
2021年4月卫生行业标准WS/T 781-2021《便携式血糖仪临床操作和质量管理指南》发布,该标准的制定充分参考了国际相关标准和循证依据、国内医疗机构便携式血糖仪应用与管理实践和专家意见。本文就便携式血糖仪医疗机构准入的性能要求和使用其进行血糖监测的质量管理要求进行解读,旨在帮助相关工作人员及管理者更好地理解和应用该标准。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分
便携式血糖仪在各级医疗机构以及糖尿病患者家庭中广为使用,有助于糖尿病患者治疗效果的监测,但因便携式血糖仪品牌、型号繁多,检测原理及检测性能也存在一定差异,不恰当的使用和结果解读有可能会对临床医师的诊疗决策及患者的医疗效果产生不利影响。
我国2002年颁布实施了卫生行业标准WS/T 226-2002《便携式血糖仪血液葡萄糖测定指南》[1],其主要采标于美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)1999年颁布的《在没有实验室支持条件下的血液葡萄糖检测》[2],该指南对使用便携式血糖仪进行血糖监测的操作人员及管理人员提出了涉及分析前、中、后环节的一般要求,但对于一些技术要点没有给出最低要求,例如医疗机构便携式血糖仪准入的技术要求、临床可接受的质量控制范围要求、与中心实验室大型生化分析仪检测结果间差异的可接受范围等。另外采标于国际标准化组织(International Organization for Standardization,ISO)《体外诊断试验系统-糖尿病管理中自我监测用血糖监测系统的要求》文件[3]的国标GB/T 19634-2005《体外诊断检验系统自测用血糖监测系统通用技术条件》[4]规定了便携式血糖仪的各项性能参数要求及具体验证方案,但主要是针对制造商的技术要求。
随着便携式血糖仪检测技术的发展,CLSI有关即时检测(point-of-care testing,POCT)的通用要求及POCT血糖监测的要求文件已更新至9项,同时ISO也在2013年更新了ISO 15197文件[5]。而WS/T 226-2002《便携式血糖仪血液葡萄糖测定指南》中部分内容已显相对陈旧[1]。2019年,国家卫生标准委员会临床检验标准专业委员会接受国家卫健委法规司委托对其进行修订,并更改标准名称为WS/T 781-2021《便携式血糖仪临床操作和质量管理指南》(后文简称《标准》),于2021年4月19日颁布。本文就便携式血糖仪医疗机构准入的性能要求和使用其进行血糖监测的质量管理要求进行解读,旨在帮助相关工作人员及管理者更好地理解和应用该标准。
新品牌、新型号的便携式血糖仪首次进入医院正式用于临床前,需选取2~3台仪器、2~3个批号的试纸进行必要的性能验证。评价指标至少包括精密度、与生化分析仪的可比性、测量区间、抗干扰性能。此外,还需确认信息化功能是否满足院内患者血糖监测和质量管理的需求。
1. 精密度(条款5.2):验证方案(附录B)详细说明,取2份肝素(或制造商推荐的抗凝剂类型)抗凝静脉血标本[红细胞压积(hematocrit,HCT)在制造商声明的适宜范围内],重复检测20次,计算标准差(standard deviation,SD)和变异系数(coefficient of variation,CV)。判断标准与GB/T 19634-2005《体外诊断检验系统自测用血糖监测系统通用技术条件》[5]的要求一致,即当血糖浓度<5.5 mmol/L时,SD<0.42 mmol/L;当血糖浓度≥5.5 mmol/L时,CV<7.5%。
2. 与生化分析仪的可比性(条款5.3):验证方案(附录C)详细说明,取肝素(或制造商推荐的抗凝剂类型)抗凝静脉血标本(HCT在制造商声明的适宜范围内)40份,每份标本使用全血进行便携式血糖仪检测,离心分离的血浆进行生化分析仪检测,为避免糖酵解带来的误差,需保证两次检测的时间间隔不超过30 min。40份标本的浓度范围要求:覆盖接近《标准》推荐的测量区间低限(2.2 mmol/L)及高限(22.2 mmol/L)、参考区间内、医学决定水平(7.0、11.0 mmol/L)。以未经人为处理的标本为宜,但低浓度与高浓度标本搜集困难时,可进行一定处理。选择血糖浓度为4~5 mmol/L的静脉血标本,将其在37 ℃孵育6 h使葡萄糖酵解,即可获得2.8 mmol/L左右的低浓度标本;加入一定稀释比例(具体根据原始标本血糖浓度计算)的5%葡萄糖注射液(277.8 mmol/L)即获得高浓度标本,需注意加入的葡萄糖注射液体积尽量小,使其对标本基质的影响最小。
判断标准综合参考国际相关指南[5, 6, 7],并经过起草及评审专家讨论,最终定为:95%以上的标本符合当血糖浓度<5.50 mmol/L时,检测结果差异在±0.83 mmol/L的范围内;当血糖浓度≥5.50 mmol/L时,检测结果差异在±15%的范围内(表1)。
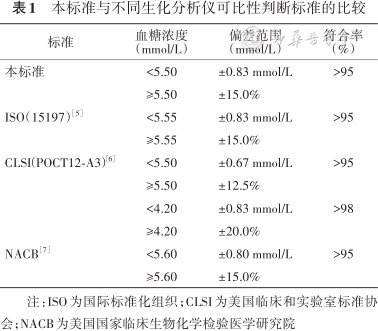
本标准与不同生化分析仪可比性判断标准的比较
本标准与不同生化分析仪可比性判断标准的比较
| 标准 | 血糖浓度(mmol/L) | 偏差范围(mmol/L) | 符合率(%) |
|---|---|---|---|
| 本标准 | <5.50 | ±0.83 mmol/L | >95 |
| ≥5.50 | ±15.0% | ||
| ISO(15197)[5] | <5.55 | ±0.83 mmol/L | >95 |
| ≥5.55 | ±15.0% | ||
| CLSI(POCT12-A3)[6] | <5.50 | ±0.67 mmol/L | >95 |
| ≥5.50 | ±12.5% | ||
| <4.20 | ±0.83 mmol/L | >98 | |
| ≥4.20 | ±20.0% | ||
| NACB[7] | <5.60 | ±0.80 mmol/L | >95 |
| ≥5.60 | ±15.0% |
注:ISO为国际标准化组织;CLSI为美国临床和实验室标准协会;NACB为美国国家临床生物化学检验医学研究院
3. 测量区间(条款5.4):目前市场上医用型便携式血糖仪测量下限可达0.6~1.1 mmol/L,测量上限可达33.5~35.0 mmol/L。临床上,糖尿病患者血糖控制目标建议毛细管血糖餐前4.4~7.2 mmol/L、餐后1~2小时<10.0 mmol/L[8];而低血糖症状一般出现于血糖<2.75 mmol/L,当血糖<1.65 mmol/L时可造成中枢神经系统严重损伤[9],因此《标准》要求便式血糖仪测量范围覆盖2.2~22.2 mmol/L即可(下限为症状性低血糖与中枢神经系统严重损伤界值的均值,上限为2倍口腹葡萄糖耐量试验2 h血糖界值),有特殊病情监测需要,且有条件的医疗机构可选择测量区间更宽的仪器。
4. 抗干扰性能(条款5.5):对便携式血糖仪检测原理的调研结果显示,54种品牌、77种型号便携式血糖仪中,59%为葡萄糖氧化酶法(glucose oxidase,GOD)、14%为黄 素 腺 嘌 呤 二 核 苷 酸 葡 萄 糖 脱 氢 酶 法(flavin adenine dinucleotide glucose dehydrogenase,FAD-GDH)、5%为葡萄糖脱氢酶法(glucose dehydrogenase,GDH)、3%为喹 啉 蛋 白 葡 萄 糖 脱 氢 酶 突 变 体 法(mutant variant of quinoprotein glucose dehydrogenase,Mut.Q-GDH)、各有1%为烟酰胺腺嘌呤二核苷酸葡萄糖脱氢酶(nicotinamide adenine dinucleotide glucose dehydrogenase,NAD-GDH)和改良GOD法,另有17%未明确说明。《标准》中(附录D)列举了常用检测方法的常见干扰因素(表2)。此外,HCT在35%~55%区间内时,便携式血糖仪通常可正常使用,当超出这个范围时,需注意便携式血糖仪检测数据的准确性。HCT偏高可导致检测结果偏低;HCT偏低可导致检测结果偏高。必要时实验室可进行抗干扰性能验证,可接受的范围为:当血糖浓度<5.50 mmol/L时,干扰物质引起的差异较空白标本不超过±0.55 mmol/L;当血糖浓度≥5.50 mmol/L时,干扰物质引起的差异较空白标本不超过±10%。
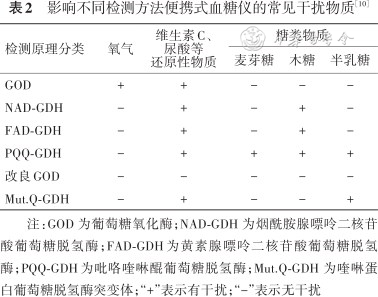
影响不同检测方法便携式血糖仪的常见干扰物质[10]
影响不同检测方法便携式血糖仪的常见干扰物质[10]
| 检测原理分类 | 氧气 | 维生素C、尿酸等还原性物质 | 糖类物质 | ||
|---|---|---|---|---|---|
| 麦芽糖 | 木糖 | 半乳糖 | |||
| GOD | + | + | - | - | - |
| NAD-GDH | - | + | - | + | - |
| FAD-GDH | - | + | - | + | - |
| PQQ-GDH | - | + | + | + | + |
| 改良GOD | - | - | - | - | - |
| Mut.Q-GDH | - | + | - | - | + |
注:GOD 为葡萄糖氧化酶;NAD-GDH 为烟酰胺腺嘌呤二核苷酸葡萄糖脱氢酶;FAD-GDH为黄素腺嘌呤二核苷酸葡萄糖脱氢酶;PQQ-GDH为吡咯喹啉醌葡萄糖脱氢酶;Mut.Q-GDH 为喹啉蛋白葡萄糖脱氢酶突变体;“+”表示有干扰;“-”表示无干扰
5. 其他性能参数:调研结果显示,市场上大部分便携式血糖仪检测用标本量≤1 μl,最大不超过3 μl;检测时间≤10 s,最长不超过25 s,符合临床需求,因此不在《标准》中做特殊要求。
6. 信息化要求(条款5.6):便携式血糖仪需能与医院信息系统(hospital information system,HIS)以及实验室信息系统(laboratory information system,LIS)相连接,或配备专用的管理软件,有助于实现全院室内质控的实时监控、试纸开瓶有效期的监控,满足医疗机构对便携式血糖仪信息化管理的要求。宜选用具有远程锁定功能的便携式血糖仪,当遇到非资格认证的操作人员、试纸超过有效期、质控失控等影响检测结果准确性的情况时,由管理人员锁定,待存在问题纠正后方可重新用于检测。
1. 院内POCT管理机构(条款6.1):POCT管理机构可由相关科室组成,包括医务管理部门(牵头)、检验科、护理部及内分泌科等,下设相关小组分管不同工作,设专人负责院内POCT管理机构工作。每家医疗机构使用的同一功能的POCT仪器品牌不宜过多。
2. 文件化(条款6.2):将便携式血糖仪质量管理相关的活动进行文件化,以制造商说明书为依据制定相应的标准化操作规程,包括标本采集、仪器操作、质量控制、结果报告、废弃物处理、仪器维护保养、试纸储存等,可根据医院具体情况进行补充或合并。《标准》的附录A提供了便携式血糖仪血糖检测标准化操作规程的范例。根据标准化操作规程制定纸质或电子记录,包括检测、质控、室间质评、各类比对实验、危急值报告、仪器校准与维护保养等,至少保存2年。
3. 人员(条款6.3):医院POCT管理机构定期组织相关操作人员的培训和考核,记录并保存培训及考核结果。经过培训且考核合格的人员经授权后方能从事临床便携式血糖仪的检测活动。培训内容至少包括:检测原理、检测流程、标本采集、质控流程和质量保证措施、仪器性能要求、血糖监测的应用价值与局限性、仪器试剂贮存条件、结果解读、误差来源、生物安全预防措施等。
4. 质量管理体系(条款6.4):质量管理体系需涵盖分析前、中、后全流程,包括末梢血的正确采集、仪器定期校准与维护保养、试纸的储存与使用管理、室内质控、规范的检测操作、结果报告要素与危急值处理流程等。
关于室内质控,《标准》要求每个检测日至少进行1次质控,包含高、低2个浓度水平。如充分评估过仪器和试剂的稳定性,可在不增加额外风险的前提下,根据评估情况制定质控频次及质控品浓度水平。如使用配套质控品,至少使用制造商提供的浓度范围作为质控范围,超出范围判定为失控;如使用第三方质控品,需参考常规定量检测项目建立质控范围,使用13S和22S质控规则。
5. 与生化分析仪的比对(条款6.5):医疗机构每年至少进行1次便携式血糖仪与检验科生化分析仪之间的方法学比对,每个医疗单元抽取每种品牌型号各1台,每台仪器比对5例标本,其中至少4例标本的检测结果符合表1中的偏差范围要求视为比对通过,比对标本制备与浓度要求、比对操作要求同新仪器初次性能评估比对。其他未进行比对的便携式血糖仪可利用日常质控或新鲜标本与参与比对的仪器进行比对评估,判断标准为4/5的检测结果差异在±10%的范围内,其中±10%为国家卫健委临检中心室间质评允许的总误差的1/2[11]。
6. 室间质评/能力验证试验(条款6.6):医疗机构每年至少参加1次国内或国外相关机构举办的室间质评/能力验证试验活动,参加的医疗单元(便携式血糖仪使用频率高、检测结果对临床决策影响大的医疗单元)宜相对固定,参加的仪器需覆盖全院使用的主要品牌,其余仪器与之进行比对,比对方案可参照生化比对方案。
《标准》发布实施后仍需要定期进行修订和完善,欢迎广大读者反馈意见和建议,为将来《标准》的修订和完善提供参考依据。
王蓓丽, 郭玮, 潘柏申. 卫生行业标准WS/T 781-2021《便携式血糖仪临床操作和质量管理指南》解读及应用[J]. 中华医学杂志, 2023, 103(25): 1946-1949. DOI: 10.3760/cma.j.cn112137-20230317-00426.
所有作者声明不存在利益冲突
1.便携式血糖仪医疗机构准入性能要求中精密度的判断标准是()
A.当血糖浓度<5.5 mmol/L时,SD<0.42 mmol/L;当血糖浓度≥5.5 mmol/L时,CV<7.5%
B.当血糖浓度<5.6 mmol/L时,SD<0.42 mmol/L;当血糖浓度≥5.6 mmol/L时,CV<7.5%
C.当血糖浓度<5.5 mmol/L时,SD<0.46 mmol/L;当血糖浓度≥5.5 mmol/L时,CV<8.5%
D.当血糖浓度<5.6 mmol/L时,SD<0.46 mmol/L;当血糖浓度≥5.6 mmol/L时,CV<8.5%
2.便携式血糖仪医疗机构准入性能要求中与生化分析仪可比性的判断标准是()
A.98%的标本符合当血糖浓度<4.2 mmol/L时,偏差在±0.83 mmol/L内;当血糖浓度≥4.2 mmol/L时,偏差百分比在±20%内
B.95%的标本符合当血糖浓度<5.5 mmol/L时,偏差在±0.67 mmol/L内;当血糖浓度≥5.5 mmol/L时,偏差百分比在±12.5%内
C.95%的标本符合当血糖浓度<5.5 mmol/L时,偏差在±0.83 mmol/L内;当血糖浓度≥5.5 mmol/L时,偏差百分比在±15%内
D.95%的标本符合当血糖浓度<5.6 mmol/L时,偏差在±0.83 mmol/L内;当血糖浓度≥5.6 mmol/L时,偏差百分比在±15%内
3.与生化分析仪可比性评估时需要检测多少份标本()
A.首次入院比对200份,每年比对40份
B.首次入院比对40份,每年比对40份
C.首次入院比对5份,每年比对5份
D.次入院比对40份,每年比对5份
4.以下关于常见干扰物质对检测方法影响叙述有误的是()
A.GOD法通常受到氧气、还原性物质干扰,不受麦芽糖和半乳糖干扰
B.HCT偏高可导致检测结果偏高,HCT偏低可导致检测结果偏低
C.FAD-GDH法通常不受氧气干扰,受还原性物质和木糖干扰
D.改良GOD法的抗干扰能力相对较强
5.以下关于医疗机构便携式血糖仪质量管理要求正确的是()
A.医疗机构内医生、护士、检验人员均可操作便携式血糖仪
B.室内质控使用Westgard多规则判断是否失控
C.充分评估过仪器和试剂的稳定性,可在不增加额外风险的前提下,根据评估情况制定室内质控频次及质控品浓度水平
D.与生化分析仪定期开展可比性评估的医疗机构无需参加室间质评/能力验证试验



























