
分析慢性子宫内膜炎(CE)对首次胚胎移植失败患者临床结局的影响。
回顾性纳入2017年1月至2021年6月在郑州大学第三附属医院生殖医学科行冻融单囊胚移植周期,共5 605个周期,患者经历了首次胚胎移植失败后,均进行宫腔镜检查,必要时子宫内膜病理检查及免疫组化联合诊断CE。分为非CE组(5 033个周期)和CE治疗组(572个周期)。主要观察指标为活产率,次要观察指标为临床妊娠率和早期流产率。本研究计量资料采用M(Q1,Q3)表示,组间比较采用秩和检验。并采用二元逻辑回归模型分析对活产率的相关因素。
首次胚胎移植失败的患者的CE发生率为10.21%(572个周期)。非CE组女方年龄为31.0(29.0,34.0)岁,CE治疗组为31.0(29.0,34.0)岁(P<0.001)。两组患者子宫内膜准备方案差异有统计学意义(P=0.010)。CE组转化日子宫内膜厚度为9.0(8.2,10.3)mm,高于非CE组的9.5(8.6,11.0)mm(P<0.001)。非CE组和CE治疗组患者的临床妊娠率[60.3%(3 035个周期)比63.1%(361个周期),P=0.193]、早期流产率[17.1%(520个周期)比20.5%(74个周期),P=0.112]、活产率[49.2%(2 477个周期)比49.3%(282个周期),P=0.969]差异均无统计学意义。女方年龄、转化日子宫内膜厚度和移植囊胚级别是活产率的相关因素,OR值(95%CI)分别为0.94(0.93~0.96)、1.10(1.06~1.14)和2.07(1.84~2.32),均P<0.001。与非CE组相比,CE治疗组并不影响移植后的活产率,OR值(95%CI)为0.99(0.82~1.18),P=0.882。
对于首次胚胎移植失败的患者,再次冻融单囊胚移植前,建议宫腔镜检查,必要时结合组织病理学和免疫组化联合筛查CE,CE患者经规范治疗后,可获得与非CE患者相似的临床妊娠率、早期流产率及活产率。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性子宫内膜炎(chronic endometritis,CE)是子宫内膜微生物与宿主免疫系统的失衡,CE的常见病原体包括粪球菌、大肠埃希菌、葡萄球菌、支原体和衣原体等。大部分的CE患者没有明显或仅有轻微症状,其患病率约为10%[1]。其病理学特点为子宫内膜间质浆细胞浸润。目前CE首选的诊断方法是通过宫腔镜结合组织病理学加CD138标记浆细胞的免疫组化学检查[2, 3]。
CE可能通过改变子宫内膜细胞因子的产生,损伤子宫内膜功能,导致子宫内膜中淋巴细胞亚群出现异常,最终可能干扰胚胎的植入,降低妊娠率[4, 5]。近年来,CE与不孕症和不良妊娠结局的关系成为研究的热点。目前的研究多集中在复发性流产和反复胚胎种植失败的患者[6, 7, 8, 9]。然而,缺少对于1次胚胎移植失败后患者的CE评估。考虑到CE的高发病率且与胚胎着床关系密切,对于首次移植失败患者进行CE的评估是有必要的。所以,本研究的目的是分析宫腔镜结合免疫组化联合筛查CE对于首次胚胎移植失败患者临床结局的影响。
本研究为回顾性队列研究。纳入2017年1月至2021年6月在郑州大学第三附属医院生殖医学科行冻融胚胎移植(frozen embryo transfer,FET)助孕的周期,共纳入5 605个FET周期。纳入标准:(1)女方年龄20~40岁;(2)既往1次胚胎移植未孕;(3)胚胎移植未孕后均行宫腔镜检查,必要时子宫内膜病理检查及免疫组化;(4)剩余至少1枚第5或6天囊胚冷冻;(5)冻融单囊胚移植。排除标准:(1)子宫畸形,包括纵隔子宫、单角子宫、双角子宫等;(2)未处理的宫腔粘连、子宫内膜息肉、子宫黏膜下子宫肌瘤或输卵管积水;(3)胚胎植入前基因学筛查周期;(4)夫妻任意一方染色体核型异常;(5)复发性流产周期;(6)重要数据记录不全周期。本研究符合《赫尔辛基宣言》伦理学要求,知情同意豁免并得到批准。
1. 子宫内膜炎的诊断与治疗:纳入患者在首次胚胎移植未孕后,均行宫腔镜检查。若镜下特点提示CE,具体表现为:子宫内膜间质水肿;局灶或弥漫性腺周充血;子宫内膜微小息肉,有蒂并伴局灶性或弥漫性的腺周充血的息肉等,进一步行子宫内膜组织病理学检查,并用CD138标记浆细胞进行常规组织学和免疫组织化学检查。若CD138阳性,诊断为CE。采取口服抗生素治疗,即多西环素0.1 g,每天2次,连用14 d[10, 11]。
2. 分组:根据宫腔镜检查结合病理+免疫组化结果,将患者分为2组,非CE组(5 033个周期)和CE治疗组(572个周期)。
3. FET方案:采用本中心常规FET方案[12, 13, 14],分为自然周期、人工周期、诱排周期和降调+人工周期4种方案。对于月经周期规律、排卵正常患者,使用自然周期准备子宫内膜。对于月经周期不规律或排卵障碍患者,根据患者时间安排,采用人工周期或诱排周期。降调+人工周期主要应用于子宫内膜异位症、子宫腺肌症或子宫肌瘤的患者。连续监测子宫内膜、卵泡发育及血清激素水平,适时转化子宫内膜,采用本中心常规黄体支持。子宫内膜转化后的5天移植1枚囊胚。囊胚评分参照Garder评分标准[15],滋养外胚层细胞及内细胞团均不为C时评为优质囊胚,两者中任一评为C则为非优质囊胚,两者均为C评为不可利用囊胚。囊胚移植后14 天行血β-人绒毛膜促性腺激素(β-human chorionic gonadotrophin,β-HCG)测定,囊胚移植后30 d行阴道超声检查。如果发生妊娠,黄体支持至少持续到移植后55 d。
1. 主要观察指标:主要观察指标为活产率,活产率=移植后妊娠≥28周活产分娩的周期数/总移植周期数×100%。
2. 次要观察指标:次要观察指标包括临床妊娠率和早期流产率,临床妊娠定义为通过超声检查观察到一个或多个孕囊而诊断为临床妊娠,包括正常宫内妊娠、异位妊娠、宫内外同时妊娠,可以仅见孕囊未见胎心,临床妊娠率=临床妊娠周期数/总移植周期数×100%。早期流产率=孕12周内的自然流产(生化妊娠除外)周期数/临床妊娠周期数×100%。
采用SPSS 22.0软件进行数据处理和统计学分析。非正态分布计量资料采用M(Q1,Q3)表示,组间比较采用Wilcoxon秩和检验。计数资料采用例(%)表示,组间比较使用χ2检验,理论频数小于5时,应采用Fisher精确检验。采用多因素logistic回归模型分析活产率的相关因素。双侧检验,检验水准α=0.05。
非CE组女方年龄为31.0(29.0,34.0)岁,CE治疗组为31.0(29.0,34.0)岁(P<0.001)。首次胚胎移植失败的患者的CE发生率为10.2%(572个周期)。两组间男方年龄、孕次、不孕类型、基础FSH、AMH和基础窦卵泡数差异均有统计学意义(均P<0.05),其余基础资料,包括体质指数、不孕时间、产次和不孕因素组间差异均无统计学意义(均P>0.05)。见表1。
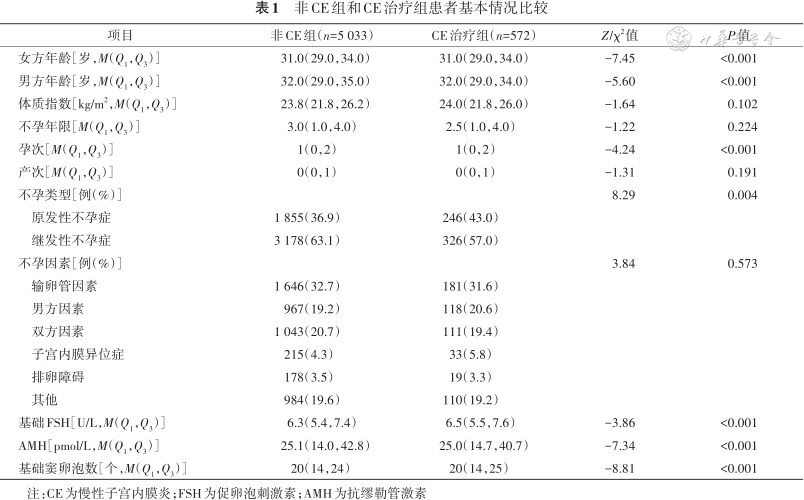
非CE组和CE治疗组患者基本情况比较
非CE组和CE治疗组患者基本情况比较
| 项目 | 非CE组(n=5 033) | CE治疗组(n=572) | Z/χ2值 | P值 |
|---|---|---|---|---|
| 女方年龄[岁,M(Q1,Q3)] | 31.0(29.0,34.0) | 31.0(29.0,34.0) | -7.45 | <0.001 |
| 男方年龄[岁,M(Q1,Q3)] | 32.0(29.0,35.0) | 32.0(29.0,34.0) | -5.60 | <0.001 |
| 体质指数[kg/m2,M(Q1,Q3)] | 23.8(21.8,26.2) | 24.0(21.8,26.0) | -1.64 | 0.102 |
| 不孕年限[M(Q1,Q3)] | 3.0(1.0,4.0) | 2.5(1.0,4.0) | -1.22 | 0.224 |
| 孕次[M(Q1,Q3)] | 1(0,2) | 1(0,2) | -4.24 | <0.001 |
| 产次[M(Q1,Q3)] | 0(0,1) | 0(0,1) | -1.31 | 0.191 |
| 不孕类型[例(%)] | 8.29 | 0.004 | ||
| 原发性不孕症 | 1 855(36.9) | 246(43.0) | ||
| 继发性不孕症 | 3 178(63.1) | 326(57.0) | ||
| 不孕因素[例(%)] | 3.84 | 0.573 | ||
| 输卵管因素 | 1 646(32.7) | 181(31.6) | ||
| 男方因素 | 967(19.2) | 118(20.6) | ||
| 双方因素 | 1 043(20.7) | 111(19.4) | ||
| 子宫内膜异位症 | 215(4.3) | 33(5.8) | ||
| 排卵障碍 | 178(3.5) | 19(3.3) | ||
| 其他 | 984(19.6) | 110(19.2) | ||
| 基础FSH[U/L,M(Q1,Q3)] | 6.3(5.4,7.4) | 6.5(5.5,7.6) | -3.86 | <0.001 |
| AMH[pmol/L,M(Q1,Q3)] | 25.1(14.0,42.8) | 25.0(14.7,40.7) | -7.34 | <0.001 |
| 基础窦卵泡数[个,M(Q1,Q3)] | 20(14,24) | 20(14,25) | -8.81 | <0.001 |
注:CE为慢性子宫内膜炎;FSH为促卵泡刺激素;AMH为抗缪勒管激素
两组患者FET周期,均进行冻融单囊胚移植。两组患者子宫内膜准备方案差异有统计学意义(P=0.010)。CE组转化日子宫内膜厚度高于非CE组(P<0.001)。两组移植优质囊胚占比相似[63.5%(3 195个周期)比63.5%(363个周期),P=0.993]。见表2。
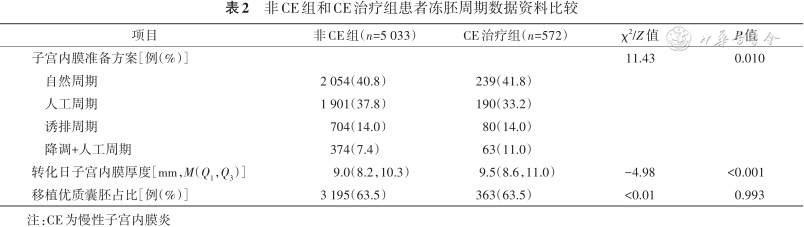
非CE组和CE治疗组患者冻胚周期数据资料比较
非CE组和CE治疗组患者冻胚周期数据资料比较
| 项目 | 非CE组(n=5 033) | CE治疗组(n=572) | χ2/Z值 | P值 |
|---|---|---|---|---|
| 子宫内膜准备方案[例(%)] | 11.43 | 0.010 | ||
| 自然周期 | 2 054(40.8) | 239(41.8) | ||
| 人工周期 | 1 901(37.8) | 190(33.2) | ||
| 诱排周期 | 704(14.0) | 80(14.0) | ||
| 降调+人工周期 | 374(7.4) | 63(11.0) | ||
| 转化日子宫内膜厚度[mm,M(Q1,Q3)] | 9.0(8.2,10.3) | 9.5(8.6,11.0) | -4.98 | <0.001 |
| 移植优质囊胚占比[例(%)] | 3 195(63.5) | 363(63.5) | <0.01 | 0.993 |
注:CE为慢性子宫内膜炎
非CE组和CE治疗组患者的临床妊娠率[60.3%(3 035个周期)比63.1%(361个周期),P=0.193]、早期流产率[17.1%(520个周期)比20.5%(74个周期),P=0.112]、活产率[49.2%(2 477个周期)比49.3%(282个周期),P=0.969]差异均无统计学意义。见表3。
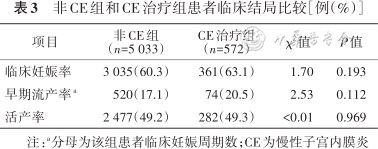
非CE组和CE治疗组患者临床结局比较[例(%)]
非CE组和CE治疗组患者临床结局比较[例(%)]
| 项目 | 非CE组(n=5 033) | CE治疗组(n=572) | χ2值 | P值 |
|---|---|---|---|---|
| 临床妊娠率 | 3 035(60.3) | 361(63.1) | 1.70 | 0.193 |
| 早期流产率a | 520(17.1) | 74(20.5) | 2.53 | 0.112 |
| 活产率 | 2 477(49.2) | 282(49.3) | <0.01 | 0.969 |
注:a分母为该组患者临床妊娠周期数;CE为慢性子宫内膜炎
女方年龄、转化日子宫内膜厚度和移植囊胚级别是活产率的相关因素,OR值(95%CI)分别为0.94(0.93~0.96)、1.10(1.06~1.14)和2.07(1.84~2.32),均P<0.001。与非CE组相比,CE治疗组并不影响移植后的活产率,OR值(95%CI)为0.99(0.82~1.18),P=0.882。详见表4。

行冻融胚胎移植助孕患者活产率相关因素的多因素logistic回归模型分析
行冻融胚胎移植助孕患者活产率相关因素的多因素logistic回归模型分析
| 因素 | β值 | SE值 | Waldχ2值 | P值 | OR值(95%CI) |
|---|---|---|---|---|---|
| 女方年龄 | -0.060 | 0.008 | 64.30 | <0.001 | 0.94(0.93~0.96) |
| 不孕年限 | 0.010 | 0.012 | 0.66 | 0.418 | 1.01(0.99~1.03) |
| 体质指数 | -0.004 | 0.008 | 0.18 | 0.669 | 1.00(0.98~1.01) |
| 不孕类型 | |||||
| 原发性不孕症 | 1.00 | ||||
| 继发性不孕症 | 0.033 | 0.064 | 0.26 | 0.610 | 1.03(0.91~1.17) |
| 子宫内膜准备方案 | |||||
| 自然周期 | 4.20 | 0.240 | |||
| 人工周期 | -0.102 | 0.067 | 2.33 | 0.127 | 0.90(0.79~1.03) |
| 诱排周期 | 0.048 | 0.088 | 0.30 | 0.583 | 1.05(0.88~1.25) |
| 降调+人工周期 | -0.101 | 0.11 | 0.84 | 0.360 | 0.90(0.73~1.12) |
| 基础FSH | -0.026 | 0.014 | 3.19 | 0.074 | 0.98(0.95~1.00) |
| 窦卵泡数 | <0.001 | 0.002 | <0.01 | 0.949 | 1.00(1.00~1.00) |
| 转化日子宫内膜厚度 | 0.094 | 0.018 | 27.17 | <0.001 | 1.10(1.06~1.14) |
| 移植囊胚级别 | |||||
| 非优质囊胚 | 1.00 | ||||
| 优质囊胚 | 0.726 | 0.059 | 150.01 | <0.001 | 2.07(1.84~2.32) |
| 是否患子宫内膜炎 | |||||
| 非CE组 | 1.00 | ||||
| CE治疗组 | -0.014 | 0.092 | 0.02 | 0.882 | 0.99(0.82~1.18) |
注:FSH为促卵泡刺激素;CE为子宫内膜炎
通过本中心的回顾性队列研究表明,对于首次胚胎移植失败的患者,宫腔镜结合组织病理学和免疫组化联合筛查CE并规范治疗后,在后续的冻融单囊胚移植周期中,可获得与非CE患者相似的临床结局。
CE对生育的影响是近些年研究的重点和热点之一。CE可能通过多种途径影响胚胎的着床和临床结局,其中具体机制尚不明确,主要研究集中在炎症反应因子和性激素受体改变两方面。第一,炎症因子的改变可影响子宫内膜容受性。与非CE患者相比,CE患者子宫内膜中局部炎症基因表达降低,包括IL-11和趋化因子配体4,并产生促炎性细胞因子[16]。同时,CE患者子宫内膜由于浆细胞的浸润,可导致子宫内膜中IgM、IgA和IgG的表达高于非CE患者[17, 18]。有研究认为,宫腔定植微生物是其影响生育的原因之一,微生物的入侵,通过uNK细胞激活和T细胞亚群异常分化等机制影响子宫内膜的免疫环境[19, 20]。第二,CE可以改变子宫内膜的性激素受体,影响子宫内膜蜕膜化的过程[21]。从CE合并不孕症患者中获得的子宫内膜样本,存在高达三分之一的患者表现出子宫内膜分化延迟[18]。
鉴于CE的高发病率以及其对生殖的影响,目前多数研究建议对于复发性流产或反复种植失败的患者进行CE评估并积极治疗[9,22, 23]。然而,对于首次胚胎移植失败患者CE评估的研究较少。2022年的一项研究纳入了2 073名首次胚胎移植失败患者,评估宫腔镜子宫内膜活检和CD38、CD138联合筛查CE以及治疗后再次胚胎移植的妊娠结局,建议在胚胎移植前进行CE评估并行必要的药物治疗[24]。另外一项回顾性研究,纳入141例既往一次移植失败的患者,结果表明CD138阴性的患者的临床妊娠率和胚胎着床率(分别为80.04%和64.9%)显著高于CD138阳性患者(分别为52.7%和46.8%)[25]。然而,目前对于首次胚胎移植失败后的患者,尚缺乏高质量的研究来探讨是否应常规进行宫腔镜检查排除宫腔方面的因素,本研究在与患者进行充分沟通后,对首次移植失败的患者进行宫腔镜检查,检查发现高达10.21%的患者确诊CE,通过规范治疗后,可获得与非CE患者相似的临床结局,所以,对于首次移植失败的患者,进行宫腔镜检查存在一定的临床意义和价值,但仍需大数据的临床研究进一步分析。
本研究属于单中心研究,数据量大,宫腔镜检查和病理评估均由我院专科医师进行,检查以及诊断标准的一致性高。本研究的主要局限在于回顾性研究的性质,两组患者基础资料存在一定差异。此外,本研究的CE诊断依据子宫内膜宫腔镜镜下特点,决定是否进一步子宫内膜组织病理学和免疫组化检查。所以,并非所有患者均进行病理学检查,存在一定假阴性的可能。但根据目前的研究结果认为,宫腔镜对CE的诊断准确性高,与组织病理学的符合率高达93%[26, 27],所以综合考虑患者意愿、诊断的准确性和医疗花费等因素,在实际临床诊疗中,并非所有患者均行子宫内膜病理学检查。
综上,对于首次胚胎移植失败的患者,再次冻融单囊胚移植前,建议宫腔镜检查,必要时结合组织病理和免疫组化联合筛查CE,经规范治疗后,可获得与非CE患者相似的临床妊娠率和活产率。
杜明泽, 张俊韦, 魏占才, 等. 慢性子宫内膜炎对首次胚胎移植失败患者临床结局的影响[J]. 中华医学杂志, 2023, 103(28): 2157-2162. DOI: 10.3760/cma.j.cn112137-20221127-02517.
所有作者声明不存在利益冲突



























