
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,62岁。因血肌酐升高20 d于2014年2月19日收入我院肾内科。2014年1月患者劳累后出现咳嗽,咳黄痰,体温正常,自服头孢克洛(0.25 g, 3次/d)3 d后出现眼睑、面部水肿,尿量自1 500 ml/d减至300 ml/d,期间饮水量如常。1月28日就诊外院,测血压165/93 mmHg(1 mmHg=0.133 kPa),查血肌酐456 μmol/L。2月3日出现无尿,查血肌酐1 067 μmol/L,血钾6.9 mmol/L。肾脏超声:双肾弥漫性病变,皮质变薄,双肾盂少量积水,左肾长径13.9 cm,右肾长径9.6 cm。考虑"慢性肾衰竭",予规律血液透析(每周3次,每次4 h),使用硝苯地平控释片(30 mg,2次/d)、美托洛尔(25 mg,2次/d)治疗,患者水肿消退,血压控制于129~140/70~85 mmHg。2月19日转诊我院。既往史:2010年无明显诱因出现皮肤、巩膜黄染,便色变浅,外院查总胆红素(TBil)110.4 μmol/L,直接胆红素(DBil)81.1 μmol/L。腹部CT:胰头肿胀,肝内外胆管扩张,胆囊、胆囊管和胆总管扩张。超声内镜见胰头部低回声大小约2.5 cm×2.0 cm,行穿刺活检未见恶性细胞。予多烯磷脂酰胆碱(556 mg,3次/d)保肝、熊去氧胆酸(250 mg,1次/d)退黄治疗2个月后黄疸逐渐缓解。2012年4月无意中发觉双侧腮腺肿大并逐步增大至鸡蛋大小,行左颌下及左腮腺结节针吸涂片,病理见增生的淋巴细胞及嗜酸性粒细胞,考虑"嗜酸细胞淋巴肉芽肿"。服用中药(具体不详)2月余后肿块缩小。否认高血压、糖尿病等病史。体检:体温36.0℃,心率64次/min,呼吸18次/min,血压131/79 mmHg;双耳前可扪及肿大腮腺,左4 cm×5 cm,右2 cm×3 cm,质硬,表面结节感,形状不规则,有压痛;心、肺、腹未见明显异常;双下肢无明显水肿。实验室检查:WBC 5.34×109/L,嗜酸性粒细胞计数(Eos) 0.54×109/L, Hb 94 g/L, PLT 309×109/L;白蛋白31 g/L,ALT 12U/L,TBil 5.7 μmol/L,DBil 1.9 μmol/L,血肌酐997 μmol/L,尿素氮24.89 mmol/L,血钾6.0 mmol/L,血钙2.21 mmol/L,血磷2.65 mmol/L;ESR 68 mm/1h,高敏C反应蛋白6.07 mg/L。涎腺超声:左右侧颌下腺、双侧腮腺多发低回声。
患者中老年女性,急性病程,近期于呼吸道感染后出现尿量减少和血肌酐升高,伴水、电解质紊乱,存在肾衰竭。外院超声提示双肾皮质变薄和右肾缩小,结合贫血和血磷升高,考虑存在慢性肾脏病。但需要注意的是,患者尿量迅速减少至无尿,且血肌酐一周内较之前水平升高50%,符合改善肾脏病整体预后工作组(KDIGO)推荐的急性肾损伤(AKI)的诊断标准[1],因此需考虑在慢性肾脏病的基础上合并AKI。
导致AKI的原因需考虑三方面:(1)肾前性:患者无明显入量减少,亦无体温升高等使不显性失水明显增多的情况,可能性不大。(2)肾后性:外院超声发现肾盂积水,提示肾后性梗阻,入院后有必要行泌尿系统影像学检查进一步明确梗阻部位。(3)肾性:患者呼吸道感染后出现AKI,合并水肿、高血压,需考虑感染后急性肾小球肾炎的可能;感染期间曾使用头孢克洛,因此药物引发的急性肾小管坏死(ATN)也需考虑;血肌酐短时间内进行性升高,合并贫血和炎性指标明显升高,需警惕急进性肾小球肾炎(RPGN),因此需完善抗肾小球基底膜(GBM)抗体、抗核抗体(ANA)、抗可提取核抗原(ENA)抗体和抗中性粒细胞胞浆抗体(ANCA)等筛查;此外,患者中老年,肾衰竭合并贫血及ESR增快,还需警惕多发性骨髓瘤、副蛋白肾病等可能。
进一步完善相关检查:抗溶血性链球菌素O 27.6 IU/ml;补体C3 0.647 g/L(参考值:0.73~1.46 g/L),补体C4 0.217 g/L;ANA、抗ENA抗体、ANCA、抗GBM抗体均阴性;IgG 17.13 g/L(参考值:7.00~17.00 g/L),IgA 1.14 g/L,IgM 0.50 g/L;总IgE 187 kU/L(参考值:0~60 kU/L);血清蛋白电泳、血免疫固定电泳未见单克隆蛋白。胸腹盆CT:部分纵隔淋巴结稍肿大;胰头饱满,胆总管增宽;左肾增大,双肾积水(轻中度);双侧髂动脉、输尿管盆段周围软组织密度影,腹膜后纤维化不除外(图1、图2)。磁共振尿路成像MRU:双侧尿路梗阻,肾盂输尿管积水,梗阻位于小骨盆入口处第二狭窄,右肾形态及信号异常(凹凸不平,体积缩小,肾实质变薄,皮髓质分界不清)。
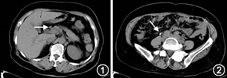

至此,患者肾后性梗阻部位明确,腹膜后纤维化所致可能性大,因目前原发病未明,需尽快解除肾后性梗阻有利于肾功能恢复。入院后继续予血液透析支持,2月20日行D–J管置入术,右侧置管顺利,左侧受阻,反复尝试未能置管。术后尿量增至40~100 ml/d,2月25日复查透前血肌酐1 150 μmol/L,尿素氮28.59 mmol/L。肾脏超声检查:双肾盂、肾盏扩张,右肾盂宽1.9 cm,左肾盂宽1.5 cm。
尝试D–J管放置后,尿量仅少许增多,血肌酐不降反升,双肾盂仍存在扩张,尽管单侧置管未成功可以解释部分病情,但整体考虑肾后性梗阻仍未解除或在此基础上合并其他如肾性因素导致的AKI。回顾患者既往病史:4年前查胰腺肿胀,2年前查腮腺肿大,均未明确诊断。因此,患者具备多脏器受累的特点,累及脏器包括涎腺、胰腺、肾及输尿管,故从感染、肿瘤、免疫病三方面进行剖析。(1)感染:特殊的细菌感染如结核可导致全身多脏器受累,结核累及肾脏时亦可出现肾积水和血肌酐升高,但肾结核常限于单侧,典型表现为脓尿和尿路刺激征,影像学可见感染侧肾脏出现片状、云絮或斑块状钙化灶,而肾积水则出现于健侧,与患者的临床表现不符;此外,病程中无盗汗、低热等结核中毒症状,涎腺超声、腹盆CT检查未见肺外结核常出现的淋巴结炎,考虑结核可能性小,可进一步行PPD检查、尿抗酸染色,必要时完善受累脏器活检,明确有无肉芽肿性炎症及抗酸杆菌。(2)肿瘤:原发和转移病灶或副肿瘤综合征可表现为多器官受累,但患者既往胰腺、腮腺穿刺涂片均未见肿瘤细胞;影像学新见的输尿管梗阻需警惕占位如输尿管肿瘤的可能,但后者临床症状多限于局部,患者临床受累的腮腺和胰腺均不是肿瘤转移的常见部位。因此,肿瘤证据不足,可进一步完善肿瘤标记物检查,必要时完善受累脏器活检。(3)免疫病:患者病程中无皮疹、关节痛等自身免疫病常见的症状和体征,ANA、抗ENA抗体、ANCA均阴性,常见的结缔组织病、血管炎等疾病证据不足;但入院检查中,患者IgG水平升高,结合既往胰腺和腮腺受累的特点,需要考虑IgG4相关疾病的可能性。IgG4相关疾病是一组系统性炎症纤维化的疾病,常累及腮腺、泪腺、胰腺、胆道、肾脏、腹膜后组织等多个器官与系统,通常以单个或多个器官肿大起病,有特殊病理表现,多伴有血清IgG4升高[2]。患者症状和体征与IgG4相关疾病相符,可进一步完善血清IgG亚型和受累组织病理检查。因肾穿刺活检存在禁忌(右肾体积缩小、肾实质变薄,左肾后梗阻尚未解除),胰腺组织活检取材相对困难且风险较高,首选腮腺作为活检部位。
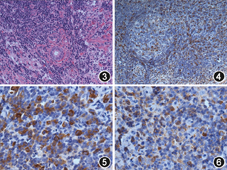
进一步完善检查:PPD、尿抗酸染色阴性;肿瘤标记物细胞白蛋白19片段(Cyfra21–1) 4.11 ng/ml(参考值:0~3.5 ng/ml),余均在正常范围;血清IgG亚型:IgG1 8 830 mg/L,IgG2 2 620 mg/L,IgG3 172 mg/L,IgG4 14 100 mg/L(参考值:80~1 400 mg/L)。腮腺活检:涎腺组织显慢性炎症,伴纤维组织及多量淋巴细胞、浆细胞浸润,免疫组化:CD138、CD38、IgG、IgG4阳性(图3, 图4, 图5, 图6)。

根据2011年IgG4相关疾病诊断标准[3]:(1)1个或多个器官弥漫性/局限性肿大或肿块形成;(2)血清IgG4≥1 350 mg/L;(3)组织病理学见:①显著淋巴细胞、浆细胞浸润和纤维化;②IgG4阳性浆细胞浸润:IgG4阳性/IgG阳性细胞>40%,且IgG4阳性浆细胞>10个/高倍视野。同时满足上述3条者确诊IgG4相关疾病,若不能满足(2)或(3)为可能IgG4相关疾病。诊断IgG4相关疾病需排除肿瘤和类似疾病(如干燥综合征、Castleman病等)。本例患者满足IgG4相关疾病的确诊条件。
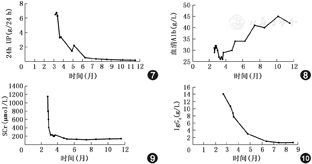
IgG4相关疾病的治疗首选激素。2月26日加用泼尼松65 mg 1次/d(1 mg/kg),2月27日双侧腮腺即出现缩小,尿量明显增至2 000 ml/d。尿常规:蛋白1g/L,潜血80红细胞/μl,异形红细胞比20%;24 h尿蛋白6.5g/24 h;尿蛋白电泳:肾小球来源100%;尿β2–微球蛋白21.8 mg/L,尿氨基葡萄糖肌酐比(U–NAG/Cr)3.68 U/mmol。血磷脂酶A2受体阴性。血IgG4、血肌酐、24h尿蛋白和白蛋白的变化见图7,图8,图9,图10。

糖皮质激素治疗后患者尿量明显增加,腮腺缩小,血肌酐在数日内降至200 μmol/L左右,提示治疗有效,肾后性梗阻解除和AKI好转,但进一步的尿检发现24 h尿蛋白大于3 g/24 h,即达到肾病范围蛋白尿,尿蛋白电泳提示尿蛋白从肾小球漏出,在治疗初期白蛋白一度降至25g/L,符合肾病综合征,提示存在肾小球病变,检查发现尿β2–MG、NAG/Cr增高,提示合并肾小管损伤。因患者仍存在肾穿刺禁忌,无法明确肾脏病变性质。但患者IgG4相关疾病诊断明确,从一元论的角度出发,肾病综合征需考虑IgG4相关疾病的肾脏受累。
IgG4相关疾病泌尿系统损害最常见的表现为肾小管间质性肾炎(IgG4–TIN)[4,5];此后陆续有IgG4相关膜性肾病(IgG4–MGN)、系膜增生性肾小球肾炎、局灶性节段性肾小球肾炎的报道[4,6]。此外还有IgG4相关疾病相关的腹膜后纤维化、前列腺炎或输尿管炎性改变所导致的肾后性梗阻性肾病[7]。患者突出的临床特点为AKI和肾病综合征,尿液检查提示存在肾小球病变和肾小管损伤,结合AKI迅速缓解的情况,肾小管损伤可能由IgG4–TIN导致,但不除外有继发于肾后性梗阻或肾小球病变的成分。从血肌酐变化趋势图来看,早期血肌酐迅速下降可能与加用激素后肾后性梗阻或IgG4–TIN的缓解有关,后期进入平台期后血肌酐仍稍高于正常范围,与第一次临床讨论分析的慢性肾脏病基础相符。
IgG4相关疾病导致的肾小球病变最常见的病理类型为IgG4–MGN。Alexander等[8]总结9例肾脏病理证实为膜性肾病(MGN)的IgG4相关疾病患者,其中5例合并IgG4–TIN,所有患者表现为中至大量蛋白尿(平均为8.3 g/d),其中8例肾小球组织行PLA2R免疫组化分析,其结果均为阴性,提示MGN继发于IgG4相关疾病。肾小球基底膜PLA2R和血抗PLA2R抗体的检出提示原发性MGN,其敏感度高达74%和57%[9]。Miyata等[10]分析了15例IgG4–MGN患者的治疗方案及效果,13例病初予激素单药治疗,7例因血肌酐、24 h尿蛋白持续较高最终加用免疫抑制剂,其中1例加用环磷酰胺治疗后随访7个月,24 h尿蛋白由4.5g降至0.7g,血肌酐由159.1 μmol/L(1.8 mg/dl)降至123.8 μmol/L(1.4 mg/dl)。本例患者未能行肾穿刺明确病理类型,但从临床分析,肾病综合征足量激素治疗1个月仍存在大量蛋白尿,血清抗PLA2R抗体为阴性,结合MGN为IgG4相关性肾病肾小球病变的最常见类型,考虑患者肾脏病理不除外合并IgG4–MGN的可能性。治疗方面,单药激素治疗效果可能不佳,需加用免疫抑制剂,故于3月28日起加用环磷酰胺(0.4 g,1次/d)联合治疗。
随访:至2014年11月17日,患者继续免疫抑制治疗,泼尼松减至25 mg、1次/d,环磷酰胺累积剂量至11 g后停用,后续硫唑嘌呤(50 mg,1次/d)。11月17日查血肌酐142 μmol/L,白蛋白42 g/L,24 h尿蛋白0.17 g。2014年10月复查泌尿系超声:双侧肾盂、输尿管未见积水。


























