
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
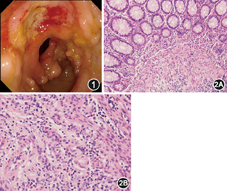
患者女,41岁。因"反复腹痛9年,加重6个月"于2013年9月11日入院。患者于2004年无诱因出现脐周隐痛,每次发作持续约1~2 h,伴发热、乏力,最高体温达39.4℃,无恶心、呕吐,抗感染治疗后腹痛、发热缓解。2007年考虑阑尾炎,行阑尾切除术,术后症状无明显改善。2013年3月腹痛程度及频率较前加重,为脐周及右下腹阵发性绞痛,腹泻与便秘交替出现,伴间断发热,最高体温同前。2013年8月当地医院行结肠镜检查见结肠多发溃疡,考虑为克罗恩病,予口服美沙拉嗪治疗,无明显效果。病程中反复出现口腔溃疡、外阴溃疡,结膜沙粒感,无畏光、流泪、视物模糊,无皮疹、脱发、光过敏、关节肿痛。既往史:发现乙型肝炎、丙型肝炎10余年,否认输血史。体检:双眼睑结膜充血,全身浅表淋巴结未触及肿大,无皮疹,心肺未见明显异常,腹部未见肠型,肠鸣音正常,触软,未触及包块、压痛及反跳痛。为进一步诊治收入我院。入院后完善辅助检查,血常规:WBC 3.14×109/L,Hb 97 g/L,PLT 274×109/L;尿常规、粪常规正常。血生化:ALT 10 U/L,AST 13 U/L,总蛋白79 g/L,白蛋白33 g/L,TBil 9.6 μmol/L,DBil 3.4 μmol/L。乙型肝炎五项:HBsAg(+),抗–HBs(–),HBeAg(–),抗–HBe(+),抗–HBc(+),HBV DNA定量<103 copies/ml;抗–HCV(+),HCV RNA定量3.35×106 copies/ml,HCV基因分型为2型;结核感染T细胞斑点试验(T–SPOT.TB)(–),PPD(–)。ESR 86 mm/1h,补体C3为0.818 g/L(参考值0.900~1.800 g/L),补体C4为0.025 g/L(参考值0.100~0.400 g/L),IgG 14.55 g/L(参考值7.00~17.00 g/L),IgA 2.1 g/L(参考值0.7~4.0 g/L),IgM 22.4 g/L(参考值0.4~2.3 g/L),IgMκ(+),冷球蛋白(+),超敏C反应蛋白(hsCRP) 12.07 mg/L;类风湿因子(RF) 17 485 U/ml(参考值0~20 U/ml),抗核抗体(ANA)、抗可溶性抗原(ENA)抗体、抗中性粒细胞胞质抗体(ANCA)均阴性,血清抗酿酒酵母抗体(ASCA)–IgA 42 RU/ml。针刺试验(–)。胸部CT:左舌叶散在小结节影。胃镜:慢性浅表性胃炎。结肠镜:进镜至回肠末段约20 cm,小肠黏膜未见明显异常,回盲瓣变形,其旁可见1个类圆形溃疡(图1),直径约2.0 cm,盲袋挛缩变形,升结肠短缩,降结肠及乙状结肠可见多发溃疡,直径约0.5~1.0 cm。(回盲部)病理:结肠黏膜慢性炎伴固有层较多嗜酸粒细胞浸润,局部黏膜下层见小血管炎(图2),抗酸染色未找到抗酸杆菌。眼科会诊考虑变应性结膜炎及淋巴管扩张可能。

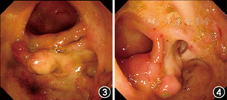
综合上述病史及辅助检查结果,考虑慢性乙型肝炎、慢性丙型肝炎、冷球蛋白血症诊断明确。结合病程中曾出现反复口腔溃疡、外阴溃疡,结肠病理提示小血管炎,考虑贝赫切特病可能性大,冷球蛋白血症相关性血管炎不除外。经感染科、免疫科会诊,制定治疗方案。2013年9月25日开始给予拉米夫定100 mg/d;2周后给予甲泼尼龙40 mg/d静脉点滴,患者腹痛明显好转,2周后过渡为泼尼松40 mg/d口服,每2周减量5 mg。2013年12月,当时泼尼松剂量为20 mg/d,患者腹痛较前加重,复查结肠镜提示病变较前无明显好转。经会诊,考虑肠道表现不除外冷球蛋白血症相关性血管炎。于2014年1月开始抗HCV治疗,皮下注射聚乙二醇干扰素α(PEG–IFNα)2a 180 μg,每周1次,利巴韦林400 mg,2次/d,症状缓解。2014年2月及4月复查HCV RNA转阴,2014年5月复查ESR 57 mm/1h,IgM 8.86 g/L,RF 8 544 U/ml,均较前明显好转。结肠镜:进镜至回肠末段约5 cm,小肠黏膜可见散在糜烂及浅溃疡,既往回盲瓣旁溃疡愈合,升结肠、横结肠、降结肠、乙状结肠及直肠可见多发不规则浅溃疡,直径约0.2~0.4 cm,病变较前明显好转(图3)。2014年7月停药。2014年8月患者再次出现腹痛,同时出现双膝、肩、肘、腕、掌指及近端指间关节酸痛,无皮疹、紫癜。2014年10月复查HCV RNA定量3.11×106 copies/ml,hsCRP 16.71 mg/L,ESR 75 mm/1h,结肠镜提示回盲瓣、升结肠、横结肠、降结肠及乙状结肠可见多发息肉样隆起,升结肠较为明显,未见明显溃疡(图4)。考虑病情与HCV活动相平行,经感染科、免疫科会诊,于2014年10月24日再次加用PEG–IFNα–2a及利巴韦林治疗。考虑存在冷球蛋白血症相关血管炎,于2014年10月31日加用静脉甲泼尼龙40 mg/d联合静脉环磷酰胺0.4 g/周,患者腹痛及关节痛较前明显好转。2015年1月随诊病情稳定。

冷球蛋白血症是一种主要累及中–小动静脉,以血管内循环免疫复合物沉积为特征的血管炎。HCV是冷球蛋白血症最常见病因之一。本例患者中年女性,慢性病程,以腹痛、结肠溃疡为主要表现,诊断和治疗过程曲折。患者有口腔、外阴溃疡等贝赫切特病表现,辅助检查虽可证实存在HCV相关冷球蛋白血症,但缺乏冷球蛋白血症相关血管炎的系统性受累证据(如皮肤、肾脏、关节等),因此诊断极为困难。给予患者糖皮质激素治疗的初期阶段,虽症状控制但结肠溃疡无明显改善。调整思路,给予抗HCV治疗,肠道溃疡明显好转并逐渐愈合。由此,考虑肠道溃疡的病因为HCV相关冷球蛋白血症性血管炎所致。
冷球蛋白是一种体外温度低于37℃时发生沉淀的单克隆或多克隆免疫球蛋白。冷球蛋白血症是免疫复合物介导的系统性血管炎,根据病因是否明确分为原发性和继发性,其中继发性冷球蛋白血症病因包括感染、免疫和肿瘤,大多数由HCV感染引起。冷球蛋白血症的流行和分布尚不十分清楚,好发于45~65岁女性,男女比例(2~3):1[1]。
尽管继发性冷球蛋白血症患者中HCV检出率可高达90%,然而仅2%~3%HCV患者有明显的血管炎表现[2]。紫癜、关节痛及乏力三联征是最常见的临床表现。
文献报道,该病较少累及消化系统(7%)[1]、呼吸系统、心血管系统及中枢神经系统。但HCV相关性冷球蛋白血症一旦累及消化系统,可危及生命,如胃肠道出血、肠缺血、急性胰腺炎等[3],也有关于导致胃肠道溃疡的报道,但临床更加少见。在PubMed中可以检索到HCV相关性冷球蛋白血症导致胃肠道溃疡的报道共有6例,其中2例经手术病理确诊,其余4例因有皮疹、关节痛或肾脏受累,临床诊断成立。诊断需结合HCV感染、临床表现、血清学指标(如冷球蛋白、免疫球蛋白、补体降低及RF升高)及病理特点[4]。
PEG–IFNα联合利巴韦林抗病毒治疗是HCV相关性冷球蛋白血症治疗的基础,同时是轻–中度患者的一线治疗方案。对于基因2型HCV,建议给予每周1次的PEG–IFNα 180 μg联合利巴韦林800 mg/d,共治疗24周。糖皮质激素和免疫抑制剂(如环磷酰胺)治疗HCV相关性冷球蛋白血症性血管炎的经验来源于其他系统性血管炎,但目前尚缺乏临床试验研究,通常用于重型患者急性症状的诱导缓解[4]。血浆置换可用于重型患者,特别是合并肾小球肾炎患者的辅助治疗,但因不能防止冷球蛋白的产生,故无长期疗效。若上述治疗均无效,则需考虑生物制剂(如利妥昔单抗)治疗[5]。
希望本病例报道能开阔临床医师对肠道溃疡鉴别诊断的视野。系统性疾病消化道受累往往表现多样,不典型病例诊断困难,在密切随诊和治疗中一步步修正关于疾病的诊断至关重要。


























