
慢性游走性红斑(erythema migrans,EM)是莱姆病皮肤损害的特征性表现,罕有累及皮下脂肪组织的报道。本例莱姆病合并脂膜炎患者无其他感染、自身免疫病及肿瘤等所致脂膜炎的确切证据,临床上考虑脂膜炎可能与螺旋体感染相关。本病需与结节性红斑、硬红斑、深部红斑狼疮、皮下脂膜炎样T细胞淋巴瘤等鉴别,治疗方法与预后尚不清楚,值得临床重视。

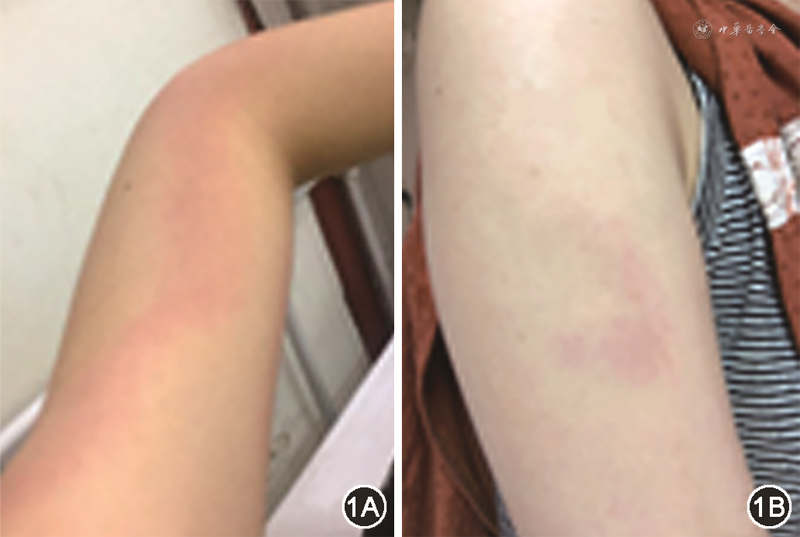
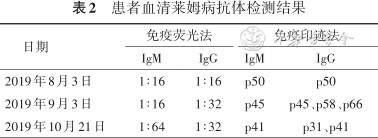
患者女,25岁,辽宁籍。因“反复游走性红斑1年余,结节性红斑样皮损10个月”于2020年3月26日就诊我院。2019年1月6—13日患者至捷克等地出差,出差过程中未去过野外灌木林,否认蜱虫叮咬及外伤史。2019年2月5日患者左上臂外侧出现硬币大小红斑,质硬,伴肿胀、压痛,随后红斑范围扩大(图1A),并出现左侧腋窝淋巴结肿痛,无发热、关节痛等其他不适。2019年4月22日患者于牡丹江林业中心医院查Lyme-IgG阳性,诊断“莱姆病”,主要诊治经过见表1。2019年8、9、10月在当地疾病控制中心查血清莱姆病抗体均阳性(表2)。2020年3月26日患者来我院就诊时右上臂伸侧可见一弓形红斑(图1B),局部压痛,无其他阳性体征。复查血常规、C反应蛋白(CRP)、抗链球菌溶血素“O”、免疫球蛋白与补体、抗核抗体、抗Sm抗体、抗双链DNA抗体、抗中性粒细胞胞质抗体(ANCA)等及乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、人类免疫缺陷病毒(HIV)、梅毒、巨细胞病毒(CMV)、EB病毒(EBV)等抗体及结核感染T细胞斑点试验(T-SPOT.TB)等均阴性,心电图、心脏超声、双侧膝关节平片等未见异常。数天后红斑自行消退。2020年5月患者腰部新发数个痛性皮下斑块;正电子发射计算机断层显像CT(PET-CT)示皮下絮状稍高密度影,代谢增高,考虑炎性病变;活检示脂肪组织中见多量炎细胞浸润,部分围绕血管分布(图2),免疫组化CD20(散在+),CD138(-),CD3(部分+),CD5(部分+),CD4(部分+),CD8(部分+),Ki-67(+20%),CD2(部分+),CD30(个别+),CD7(部分+),CD56(散在+),granzyme B(散在+),TIA-1(散在+),原位杂交EBER(-),T细胞克隆性基因重排(-);特染及培养未见病原体,螺旋体及分枝杆菌核酸检测阴性。考虑诊断为脂膜炎,予泼尼松口服40 mg/d,每10天减量5 mg,最后以5 mg/d维持;甲氨蝶呤12.5 mg,1次/周治疗。1周后皮下斑块消退,复查各项指标正常,2020年7月病情好转出院,嘱出院后定期复诊。


患者来北京协和医院就诊前主要的临床表现及诊治经过
患者来北京协和医院就诊前主要的临床表现及诊治经过
| 日期 | 主要表现 | 辅助检查 | 治疗及转归 |
|---|---|---|---|
| 2019年2月 | 左上臂单个游走性红斑,伴左侧腋窝淋巴结肿痛 | 超声示左臂浅筋膜水肿、增厚 | 头孢菌素(具体不详)静脉点滴12 d,红斑及肿大淋巴结消退 |
| 2019年3月 | 左上臂单个游走性红斑 | 皮损活检示真皮层血管周围淋巴细胞浸润,皮下脂肪小叶淋巴细胞、嗜中性粒细胞浸润,未见血管炎及脂肪坏死 | 多西环素口服10 d无效 |
| 2019年4月 | 左上臂少许红斑 | 血清莱姆病IgG抗体阳性;诊断“莱姆病” | 头孢曲松静脉点滴3 g/次,1次/d;多西环素口服100 mg/次,3次/d,治疗20 d后红斑消退 |
| 2019年5月 | 左腰部皮下斑块 | 超声示局部浅筋膜水肿、增厚,约7 cm×2 cm | 多西环素100 mg/次,3次/d口服12 d,斑块消退 |
| 2019年8月 | 右上臂3个结节性红斑样皮损,伴发热、乏力、头痛 | 再次查血清莱姆病抗体阳性 | 头孢曲松2 g/次,1次/d静脉点滴5周后红斑消退、体温复常 |
| 2019年11月 | 右上臂单个游走性红斑,左大腿内侧数个结节性红斑样皮损,伴发热 | 血常规、CRP、PCT、免疫球蛋白与补体均正常,ANA、抗Sm抗体、抗dsDNA抗体、ANCA、抗磷脂抗体等阴性;HBV、HCV、HIV、梅毒、CMV、EBV等抗体及结核T-SPOT等均阴性;心电图、心脏超声、双侧膝关节平片均未见异常;脑脊液常规、生化及病原体二代测序(mNGS)未见异常 | 阿莫西林静脉点滴1g/次,1次/6h;米诺环素口服100 mg/次,2次/d治疗4周,发热、皮损无改善;得宝松1 ml 肌肉注射1次,体温随即复常,数日后右上臂及左大腿皮损消退 |
| 2020年2月 | 右上臂数个结节性红斑样皮损 | 阿莫西林0.5 g/次,3次/d及米诺环素100 mg/次,2次/d口服共2周,皮损无好转 |
注:CRP为C反应蛋白;PCT为降钙素原;ANA为抗核抗体;dsDNA为双链DNA;ANCA为抗中性粒细胞胞质抗体;HBV为乙型肝炎病毒;HCV为丙型肝炎病毒;HIV为人类免疫缺陷病毒;CMV为巨细胞病毒;EBV为EB病毒;T-SPOT为T细胞斑点试验
患者血清莱姆病抗体检测结果
患者血清莱姆病抗体检测结果
| 日期 | 免疫荧光法 | 免疫印迹法 | ||
|---|---|---|---|---|
| IgM | IgG | IgM | IgG | |
| 2019年8月3日 | 1∶16 | 1∶16 | p50 | p50 |
| 2019年9月3日 | 1∶16 | 1∶32 | p45 | p45、p58、p66 |
| 2019年10月21日 | 1∶64 | 1∶32 | p41 | p31、p41 |

莱姆病是一种由伯氏疏螺旋体(Borrelia burgdorferi)引起的经硬蜱叮咬传播的自然疫源性疾病,临床表现复杂多样,常涉及皮肤、神经、心脏及关节等多系统损害[1]。受累组织或器官与感染螺旋体基因型相关。皮肤是莱姆病最常累及部位,目前已知6种对人致病基因型,包括狭义伯氏(B. burgdorferi sensu stricto)、阿氏(B. afzelii)、伽氏(B. garinii)、斯氏(B. spielmanii)、巴伐利亚(B. bavariensis)和梅奥疏螺旋体(B. mayonii)均可引起皮肤损害,其中以阿氏疏螺旋体最为突出,80%感染者以皮损为唯一表现[2]。未经治疗者随病程进展可出现游走性红斑、莱姆性淋巴细胞瘤、慢性萎缩性肢端皮炎等。蜱叮咬部位单发游走性红斑是局部皮肤损害期(1期)的特征性改变,常见为3~33d内出现的逐日扩大的环状红斑,直径多大于5 cm,2~3周自行消退。游走性红斑发生后数周至数月内,25%~50%的患者可继发除掌、跖皮肤及黏膜外部位的多发游走性红斑,皮损略小,无硬结中心,较少移行,消退较快。部分患者反复发作,持续数年。多发游走性红斑是螺旋体经血或淋巴播散的皮肤体征,提示疾病进展至播散感染期(2期)。
对有明确流行病学史者,典型游走性红斑是早期莱姆病诊断的独立指标;对缺乏典型表现或暴露史、感染组织螺旋体分离培养或核酸检测阴性者,血清等体液中特异性抗体阳性是临床诊断的主要依据。因螺旋体致病基因型流行分布的地域差异及其表达优势抗原的变异,各地区检测抗原所用标准菌株及结果解释存在一定差别(表3)[2, 3, 4, 5]。目前对无神经系统和心脏损害的播散感染期成年游走性红斑,指南推荐多西环素、阿莫西林或头孢呋辛酯口服,疗程14~21 d;有神经系统或/和心脏受累者,推荐头孢曲松、头孢噻肟或青霉素G静脉点滴,疗程14~28 d[1, 2]。证据显示,上述指南推荐方案治疗早期莱姆病的疗效并无显著差异[6]。多数患者在治疗20 d内缓解,临床上尚无耐药菌株的报道[1, 7]。值得注意的是,IgG抗体在病原清除后仍可持续数年[1, 2]。因此,现行抗体检测不能区分活动性感染、既往感染和再感染等,更不适用于抗菌疗效的评估。因此,在标准疗程抗菌药物治疗后,对临床表现持续或复发者,须仔细评估病史、依从性及再感染可能,而非无依据地延长抗菌疗程。
中外莱姆病指南血清免疫印迹法(WB)检测的对比
中外莱姆病指南血清免疫印迹法(WB)检测的对比
| 指南 | 流行基因型 | IgM | 判定标准 | IgG | 判定标准 |
|---|---|---|---|---|---|
| 美国[3] | 狭义伯氏、梅奥疏螺旋体 | OspC(p24)、BmpA(p39)、Fla(p41) | 2种及以上为阳性 | OspC(p18、p21)、BmpA(p28、p30、p39)、Fla(p41、p45、p58、p66、p93) | 5种及以上为阳性 |
| 欧洲[2] | 阿氏、伽氏、狭义伯氏、斯氏、巴伐利亚疏螺旋体 | DbpA(p17)、OspC、p39、p41 | 1种及以上为阳性 | p14、p17、p21、OspC、p30、p39、p43、p58、p83/100 | 2种及以上为阳性 |
| 中国[4, 5] | 伽氏、阿氏、狭义伯氏疏螺旋体 | p17、OspC、p28、p30、OspA(p31)、 p39、p41、p58、p83/100 | 1种及以上为阳性 | p14、p17、OspC、p28、p30、p39、p31、OspB、p58、p66、p83/100 | 1种及以上为阳性 |
注:OspC为外膜蛋白C;BmpA为层黏蛋白结合蛋白A;Fla为鞭毛蛋白;DbpA为核心蛋白结合蛋白A;OspA为外膜蛋白A;OspB为外膜蛋白B
脂膜炎是一组病因不明的主要累及皮下脂肪的炎症性疾病综合征,部分继发于感染、创伤、自身免疫病、肿瘤等,表现为脂肪细胞变性、坏死和小叶或小叶间隔炎性细胞浸润。游走性红斑典型病理改变是真皮血管周围以淋巴细胞为主伴有少数嗜酸性粒细胞和浆细胞的炎性浸润[1, 2],但罕见有皮下脂肪受累。脂膜炎的组织病理学表现为非特异性炎症,应与结节性红斑、硬红斑、深部红斑狼疮、皮下脂膜炎样T细胞淋巴瘤等进行鉴别。上述疾病也可表现为四肢、躯干等部位反复发作的单或多发红斑,同时累及皮下脂膜,但皮疹通常无游走性红斑表现。莱姆病并发脂膜炎极为罕见,进行相关检索仅有6例个案报道[8, 9, 10, 11, 12],患者皮肤病理符合小叶性或间隔性脂膜炎,其中2例从皮损中培养出螺旋体,1例核酸PCR检测阳性;经抗菌药治疗后皮损消失且无复发,提示脂膜炎可能是螺旋体向皮下脂肪播散所致病理损伤。
本例患者为青年女性,既往体健,以莱姆病流行区旅居后四肢近端及躯干等部位反复出现的多发游走性红斑和痛性皮下结节、斑块为主要表现,病程迁延;病程中多次血清莱姆病特异性抗体免疫印迹法检测阳性(中国标准),前期游走性红斑经抗菌药物治疗有效,临床考虑莱姆病诊断成立。血清学检查是诊断莱姆病的重要手段,但抗菌治疗成功且症状完全消退者,其特异性IgM和IgG抗体仍会持续数月或数年处于升高水平,血清反应阳性不足以做出活动性莱姆病诊断的结论。本例患者皮肤活检提示真皮血管周围及皮下脂肪小叶以淋巴细胞为主的炎性浸润,符合小叶性脂膜炎诊断,但组织特殊染色及培养未见病原体,分枝杆菌核酸检测阴性,无脂肪坏死及血管炎表现,暂无其他感染、自身免疫病及肿瘤等所致脂膜炎的确切证据。有研究表明,螺旋体OspA等脂蛋白可诱导辅助性T淋巴细胞17(Th17)/调节T细胞(Treg)功能失衡或/和针对宿主抗原共表位hLFA-1自身免疫及炎症反应[1, 7]。因此,推测该患者皮肤小叶性脂膜炎与螺旋体感染相关。目前莱姆病相关脂膜炎的发病率、发病机制、治疗方法及预后等尚不明确。本例患者既往莱姆病诊断明确,经规范抗感染治疗后考虑病原体已清除,后皮疹反复出现可能为皮肤小叶性脂膜炎所致,后经激素治疗病情好转可解释,我们将长期跟踪随访。
所有作者均声明不存在利益冲突



























