
患者男性,43岁。以水肿起病,查24h尿蛋白定量4.66 g,抗M型磷脂酶A2受体(PLA2R)抗体水平25.3 EU/ml,肾脏穿刺病理确诊特发性膜性肾病(MN)。初期口服泼尼松40 mg每日1次,环孢素A 100 mg每日2次治疗,部分缓解后复发,联合环磷酰胺100 mg每日1次口服无效,监测24h尿蛋白定量升至10.8 g,抗PLA2R抗体水平升至496 RU/ml,CD19+B细胞计数71个/μl,遂分别予3次利妥昔单抗1 g静脉输液治疗,并先后停用环孢素A、环磷酰胺及泼尼松。末次随访CD19+B细胞0个/μl,抗PLA2R抗体阴性,血白蛋白34 g/L,24 h尿蛋白定量4.4 g。本例患者提示了利妥昔单抗在难治性膜性肾病中的治疗效果,以CD19+B细胞计数或抗PLA2R抗体水平作为再次使用利妥昔单抗治疗的指征,需进一步思考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,43岁。因尿中泡沫增多、水肿2月余于2018年3月1日收入我院肾内科。患者2018年1月发现尿中泡沫增多,伴一过性双踝可凹性水肿。2018年2月就诊我院门诊,测血压120/80 mmHg(1 mmHg=0.133 kPa),查血白蛋白34 g/L,血肌酐89 μmol/L;尿常规:蛋白1.0 g/L,潜血25个细胞/μl;24 h尿蛋白定量4.66 g;抗M型磷脂酶A2受体(PLA2R)抗体水平25.3 EU/ml;血免疫固定电泳、尿免疫固定电泳、抗核抗体、抗双链DNA抗体、抗可溶性核抗原抗体、乙型肝炎病毒表面抗原及丙型肝炎病毒抗体均未见异常。泌尿系超声检查示,双肾长径10~11 cm,皮质厚0.7~0.8 cm。考虑特发性膜性肾病(MN),予口服泼尼松40 mg 每日1次,环孢素A 100 mg每日2次,氯沙坦100 mg每日1次治疗。患者仍间断出现双踝一过性水肿,2018年2月复查血白蛋白27 g/L,24h尿蛋白定量7.4 g,抗PLA2R抗体水平18.3 EU/ml,为进一步诊治收入我院。既往史:否认高血压、糖尿病、肝炎及结核病史。入院体检:体温36.3 ℃,血压117/81 mmHg,呼吸18次/min,脉搏88次/min;神志清楚,自主体位,安静面容,查体合作;全身浅表淋巴结未及肿大;眼睑无水肿;心律齐,各瓣膜区无病理性杂音;双肺呼吸音清;腹软,无压痛、反跳痛及肌紧张,腹部移动性浊音叩诊阴性,双侧肾区无叩痛,肠鸣音正常;双下肢未及可凹性水肿;四肢肌力及肌张力正常,双侧巴宾斯基征阴性。
患者青年男性,慢性病程,隐匿起病。临床主要表现为蛋白尿及水肿。辅助检查提示血白蛋白<30 g/L,24h尿蛋白定量≥3.5 g,符合肾病综合征(NS)诊断标准[1]。NS患者首先需除外继发因素,包括代谢、药物、感染、肿瘤、免疫等原因。患者为非自身免疫病好发人群,病程中无皮疹、口眼干、关节肿痛等临床表现,不存在慢性病毒性肝炎等感染病史,亦无高血压、糖尿病等代谢病史,起病前无特殊用药史,血压正常,肝炎病毒、免疫固定电泳及自身抗体筛查均阴性,不支持上述继发因素。血清抗PLA2R抗体对特发性MN诊断的敏感度为78%,特异度为99%[2],结合患者起病年龄和病史特点,考虑特发性MN可能性大。
特发性MN常用的一线治疗方案包括,(1)糖皮质激素联合环磷酰胺;(2)钙调神经蛋白酶抑制剂(CNIs)联合或不联合糖皮质激素;(3)利妥昔单抗[1]。在初始治疗中,患者经验性应用糖皮质激素联合CNIs治疗,但NS病情仍一度进展,可能的原因包括,(1)CNIs的血药浓度未达到治疗浓度;(2)存在其他潜在的继发因素,如潜在的实体肿瘤;(3)同时合并其他可能导致NS的肾脏疾病,如糖尿病肾病;(4)存在NS的并发症,如肾静脉血栓,或严重胃肠道水肿导致药物吸收不充分。入院后可检测环孢素A浓度,完善粪潜血、血糖谱、糖化血红蛋白、胸腹盆CT、肾静脉超声等检查,择期行肾脏穿刺明确诊断。
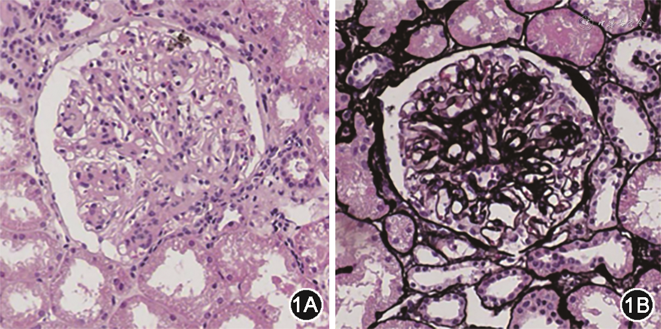
患者入院后完善检查,粪潜血阴性。空腹血糖5.0~5.8 mmol/L,餐后2 h血糖6.1~7.5 mmol/L;糖化血红蛋白6.1%。环孢素A空腹血药浓度101.6 ng/ml。肾静脉超声检查未见血栓形成。胸腹盆CT示,双肺散在微结节;肝、脾、胰形态、大小未见明显异常,胆囊张力不大,胆囊壁不厚;膀胱壁光整,未见明显增厚;前列腺钙化点。2018年3月5日在超声引导下行肾脏组织活检穿刺,肾组织病理示,免疫荧光:IgG++(IgG1+,IgG2+,IgG3+~++,IgG4++),PLA2R+,C3±,κ链±~+,λ链±~+,沿毛细血管襻弥漫性呈颗粒状分布;光镜:全片19个肾小球,1个球性硬化,肾小球基底膜较僵硬,上皮下可见嗜复红物质沉积(图1);电镜:肾小球基底膜弥漫性增厚伴钉突状增生,上皮下可见较多电子致密物沉积,偶见虫蚀状空泡形成;上皮细胞足突广泛融合、微绒毛化,肾小管及间质未见明显异常;符合MN Ⅱ期。至此,患者诊断特发性MN明确,既往治疗中环孢素A血药浓度达标,遂继续口服氯沙坦100 mg每日1次,泼尼松40 mg每日1次,环孢素A 100 mg每日2次。患者未再发水肿,2周后测24h尿蛋白下降至3 g,于2018年3月15日出院。出院后患者继续上述治疗,监测血白蛋白29 g/L,24h尿蛋白定量5~7 g。2018年12月因考虑患者对泼尼松联合环孢素A治疗效果不佳,加用环磷酰胺50 mg每日1次口服,1个月后加量至100 mg每日1次,同期泼尼松按每月5 mg规律减量。2019年2月患者再发双下肢水肿,复查血白蛋白24 g/L,监测24h尿蛋白定量9.1 g(2019年2月)升至10.8 g(2019年4月),抗PLA2R抗体水平240 RU/ml(2019年2月)升至496 RUml(2019年4月),为调整治疗2019年4月再次入院。

患者诊断特发性MN明确,历经3个月以上的充分免疫抑制治疗(半年以上糖皮质激素联合环孢素A,后续叠加环磷酰胺),NS仍未缓解,考虑为难治性NS。根据改善全球肾脏病预后组织(KDIGO)肾小球疾病指南建议[1],特发性MN在初始治疗后可通过监测3个月及6个月的抗PLA2R抗体评估治疗效果及调整治疗方案。对应用CNIs作为初始治疗的患者,如果治疗3个月后抗PLA2R抗体水平升高,必要时可考虑联合利妥昔单抗或环磷酰胺治疗,若联合治疗后抗PLA2R抗体水平进行性升高或维持在较高水平,则需考虑调整治疗方案。本例患者NS持续不缓解,当前复查血抗PLA2R抗体水平进行性升高,后续治疗拟调整为利妥昔单抗治疗。
患者入院后完善T、B淋巴细胞亚群检查,淋巴细胞1 690个/μl,CD19+B细胞71个/μl,T淋巴细胞1 518个/μl;巨细胞病毒DNA、EB病毒DNA、乙型肝炎表面抗原、乙型肝炎e抗体、乙型肝炎核心抗体均阴性;胸腹盆CT示,双肺散在微小结节,肠系膜根部、腹膜后多发小淋巴结;大致同前。考虑患者无利妥昔单抗应用禁忌,于2019年4月19日行第1次利妥昔单抗1 g静脉输液治疗。考虑患者对环孢素A长期使用无明显应答,后续治疗方案中停用环孢素A,继续口服环磷酰胺50 mg每日1次,泼尼松减至15 mg每日1次口服。患者水肿部分消退,于2019年4月26日出院。出院后患者继续口服上述药物,2019年7月泼尼松减至10 mg每日1次长期维持,2019年8月环磷酰胺累积口服14 g后停用。患者仍有双踝部轻度可凹性水肿,监测24h尿蛋白定量9~15 g,抗PLA2R抗体水平逐步下降至118 RU/ml,CD19+B细胞自1个/μl(2019年5月)逐步升至40个/μl(2019年9月),遂于2019年9月10日予第2次利妥昔单抗1 g静脉输液治疗,泼尼松减至5 mg每日1次口服维持。此后患者双下肢水肿逐步缓解,2019年10月患者抗PLA2R抗体转阴,2020年4月患者24h尿蛋白定量下降至3.36 g,血白蛋白回升至40 g/L。
特发性MN是最常见的导致成人NS的特发性肾小球疾病[3]。自然病程中,约30%的特发性MN合并NS的患者可能出现自发缓解[4]。基于此,对于特发性MN患者,KDIGO指南推荐早期使用肾素-血管紧张素系统抑制剂等药物进行对症治疗,对进展为NS且具有如下特点的患者才启动免疫抑制治疗[5],(1)至少经过6个月降压和降尿蛋白的治疗,尿蛋白仍持续>4 g/d,或持续高于基线水平 50%以上且无下降趋势;(2)NS引起严重或威胁生命的临床表现;(3)6~12个 月内血肌酐升高超过基线 30%,且并非NS并发症导致。
与指南建议不同,本例患者在初始免疫抑制治疗时并未达到NS诊断标准,即使提前启动治疗,患者此后仍进展至难治性NS阶段。既往研究表明,对特发性MN患者,治疗诱导NS缓解与预后相关,在完全缓解、部分缓解和无缓解患者中,肾脏10年生存率分别为100%、90%及50%[6]。因而,如何早期识别需要更早治疗的MN患者,适时干预疾病的进展值得进一步研究探讨。
自 2009 年首次报道抗PLA2R抗体以来[7],该抗体不仅成为了MN诊断的重要生物学标志物,也与MN的治疗效果及预后相关。研究表明,抗PLA2R抗体水平与MN的活动度相关,检测出高滴度抗PLA2R抗体的MN患者,往往尿蛋白升高和血白蛋白降低更为突出,肾功能恶化比例更高,临床完全缓解率更低[8]。更为重要的是,抗体水平的变化早于临床缓解的出现,抗PLA2R抗体水平下降较同比例蛋白尿下降可提前达10个月[9]。与其相似,本例患者在接受第1次利妥昔单抗治疗后已出现血抗PLA2R抗体水平下降,但直至近6个月后才实现NS的部分缓解。基于此,在起始免疫抑制治疗后定期监测抗PLA2R抗体水平可为个体化治疗提供合理的参考方向,而抗PLA2R抗体转阴可能成为MN治疗的首要目标[10]。
利妥昔单抗是针对成熟 B 淋巴细胞表面膜蛋白 CD20 的嵌合型单克隆抗体,能够特异性耗竭 B 细胞,减少肾小球足细胞相关自身抗体的生成。自2002年首次报道利妥昔单抗治疗特发性MN以来[11],多项观察性及随机对照研究已证实该治疗方案的效果[12, 13, 14]。此外,Ruggenenti等[14]进行了一项前瞻性研究,对100例特发性MN患者给予利妥昔单抗治疗,此前32例患者接受过烷化剂、CNIs等传统免疫抑制治疗,其中20例患者曾实现短暂的临床部分缓解;最终超过半数患者在接受利妥昔单抗进行二线治疗后达到了部分或完全缓解。80%~90%应用利妥昔单抗的患者存在输注反应,严重细菌、真菌及病毒新发感染或既往感染再活动也是利妥昔单抗的重要不良反应,因而重症活动感染是利妥昔单抗的应用禁忌[15]。与既往研究一致,本例患者接受传统免疫抑制治疗短期达到部分缓解后病情反复,在筛查除外活动性感染后,调整治疗为利妥昔单抗后实现部分缓解。对特发性MN而言,在传统免疫抑制治疗效果不佳时,联合使用利妥昔单抗的策略有望为更多的难治性特发性MN患者提供新的选择。
根据Fervenza等[16]应用利妥昔单抗治疗特发性MN的经验,本例患者在初次利妥昔单抗治疗5~6个月后,由于临床未达缓解且存在B细胞复燃,给予第二次利妥昔单抗注射。值得注意的是,本例患者第二次治疗时,尽管B细胞复燃,但抗PLA2R抗体水平尚在缓慢下降中。特发性MN在应用利妥昔单抗后,重复使用的合理时机目前还是重要的研究热点之一。一项利妥昔单抗治疗特发性膜性肾病的随机对照临床试验(GEMRITUX研究)[12]发现,抗PLA2R抗体的消失而非B淋巴细胞的耗竭预测了特发性MN患者对利妥昔单抗治疗的反应性。相应地,是否应该以抗PLA2R抗体的反复,而非B细胞计数的反复作为利妥昔单抗重复治疗的标准亦值得进一步临床研究探讨。
随访:本例患者于2020年9月减停泼尼松,继续口服氯沙坦100 mg每日1次控制尿蛋白。2020年10月门诊复查血CD19+B细胞 148个/μl,抗PLA2R抗体水平15 RU/ml,血白蛋白30 g/L,24h尿蛋白定量6.4 g。考虑病情复燃,再次予利妥昔单抗1 g静脉输液治疗。2020年11月末次随访血CD19+B细胞 0个/μl,抗PLA2R抗体阴性,血白蛋白34 g/L,24h尿蛋白4.4 g。
所有作者声明不存在利益冲突



























