
老年急性髓系白血病(AML)对化疗耐受性差,早期病死率高,化疗缓解率低。近几年,随着AML分子机制逐渐被阐明,一系列靶向和免疫治疗药物获批上市,老年AML治疗模式发生了重大变化。在新药时代下,老年AML的诊疗已经转变为分子检测指导的精准治疗。异基因造血干细胞移植(allo-HSCT)仍然是高危或中危老年AML最有潜力治愈的方法,随着移植技术的发展和进步,allo-HSCT对老年AML患者是一种可行性选择。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,每年从第1期至第10期共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获得5分。
急性髓系白血病(AML)是一组造血组织来源的恶性克隆性疾病,异质性强,其特征为不受控制的异常原始细胞克隆增殖以及正常血细胞的生成及分化障碍。AML是成人最常见的急性白血病类型[1, 2]。2018年发布的癌症统计报告显示我国新诊断白血病患者约有8.26万人,其中AML是我国最常见的白血病亚型,占所有白血病患者的51.7%[3]。由此推算,我国每年新诊断的AML患者超过4万人。AML的发病率随年龄增加而显著升高,中位发病年龄68~70岁[4],意味着超过50%的AML发生在≥60岁的老年患者。一般情况差、合并症多、不良细胞遗传学和不良基因突变发生率高等老年患者特点和疾病特点决定了老年AML患者临床预后差于年轻患者,60~65岁AML患者的5年总体生存(OS)率<25%,≥70岁患者5年OS率<10%,而<50岁患者5年OS率近50%[5]。美国≥65岁AML患者中大部分因伴有合并症、体能状态差等因素,不能耐受强化疗或移植方案,中位生存期在2016年仅4个月[6, 7]。因此,老年AML治疗给血液科临床医师带来挑战。
关于老年AML患者的定义及年龄界限,目前全球尚未有统一标准。国内外大多数指南和共识将年龄≥60岁AML定义为老年患者[8, 9, 10],例如欧洲白血病网(ELN)和美国国家综合癌症网络(NCCN)AML指南均将≥60岁AML患者与<60岁AML患者的推荐治疗方案分开列出[11]。老年AML患者的定义从最初的年龄≥60或65岁到近几年的年龄≥70或75岁,在临床研究中取决于所研究人群的选择。在临床实践中,随着年龄的增长,通常认为患者不适合强化疗,因为年龄越大、体能状态差、伴有合并症,如心、肝、肾等器官功能不全。越来越多的研究表明患者的数字年龄不能准确预测治疗的益处,而仅与生命年限有关,生物学年龄才更适合衡量AML患者是否合适行强化疗。总之,年龄≥60岁是目前普遍认同的老年AML患者临界值[8, 9, 10, 11]。
老年AML患者接受治疗的比例低,接受治疗的效果差于年轻患者。美国真实世界研究显示2000至2009年新诊断>66岁老年AML患者仅有40%在诊断的前3个月内接受化疗,老年AML患者确诊时年龄越大接受化疗的比例越低[12]。老年AML患者中大多具有前驱血液病史(治疗相关AML及继发性AML高达20%)、超过80%伴有中高危细胞遗传学风险[13];常合并≥5个突变基因的多种基因突变[14];超过一半的≥60岁AML患者体能状态较差[美国东部肿瘤协作组(ECOG)评分≥2分];≥65岁AML患者中约2/3伴有1种或多种合并症[15];易伴器官功能损伤,如肝肾功能不全;多数不能耐受强化疗,强化疗死亡率高,化疗效果差。因此,与年轻AML患者相比,老年AML患者诱导缓解率低、治疗相关死亡率高、OS率低。美国2010至2014年数据表明≥65岁的老年AML患者中AML相关死亡率高达69.3%[5]。ECOG评分2分的年龄在66~75岁患者诱导治疗30 d死亡率高达31%,随着年龄增长或体能评分的下降,死亡率呈上升趋势[16]。美国安德森癌症中心研究结果显示,老年AML患者接受强化疗后完全缓解率为40%~50%,60 d早期病死率高达36%,中位生存仅4~6个月,1年OS率低于30%,而年轻AML患者接受强化疗后完全缓解(CR)率为70%~80%、长期生存率为40%~50%,老年AML患者无论是疗效还是预后均远差于年轻AML患者[1]。
总之,老年AML患者的诊治可能仍面临多重挑战:(1)不利遗传学特征比例高,中、高危患者占比>80%;(2)大多数患者伴有合并症,约70%的患者伴有合并症;(3)体能状态差,30%的老年患者体能状态评分≥2分;(4)对强化疗耐受性差,早期死亡率高达31%;强化疗比例低,50%~70%患者未接受强化疗;化疗缓解率低,CR率仅30%~55%;(5)经济能力差,导致50%患者不能接受化疗;(6)化疗治疗意愿低,部分患者选择支持治疗代替化疗;(7)需要护理支持。
老年AML治疗的第1步是根据年龄、体能状态评分和合并症等评估老年AML患者是否适合强化疗。适合强化疗的AML患者(fit患者)治疗目标是通过强诱导化疗获得CR后进行巩固强化或造血干细胞移植追求治愈;不适合强化疗者(unfit患者)治疗目标是通过低强度治疗和/或支持治疗改善生活质量、争取延长生存。目前国内外指南和共识对于“unfit”AML患者尚未给出明确的定义。现多采用Ferrara标准判断患者是否为unfit患者[17]。对“fit”或“unfit”的评价仍然是主观的。总之,老年AML患者治疗方案的选择需要根据合并基础疾病、体能状态评分、AML危险度分层等综合而定。
自1973年获得批准后,以经典的阿糖胞苷和蒽环类药物为代表的“7+3”方案是近半个世纪以来可耐受强化疗AML患者一线诱导治疗的基石。非强化疗包括支持治疗和低剂量化疗[主要包括去甲基化药物(HMAs)和小剂量阿糖胞苷(LDAC)]。AML治疗药物的发展在很长一段时间内都处于停滞的状态,AML治疗药物非常有限,2017年之前,仅2004年新批准了阿扎胞苷用于AML的治疗。直至2017年,随着AML的分子机制逐渐被阐明,AML治疗药物发展也出现了转机。美国食品药品监督管理局(FDA)于2017年批准了多靶向酪氨酸激酶抑制剂米哚妥林、异柠檬酸脱氢酶(IDH)2抑制剂恩西地平(enasidenib)、柔红霉素和阿糖胞苷的脂质体制剂CPX-351和吉妥单抗的AML治疗适应证。紧接着2018年,美国FDA又批准了IDH1突变抑制剂艾伏尼布(ivosidenib)、Smoothened蛋白(SMO)抑制剂格拉吉布、FMS样酪氨酸激酶3(FLT3)突变抑制剂吉瑞替尼(gilteritinib)、B细胞淋巴瘤因子-2(BCL-2)抑制剂维奈克拉(venetoclax)等药物。新型靶向药物逐渐获批用于AML的治疗,提高了部分伴有特定突变及不能耐受强化疗AML患者的疗效。2018年,维奈克拉的AML适应证获批,不受限于基因突变,成为不适合接受强化疗AML患者一线治疗新标准。
总之,在新药时代下,老年AML患者治疗模式主要为新型靶向药物的单独或联合应用。老年初治AML患者目前治疗方案如下:适合强化疗者采用新型药物+强化疗;不适合强化疗者采用维奈克拉+HMAs或其他新型药物+HMAs(图1)。老年难治/复发(R/R)AML目前治疗方式:除了传统的强化疗和非强化疗,新增靶向药物±HMAs。
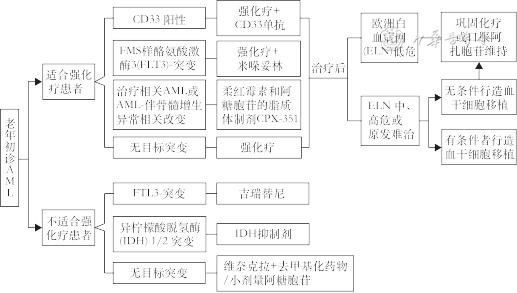

维奈克拉是首个高选择性BCL-2抑制剂,可选择性与BCL-2结合,释放促凋亡蛋白,启动肿瘤细胞凋亡[18]。尽管陆续有一些靶向治疗药物问世,但每种药物仅适用于小部分患者,获益仅限于存在特定基因突变的患者。维奈克拉治疗AML不受限于基因突变,为AML治疗开启了新时代。2018年11月美国FDA批准了维奈克拉与HMAs或LDAC联合用于因合并症不适合接受强诱导化疗,或者年龄75岁及以上的新诊断的成人AML患者。2020年12月中国批准维奈克拉联合HMAs或LDAC用于unfit AML患者。VIALE-A研究[19]显示,维奈克拉联合阿扎胞苷与单药阿扎胞苷相比,带来更长的中位OS期和更高效的缓解:(1)中位OS时间更长,可达14.7个月,比阿扎胞苷单药显著延长了5.1个月;(2)复合完全缓解(CRc)率更高,可达66.4%,比阿扎胞苷单药显著增高2倍以上;(3)首次达到缓解的时间也更快,仅用了1.3个月,相较于阿扎胞苷单药缩短近一半的时间;(4)持续缓解时间(DoR)长达17.5个月,比阿扎胞苷单药显著延长4.1个月。
吉瑞替尼是第二代Ⅰ型FLT3抑制剂,通过与激酶域结合,高选择性地抑制FLT3-ITD突变和FLT3-TKD突变,抑制FLT3受体信号传导,致使AML细胞生长受到抑制,细胞增殖减少并诱导其凋亡。2018年美国FDA获批吉瑞替尼治疗R/R FLT3突变的AML。2021年1月吉瑞替尼在中国获批治疗携带FLT3突变的R/R AML成人患者。一项关于吉瑞替尼全球多中心随机、对照Ⅲ期临床研究(ADMIRAL研究)[20]纳入371例≥18岁的FLT3突变R/R AML患者,结果显示单药吉瑞替尼与挽救性化疗相比:(1)CRc率为54.3%比21.8%;(2)中位DoR为11.0个月比1.8个月;(3)吉瑞替尼单药治疗至首次CRc的中位时间为1.8个月(范围:0.9~9.5个月)。
1.艾伏尼布:为IDH1抑制剂,精准靶向作用于IDH1突变,抑制突变IDH1酶的活性,以防止代谢产物2-HG的积累,从而起到抗癌作用。艾伏尼布于2018年被美国FDA获批用于治疗存在IDH1突变的R/R AML,于2022年1月在中国获批适应证用于R/R IDH1突变AML。一项多中心、随机双盲Ⅲ期研究显示艾伏尼布联合阿扎胞苷一线治疗不可耐受强化疗IDH1突变的新诊断AML患者,CR率达47.2%,CR+CR伴血液学不完全恢复率达52.8%,总体反应率(ORR)达62.5%,均显著高于对照组(单药阿扎胞苷治疗),中位OS达24.0个月,是对照组(7.9个月)的3倍,显著降低死亡风险达56%[21]。另外一项研究显示艾伏尼布联合阿扎胞苷一线治疗伴IDH1突变不适合强化疗的初诊AML,提升了疗效,延长了生存:共入组患者23例,中位年龄76岁,中位随访16个月,ORR为78.3%(18/23),CR率为60.9%(14/23),中位疗效持续时间未达到,12个月OS率为82%[22]。
2.恩西地平:是一种口服靶向IDH2突变选择性抑制剂,也是首个IDH突变抑制剂。恩西地平于2017年8月1日被美国FDA批准用于治疗R/R IDH2突变AML。一项关于恩西地平治疗IDH2突变R/R AML患者的Ⅰ/Ⅱ期临床研究显示:CR率为19.3%,ORR为40.3%,中位DoR为5.8个月,中位生存时间9.3个月,1年OS率为39%,CR和部分缓解患者中位OS时间分别为19.7个月和14.4个月[23]。
异基因造血干细胞移植(allo-HSCT)仍然是高危或中危AML最有潜力治愈的方法。随着allo-HSCT移植技术的发展和进步,移植结果得到了很大改善,老年AML患者行allo-HSCT的可行性得到广泛认可,移植比例显著增加。NCCN指南推荐≥60岁AML患者达到CR后可选择减低剂量预处理allo-HSCT[11]。中国成人AML诊疗指南推荐年龄<70岁、一般状况良好、重要脏器功能基本正常、伴有预后不良因素、有合适供者的患者,可采用非清髓预处理的allo-HSCT[24]。美国一项研究分析2000至2013年1 106例年龄≥70岁接受allo-HSCT的血液恶性肿瘤患者,在过去十年中allo-HSCT的数量和比例显著增加,移植比例由2000年的0.1%上升至2013年的3.85%(n=298)[25]。国际血液和骨髓移植研究中心(CIBMTR)分析了2007至2017年间年龄≥60岁AML第1次缓解期接受allo-HSCT的1 321例患者,中位随访近3年的结果显示,60~64岁、65~69岁和≥70岁患者的3年OS率分别为49.4%、42.3%和44.7%(P=0.026)[26]。通过采用减低毒性的预处理方案、加强移植物抗宿主病(GVHD)的预防等降低GVHD发生率和致死率措施,国内移植中心也开展了≥60岁老年AML患者的allo-HSCT[27, 28, 29, 30]。因此,对老年AML患者来说,allo-HSCT是一种可行性的选择。近年来,通过一系列对老年患者allo-HSCT技术的改进措施,国内与国际对老年AML患者行allo-HSCT的差距在缩小。
年龄已经不再是老年AML患者行allo-HSCT的障碍。影响老年AML患者行allo-HSCT的主要因素是体能状态、合并症和生物学年龄。临床上评估患者生物学年龄的方法有ECOG评分、Karnofsky功能状态评分及造血干细胞移植合并症指数(HCT-CI)等。拟行allo-HSCT的患者移植前通常采用HCT-CI评估合并症对allo-HSCT预后的影响,HCT-CI≥3分患者具有较高的移植相关死亡率(TRM)[26],可通过采用减低毒性的预处理方案等降低TRM。因此,通过更精准的移植前评估、更好的支持策略、预处理方案调整等,allo-HSCT可使老年AML患者获益。
老年AML的治疗仍是血液科临床医师的重大挑战。分子检测指导的精准治疗是老年AML治疗未来的发展方向。近5年诸多髓系肿瘤靶向药物研发成功,使得老年AML的诊疗已经进入精准医学时代。年龄已经不是老年AML患者行allo-HSCT的障碍,allo-HSCT对老年AML患者是一种可行性选择。
唐菲菲, 黄晓军. 老年急性髓系白血病的治疗[J]. 中华内科杂志, 2023, 62(3): 324-328. DOI: 10.3760/cma.j.cn112138-20221216-00934.
所有作者声明无利益冲突
1.老年急性髓系白血病目前普遍认同的年龄界值是()
A.55岁
B.60岁
C.65岁
D.70岁
2.以下哪项不是老年急性髓系白血病的现状()
A.预后良好遗传学特征比例高
B.大多数患者伴有合并症
C.体能状态差
D.对强化疗耐受性差
3.老年急性髓系白血病耐受强化疗者首选诱导治疗是()
A.7+3方案
B.去甲基化药物
C.低剂量阿糖胞苷
D.新型药物+去甲基化药物
4.老年急性髓系白血病不耐受强化疗者首选诱导治疗是()
A.7+3方案
B.去甲基化药物
C.低剂量阿糖胞苷
D.新型药物+去甲基化药物
5.以下哪项不是评估患者体能状态评分的标准()
A.ECOG评分
B.KPS评分
C.HCT-CI
D.IPSS评分



























