
自身免疫性溶血性贫血和噬血细胞综合征常继发于病毒感染、血液系统恶性肿瘤及自身免疫病,特别是与B-淋巴瘤相关性噬血细胞综合征相比,T/NK-淋巴瘤相关性噬血细胞综合征发病率高、EB病毒颗粒检出率高,实体肿瘤合并自身免疫性溶血性贫血和噬血细胞综合征的报道也罕见。本文报道一例老年男性,入院时表现为自身免疫性溶血性贫血,给予糖皮质激素治疗,病情仍迅速进展,经病理证实同时患有小B淋巴细胞白血病和胰体部腺癌,并因反复黑便行肠镜及免疫组织化学(IHC)检查确诊为横结肠脾区EB病毒阳性弥漫大B细胞淋巴瘤,最终因消化道出血抢救无效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
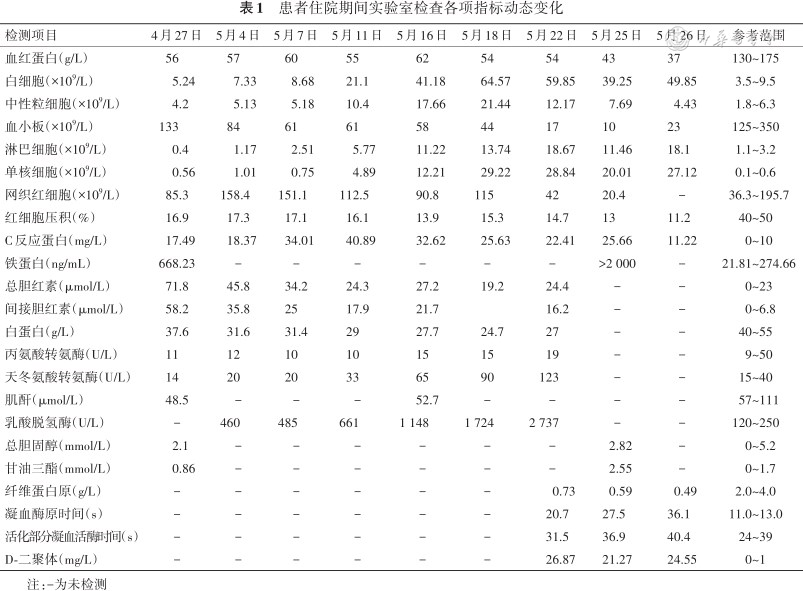
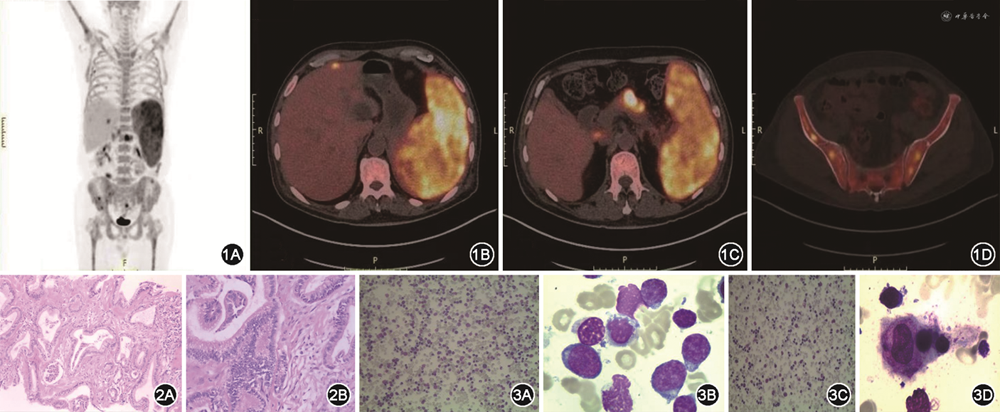
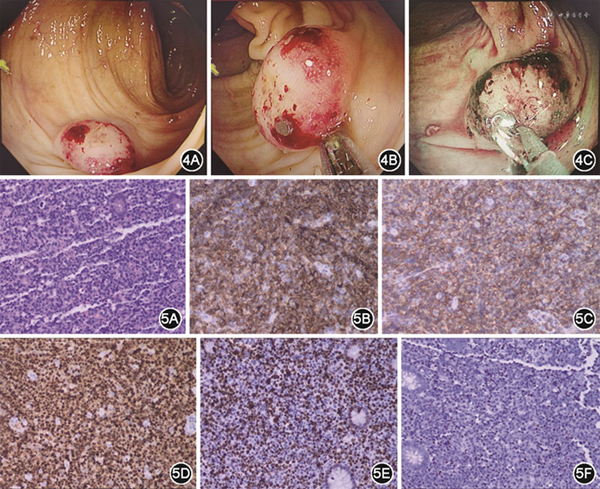
患者男,66 岁,因间断头晕、乏力1年余,加重1周,于2022年4月27日住入泰州市人民医院。患者1年余前无明显诱因下开始出现头晕、乏力,伴活动后心悸,多次查血常规提示贫血,2020年7月14日于泰州市人民医院查骨髓涂片提示增生性贫血,骨髓增生异常综合征荧光原位杂交、染色体核型分析未提示异常,后患者间断出现上述症状,具体治疗过程不详。1周前患者头晕、乏力症状加重,伴有心慌、胸闷,偶有头痛,就诊于泰州市人民医院。查血常规:红细胞1.85×1012/L,血红蛋白67 g/L,白细胞6.42×109/L,中性粒细胞%84.1%,血小板计数141×109/L,红细胞平均体积109.2 fl。现为求进一步诊治,门诊以“贫血”收住入院。查体:贫血貌,皮肤、巩膜黄染,脾脏肋下4 cm,未见其他阳性体征。入院后完善相关检查,血常规、生化(表1),尿便常规未见异常;降钙素原检测211 ng/L;甲状腺功能正常。病原4项:梅毒螺旋体特异性抗体、人类免疫缺陷病毒抗体、丙型肝炎病毒抗体、乙肝病毒表面抗原、乙肝病毒表面抗体、乙肝病毒e抗原、乙肝病毒e抗体均阴性,乙肝病毒核心抗体阳性。肿瘤标志物7项:甲胎蛋白、癌胚抗原、糖类抗原125、糖类抗原15-3、糖类抗原19-9、细胞角蛋白19片段、鳞状上皮细胞癌抗原均正常;狼疮全套(抗核抗体、抗线粒体M2型抗体、抗Sm抗体、抗U1-nRNP抗体、抗SSA-60抗体、抗Ro-52抗体、抗SSB抗体、抗Scl-70抗体、抗Jo-1抗体、抗核糖体P蛋白抗体、抗着丝粒抗体、抗核小体抗体、抗组蛋白抗体、抗双链DNA抗体、抗增殖细胞核抗原抗体、抗PM Scl抗体)均阴性。贫血4项:铁蛋白668.23 μg/L;叶酸、维生素B12、可溶性转铁蛋白受体均正常。心脏彩超:心脏结构未见明显异常。胸腹部CT平扫:(1)两肺散在慢性炎症;两肺多发结节、类结节;(2)肝囊肿可能;胆囊结石;脾大;(3)纵隔、双侧腋窝及腹膜后小淋巴结。4月27日骨髓形态+流式细胞+活检未发现异常细胞,抗人球蛋白试验(Coombs试验)阳性,自身免疫性溶血诊断明确,予以糖皮质激素治疗。5月7日起患者开始出现发热,降钙素原检测204 ng/L,予以哌拉西林抗感染治疗。患者在使用激素治疗的情况下仍有反复发热,血培养、曲霉菌免疫学试验(酶联免疫法)、真菌D-匍聚糖检测均阴性,5月12日完善PET-CT检查,提示脾脏、肝左叶边缘区域、胰腺体部、诸骨骨髓、多处淋巴结及肠道局部糖代谢异常增高(图1)。5月13日行CT引导下胰腺体部穿刺活检,病理示腺癌(图2)。多次请外科会诊无手术条件。治疗过程中,患者反复发热,5月18日复查血常规白细胞和淋巴细胞计数进行性上升、血小板计数进行性下降(表1),降钙素原检测376 ng/L,调整抗菌药物为比阿培南联合莫西沙星。5月19日复查骨髓形态、免疫分型提示小B淋巴细胞白血病,少见噬血细胞,吞噬红细胞、血小板(图3)。5月20日患者多次解黑便,急查胃肠镜见横结肠脾曲处有息肉样隆起,呈黏膜下肿瘤(submucosal tumor,SMT)样改变,活检3块送检(图4)。请消化内科、肝胆外科、肿瘤科、病理科、核医学科全院大会诊,患者病情极其危重,无手术条件,建议积极控制血液病进展及对症支持为主治疗。予以禁食、止血、补液、输血、营养支持等治疗后,患者大便转黄。患者符合噬血细胞综合征(hemophagocytic lymphohistiocytosis,HLH)诊断标准,与患者家属沟通后,5月24日患者家属至江苏省人民医院请专家会诊,建议再次复查骨髓涂片+活检、免疫分型、IG TCR重排、染色体核型分析等检查,针对HLH建议化疗控制。与患者家属充分沟通病情、治疗方案及相关风险后,5月25日予以DEP方案化疗。5月26日5:15左右患者解黑便约300 ml,立即查粪便隐血、血常规、凝血功能等,给予心电监护、凝血酶、生长抑素止血及补液、输血等治疗,急请消化科、普外科及介入科会诊,表示无手术及介入治疗指征,建议保守治疗。后患者再次解黑便,8:10左右出现血压下降,急请重症监护室、消化内科会诊,予以积极补液、输血、血管活性药物维持循环等处理。9:00患者意识丧失,呼吸心脏骤停,予以肾上腺素、胸外按压等积极抢救治疗。10:20患者生命体征未恢复,患者家属放弃抢救,予以出院。随访死亡。5月31日病理结果回报:(横结肠脾曲)基于HE形态,结合免疫酶标结果,倾向侵袭性B细胞性淋巴瘤,考虑为EB病毒(Epstein-Barr virus,EBV)阳性弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)(图5)。
患者住院期间实验室检查各项指标动态变化
患者住院期间实验室检查各项指标动态变化
| 检测项目 | 4月27日 | 5月4日 | 5月7日 | 5月11日 | 5月16日 | 5月18日 | 5月22日 | 5月25日 | 5月26日 | 参考范围 |
|---|---|---|---|---|---|---|---|---|---|---|
| 血红蛋白(g/L) | 56 | 57 | 60 | 55 | 62 | 54 | 54 | 43 | 37 | 130~175 |
| 白细胞(×109/L) | 5.24 | 7.33 | 8.68 | 21.1 | 41.18 | 64.57 | 59.85 | 39.25 | 49.85 | 3.5~9.5 |
| 中性粒细胞(×109/L) | 4.2 | 5.13 | 5.18 | 10.4 | 17.66 | 21.44 | 12.17 | 7.69 | 4.43 | 1.8~6.3 |
| 血小板(×109/L) | 133 | 84 | 61 | 61 | 58 | 44 | 17 | 10 | 23 | 125~350 |
| 淋巴细胞(×109/L) | 0.4 | 1.17 | 2.51 | 5.77 | 11.22 | 13.74 | 18.67 | 11.46 | 18.1 | 1.1~3.2 |
| 单核细胞(×109/L) | 0.56 | 1.01 | 0.75 | 4.89 | 12.21 | 29.22 | 28.84 | 20.01 | 27.12 | 0.1~0.6 |
| 网织红细胞(×109/L) | 85.3 | 158.4 | 151.1 | 112.5 | 90.8 | 115 | 42 | 20.4 | - | 36.3~195.7 |
| 红细胞压积(%) | 16.9 | 17.3 | 17.1 | 16.1 | 13.9 | 15.3 | 14.7 | 13 | 11.2 | 40~50 |
| C反应蛋白(mg/L) | 17.49 | 18.37 | 34.01 | 40.89 | 32.62 | 25.63 | 22.41 | 25.66 | 11.22 | 0~10 |
| 铁蛋白(ng/mL) | 668.23 | - | - | - | - | - | - | >2 000 | - | 21.81~274.66 |
| 总胆红素(μmol/L) | 71.8 | 45.8 | 34.2 | 24.3 | 27.2 | 19.2 | 24.4 | - | - | 0~23 |
| 间接胆红素(μmol/L) | 58.2 | 35.8 | 25 | 17.9 | 21.7 | 16.2 | - | - | 0~6.8 | |
| 白蛋白(g/L) | 37.6 | 31.6 | 31.4 | 29 | 27.7 | 24.7 | 27 | - | - | 40~55 |
| 丙氨酸转氨酶(U/L) | 11 | 12 | 10 | 10 | 15 | 15 | 19 | - | - | 9~50 |
| 天冬氨酸转氨酶(U/L) | 14 | 20 | 20 | 33 | 65 | 90 | 123 | - | - | 15~40 |
| 肌酐(μmol/L) | 48.5 | - | - | - | 52.7 | - | - | - | - | 57~111 |
| 乳酸脱氢酶(U/L) | - | 460 | 485 | 661 | 1 148 | 1 724 | 2 737 | - | - | 120~250 |
| 总胆固醇(mmol/L) | 2.1 | - | - | - | - | - | - | 2.82 | - | 0~5.2 |
| 甘油三酯(mmol/L) | 0.86 | - | - | - | - | - | - | 2.55 | - | 0~1.7 |
| 纤维蛋白原(g/L) | - | - | - | - | - | - | 0.73 | 0.59 | 0.49 | 2.0~4.0 |
| 凝血酶原时间(s) | - | - | - | - | - | - | 20.7 | 27.5 | 36.1 | 11.0~13.0 |
| 活化部分凝血活酶时间(s) | - | - | - | - | - | - | 31.5 | 36.9 | 40.4 | 24~39 |
| D-二聚体(mg/L) | - | - | - | - | - | - | 26.87 | 21.27 | 24.55 | 0~1 |
注:-为未检测


HLH是一种由异常的免疫激活引起的罕见且可致命的临床综合征。近70%HLH继发于病毒感染(特别是疱疹病毒)[1, 2, 3],血液系统恶性肿瘤是继发性HLH第2常见病因[4]。本例患者存在EBV相关淋巴瘤、胰腺癌以及因发热使用多种抗生素,单一因素驱动HLH发生还是多种因素共同参与HLH发生较难分辨。文献报道,实体肿瘤仅占肿瘤相关HLH3.1%[5]。消化道肿瘤合并HLH罕见,我们检索到3例胃癌[6, 7],1例直肠癌[8]以及1例因胰腺癌行胰十二指肠切除术的老年男性患者,在行尸检时发现HLH是由梭状芽孢杆菌引发[9],未检索到胰腺癌单独导致HLH的报道。患者同时诊断小B淋巴细胞白血病和DLBCL考虑受不同的检查方法影响,也有互相转化可能,但结合患者病情进展速度及肿瘤自身特点,似乎以DLBCL来解释更合理。
与T/NK-淋巴瘤相关性噬血细胞综合征(lymphoma-associated HLH,LAHS)相比,B-LAHS发病率低[10]、发病年龄大、EB病毒颗粒检出率低[11]。B-LAHS的确切发病机制尚不清楚。首先,DLBCL(非GCB亚型)患者TLR/MYD88/NF-κB信号通路存在异常,过度激活CD8+导致T细胞产生促炎细胞因子,进而促进HLH 的发展[12]。在Hou等[13]研究的25例DLBCL相关HLH患者中,23例为非GCB亚型(92%)。Yeh等[14]的数据也支持DLBCL中的这一特性与HLH相关。其次,多周期化疗或长期免疫抑制治疗导致免疫细胞缺陷,特别是CD8+T细胞和自然杀伤细胞,这最终会导致持续感染状态,进一步促进HLH的发生[15]。EBV感染已被证实在T/NK-LAHS的发生发展中发挥重要作用[16]。目前尚不清楚EBV感染是否在B-LAHS的发生中起重要作用。EBV阳性的DLBCL最常累积部位是肺和胃肠道[17],EBV阳性的DLBCL相关HLH的发生率为1.4%~3.4%[18, 19]。本例虽然未行血清EBV抗体和EBV脱氧核糖核酸方面的检测,但通过对结肠免疫组织化学检测,除了发现DLBCL的免疫酶标阳性,还发现EBER阳性,EBV感染可能加速患者疾病进展,从而可能导致成人B-LAHS预后不良[13]。本例患者短期内死亡,对B-LAHS发病机制方面的研究中断。
自身免疫性溶血性贫血(autoimmune hemolytic anemia,AIHA)系体内免疫调节功能紊乱,产生自身抗体和/或补体结合在红细胞膜上,红细胞破坏加速而引起的一组溶血性贫血。恶性淋巴瘤因常伴有自身免疫功能紊乱,故易合并AIHA,以慢性淋巴细胞白血病(chronic lymphoblastic leukemia,CLL)合并AIHA的发生率最高,为4%~6%,男女比例为44∶8,且年龄>60岁是CLL患者发生AIHA的独立预后因素[20]。合并AIHA的患者较未合并者预后差[21]。
AIHA作为一种熟知的血液系统恶性肿瘤的副肿瘤综合征,在实体肿瘤中的报道却少得多,将AIHA与实体肿瘤联系起来需要排除其他可能的基础疾病,如药物摄入、感染、自身免疫性疾病和血液系统恶性肿瘤。在一项对1 083例实体肿瘤患者的研究中,仅有1.29%出现副肿瘤综合征,其中只有14%与AIHA相关[22, 23, 24],尤其是在胰腺癌中,Puthenparambil等[25]汇编了52例与实体瘤相关的AIHA的报告,其中只有1例与胰腺癌有关。除此以外,我们仅检索到另1例伴脱髓鞘神经病变和AIHA的71岁男性胰腺腺癌患者[26]。
EBV与冷抗体型AIHA的关系已得到证实。然而,EBV是否也能诱导温抗体型AIHA尚不清楚。但已有EBV加重IgG温抗体导致AIHA致死性的报道[27]。我们这例患者Coombs试验阳性,提示为温抗体型AIHA,EBV究竟起诱导还是加重作用不明。
综上,我们认为本例患者在住院开始表现的AIHA可能为是小B淋巴细胞白血病的副肿瘤综合征。
HLH可迅速发展为多器官衰竭和死亡,因此早期诊断和治疗对生存至关重要。HLH的治疗旨在中止任何潜在的触发因素,控制过度活化的免疫系统。AIHA实质为一种Ⅱ型超敏反应,皮质类固醇是治疗的首选药物。无论是HLH,还是AIHA患者就诊治疗期间如何进行相关检查,及早发现其潜在疾病并尽早特异性治疗十分重要。目前认为恶性淋巴瘤合并AIHA的预后差,且LAHS预后凶险,而恶性淋巴瘤同时合并AIHA和HLH尚鲜有报道,本研究以AIHA首发表现,出现HLH后迅速死亡,提醒我们在临床中应引起对本病的重视。
亓传旺, 李勤, 肖蔚, 等. 自身免疫性溶血为首发表现的同时性胰腺癌和弥漫大B细胞淋巴瘤合并噬血细胞综合征1例[J]. 中华内科杂志, 2023, 62(7): 855-859. DOI: 10.3760/cma.j.cn112138-20220624-00477.
所有作者声明无利益冲突































