
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
根据患者的临床表现和疾病进程,冠心病可分为急性冠状动脉综合征(acute coronary syndrome,ACS)和稳定性冠心病(stable coronary artery diseases,SCAD)。其中ACS主要包括不稳定性心绞痛、非ST段抬高性心肌梗死和ST段抬高性心肌梗死,除此以外其他类型的冠心病均可归为SCAD,主要包括6种临床类型:典型或不典型的劳力性心绞痛、无症状性冠心病、心力衰竭、ACS发生或血运重建术后1年以内、ACS发生或血运重建术后1年以上、变异性心绞痛和微血管性冠心病[1]。
随着我国冠心病二级预防的逐步普及和深入,ACS在冠心病就诊人群中的比例正逐年下降,SCAD的临床诊治工作显得愈发重要。与ACS患者不同,SCAD患者的慢性病程为医师提供了足够的诊疗时间,充分的临床检查、规范的SCAD诊断和风险评估有助于高效准确筛选出可能因冠状动脉造影和血运重建而获益的患者,医师可以在全面评估患者病情的基础上,制定个体化治疗方案,为患者争取最佳的临床结局。
SCAD患者的临床表现个体差异性很大,需要标准化的SCAD诊断流程来有效地识别不同类型的冠心病、减少不必要的冠状动脉检查、为治疗方案的选择和预后判断提供充足的依据。2019版的欧洲心脏学会指南推荐,对临床上怀疑冠心病的患者进行六步法诊断[1]。
1.根据患者的症状(典型心绞痛、不典型心绞痛和非心绞痛型胸痛)和病史特点,筛选出可能为ACS者,按照ACS的原则处理[2,3],避免延误治疗。
2.评估患者一般情况、体质状况和生活质量。对于存在血运重建禁忌证的患者,可直接进行非手术治疗,从而避免不必要的检查。
3.进行血生化、心电图和超声心动图等常规检查。超声心动图可评估左心室功能、室壁活动和心脏瓣膜功能,帮助选择治疗方案和制定术后康复方案。
4.评估患者的冠心病患病风险,以决定是否需要进一步的冠状动脉检查。
5.结合患者的静息心电图、患者的活动能力、临床技术人员和设备情况综合选择适宜的冠状动脉检查评估冠心病的严重程度。冠心病患病风险较低(≤5%)者可临床随访,无需进一步检查;中风险(5%~15%)者可选择阴性预测值高的冠状动脉CT血管造影,排除冠心病诊断;高风险(>15%)者首先选择无创功能学检查,如负荷心电图、心动图或心肌灌注显像,评估是否存在心肌缺血和缺血范围。
6.根据无创检查结果评估患者发生冠状动脉事件(包括心源性死亡、非致死性心肌梗死、需血运重建)的风险。不推荐低危患者进行冠状动脉造影,建议直接进行非手术治疗,包括生活习惯调整、危险因素控制和药物治疗。对无创冠状动脉检查提示存在大面积缺血心肌的高危患者(负荷心电图杜克运动平板评分心血管死亡率>3%,负荷心肌灌注左心室缺血心肌范围≥10%,负荷超声心动图3个以上节段出现负荷状态下心肌运动减弱或无运动,冠状动脉CT血管造影左主干、前降支近端或三支病变中包括近端病变)和药物治疗无效的心绞痛患者,建议行冠状动脉造影。
SCAD患者的治疗目标是缓解症状,同时延缓或阻止冠状动脉病变进展和减少冠状动脉事件的发生。治疗方法包括生活习惯的调整、危险因素的控制、药物治疗和血运重建。下面重点介绍SCAD患者的药物治疗和血运重建的目的、指征和选择。
药物治疗是SCAD治疗的基石,主要包括抗心绞痛和阻止冠状动脉病变进展的治疗。其中抗心绞痛药物,包括β受体阻滞剂、钙离子拮抗剂和硝酸酯类药物,临床上用于预防心绞痛发作,提高活动耐量。更重要的长期治疗方案,包括抗血小板药物、他汀类药物、β受体阻滞剂和对于特定人群的血管紧张素转化酶抑制剂或血管紧张素受体抑制剂类药物,用于延缓冠心病进展、预防心血管事件发生,进而改善预后。
在优化的药物治疗基础上,血运重建可以改善冠状动脉事件高风险患者的临床预后和缓解药物治疗无效患者的心绞痛症状。
有研究证据表明,与药物治疗相比,CABG可明显改善冠状动脉事件高危或左心室收缩功能低下患者的临床预后。2014年的一项纳入100项研究共93 553例SCAD患者的Meta分析结果显示,与药物治疗相比,CABG组全因病死率降低20%(HR=0.80,95%CI:0.70~0.91),心肌梗死发生率降低21%(HR=0.79,95%CI:0.63~0.99),再次血运重建降低84%(HR=0.16,95%CI:0.13~0.20)[4]。STITCH研究中,1 212例射血分数≤35%的SCAD患者被随机分为CABG组和药物治疗组,10年随访结果显示CABG组患者的全因死亡(59%比66%,HR=0.84,95%CI:0.73~0.97,P=0.02)和心源性死亡(41%比49%,HR=0.79,95%CI 0.66~0.93,P=0.006)发生率均低于药物治疗组[5]。
目前还没有明确的研究证据表明PCI与药物治疗相比能更好地改善SCAD的临床预后。FAME2研究的3年随访结果显示,多支病变SCAD患者接受血流储备分数指导的PCI+药物洗脱支架,可较药物治疗明显缓解心绞痛症状[6]。但是对于单支病变SCAD患者,2018年公布的ORBITA研究结果显示,PCI和药物治疗患者的活动耐量和心绞痛发生率差异无统计学意义[7]。2019年美国心脏协会年会上报道了最新的ISCHEMIA研究的结果:将5 179例负荷检查提示至少中度心肌缺血的SCAD患者随机分为两组,一组直接接受血运重建,另一组先进行积极药物治疗,药物治疗无效的再接受血运重建,平均随访3.5年后发现,两组患者在复合终点事件(心源性死亡、非致死性心肌梗死、心跳骤停和因不稳定心绞痛或心力衰竭二次入院)发生率上并没有明显差异[8]。因此指南建议,SCAD患者如希望提高活动耐量,而药物治疗效果不佳,或者患者符合CABG手术指征,却有CABG禁忌证,可选择进行PCI[9]。
指南推荐,对于需要行血运重建的SCAD患者(表1),由心脏团队结合预测手术风险、冠状动脉病变复杂程度和预计能达到的完全再血管化程度等因素在CABG和PCI中做出选择[9]。
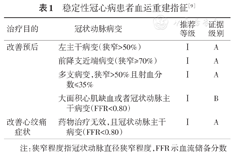
稳定性冠心病患者血运重建指征[9]
稳定性冠心病患者血运重建指征[9]
| 治疗目的 | 冠状动脉病变 | 推荐等级 | 证据级别 |
|---|---|---|---|
| 改善预后 | 左主干病变(狭窄>50%) | Ⅰ | A |
| 前降支近端病变(狭窄≥70%) | Ⅰ | A | |
| 多支病变,狭窄>50%且射血分数≤35% | Ⅰ | A | |
| 大面积心肌缺血或者冠状动脉主干病变(FFR<0.80) | Ⅰ | B | |
| 改善心绞痛症状 | 药物治疗无效,且冠状动脉主干病变(FFR<0.80) | Ⅰ | A |
注:狭窄程度指冠状动脉直径狭窄程度,FFR示血流储备分数
(1)前降支近端病变:单纯前降支近端病变患者CABG和PCI术后临床结局(全因死亡、心肌梗死和脑卒中)相似,但PCI术后患者需再次血运重建的风险高于CABG[10]。有证据表明,微创直视下CABG采用经左前外侧小切口或胸骨下段小切口,与胸骨正中切口相比,可明显减轻术后疼痛,缩短术后住院时间,提高术后生活质量[11];与PCI相比,可降低单纯前降支近端病变患者术后需要再次血运重建的风险[12]。
(2)左主干病变:目前的研究证据显示,左主干病变患者行CABG和涂层支架PCI术后5年内的复合终点事件(全因死亡、心肌梗死和脑卒中)发生率总体相似,但CABG患者围手术期脑卒中发生率略高,PCI患者术后远期需血运重建的风险略高[13,14,15,16,17]。EXCEL研究中1 905例左主干病变患者(SYNTAX评分≤32分)被随机分为CABG组和新一代药物洗脱支架PCI组,术后3年随访结果显示,两组患者的主要终点事件(死亡、脑卒中或心肌梗死)发生率相似(14.7%比15.4%,HR=1.00,95%CI:0.79~1.26,P=0.98)[14]。NOBLE研究中1 201例左主干病变患者(平均SYNTAX评分为23分)被随机分为CABG组和新一代药物洗脱支架PCI组,中位随访3.1年,结果显示PCI组患者的主要终点事件(死亡、心肌梗死、脑卒中或再次再血管化治疗)发生率高于CABG组(29%比19%;HR=1.48,95%CI:1.11~1.96,P=0.007)[15]。因此,指南中将SYNTAX评分低危(≤22分)的左主干病变患者的CABG和PCI均列为Ⅰ类推荐,而推荐SYNTAX评分高危(>33分)的左主干病变患者行CABG,建议SYNTAX评分中危的患者可结合其他临床因素选择治疗方案[9]。
(3)多支病变:目前的研究证据显示,CABG在多支病变治疗上有明显优势。除SYNTAX评分低危(≤22)的非糖尿病患者,药物洗脱支架PCI术后可以获得与CABG相似的临床结局外,其他患者CABG术后的远期预后均优于PCI[16,18,19]。一项包含SYNTAX和BEST研究数据的Meta分析结果显示,对于不合并糖尿病的三支病变患者,SYNTAX低危组(≤22分)患者CABG和药物洗脱支架PCI术后死亡风险相似(6.0%比7.5%,P=0.66),而中高危组(>22分)患者CABG术后死亡风险明显低于PCI(7.1%比11.6%,P=0.02)[20]。FREEDOM研究结果显示,对于合并糖尿病的多支病变患者,CABG组术后5年的主要终点事件(死亡、心肌梗死或者脑卒中)发生率明显低于新一代药物洗脱支架PCI组(18.7%比26.6%,P=0.005),其中CABG组死亡和心肌梗死发生率均低于PCI组(10.9%比16.3%,P=0.049;6.0%比13.9%,P=0.000),而脑卒中发生率CABG组高于PCI组(5.2%比2.4%,P=0.03)[21]。Bangalore等[22]的研究发现,严重左心室功能低下(射血分数≤35%)的多支病变患者行PCI和CABG术后死亡风险相似(HR=1.01,95%CI:0.81~1.28,P=0.91),而PCI组患者术后心肌梗死和需再次血运重建风险均高于CABG组(HR=2.16,P=0.000 3;HR=2.54,P=0.000),术后脑卒中风险低于CABG组(HR=0.57,P=0.04)。因此,目前指南推荐,如果多支病变患者术前SYNTAX评分中高危(>22),或合并糖尿病,或合并左心室收缩功能下降,可优先选择CABG。
(4)其他临床因素:在临床决策中,我们还需要综合考虑其他临床因素。CABG的相对禁忌证包括:患者预期寿命短,活动能力差,有严重合并症,胸部畸形,胸部放疗史,升主动脉广泛严重钙化;PCI的相对禁忌证包括:双联抗血小板禁忌证,支架内再狭窄病史,合并其他需外科手术处理的心脏问题。
目前的研究证据表明,对于常规病例,技术成熟的外科医师施行体外循环和非体外循环CABG的临床结局相似,而升主动脉广泛钙化或术前高危(如肾功能不全)的患者,非体外循环CABG可能使患者获益。
ROOBY研究中2 203例冠心病患者被随机分为体外循环和非体外循环CABG两组,结果发现非体外循环组患者完全再血管化率和旁路血管通畅率均低于体外循环组(82.2%比88.9%,P=0.000;82.6%比87.8%,P=0.000)[23],5年随访结果提示,非体外循环组患者死亡风险和术后主要严重心脑血管事件发生率均高于体外循环组(15.2%比11.9%,HR=1.28,95%CI:1.03~1.58,P=0.02;31.0%比27.1%,HR=1.14,95%CI:1.00~1.30,P=0.046)[24]。为了避免外科医师经验对研究结果的影响,国际多中心CORONARY研究中纳入了19个国家79个心脏中心有经验的外科医师,将4 752例冠心病患者随机分为体外循环和非体外循环CABG两组,结果显示,两组患者术后30 d和1年的主要终点事件(死亡、心肌梗死、脑卒中)发生率无明显差异[25,26]。
随着近年来研究证据的公布,非体外循环CABG的比例呈逐渐下降趋势。美国胸外科医师数据库结果显示,近年来全美非体外循环CABG的比例仅为10%~15%。目前指南中仅推荐升主动脉广泛钙化的病例(Ⅰ类推荐,B级证据)和高危患者(Ⅱa类推荐,B级证据)由有经验的手术医师行非体外循环CABG[9]。
综上所述,SCAD患者的临床诊疗需要心脏团队在循证医学的证据指导下,结合患者的具体病情,制定个体化的诊疗方案。规范的诊断流程有助于筛选出SCAD患者中的高危人群,优化的药物治疗是SCAD治疗的基础,CABG有助于改善高危SCAD患者的临床预后,有经验的医师行非体外循环CABG可取得与体外循环CABG相似的疗效,而PCI需要谨慎用于SCAD患者的治疗。
所有作者均声明不存在利益冲突
1.稳定性冠心病的一线抗心绞痛药物是( )
A.β受体阻滞剂;B.钙离子拮抗剂;C.硝酸酯类药物;D.曲美他嗪
2.和药物治疗相比,下面哪项治疗有证据表明可以明确改善冠状动脉事件高危的稳定性冠心病患者的临床预后( )
A.危险因素干预+药物治疗;B.危险因素干预+药物治疗+金属裸支架经皮腔内冠状动脉成形术(PCI);C.危险因素干预+药物治疗+药物洗脱支架PCI;D.危险因素干预+药物治疗+冠状动脉旁路移植术
3.无创冠状动脉检查提示下列何种情况需要行冠状动脉造影检查( )
A.负荷心电图杜克运动平板评分心血管死亡率>2%;B.负荷心肌灌注显像中左心室缺血心肌范围≥10%;C.负荷超声心动图中1个以上节段出现负荷状态下心肌运动减弱或无运动;D.冠状动脉CT提示前降支远端和右冠状动脉中段重度狭窄
4.稳定性冠心病患者行血运重建的适应证( )
A.前降支中段病变;B.多支病变,射血分数正常,负荷心肌灌注显像提示左心室缺血心肌占8%;C.右冠状动脉分叉前病变(血流储备分数<0.80)且心绞痛药物治疗有效;D.左主干病变
5.稳定性冠心病患者优先推荐行CABG的适应证( )
A.左主干病变,SYNTAX评分30分;B.多支病变,SYNTAX评分20分;C.多支病变,SYNTAX<22分,无糖尿病;D.多支病变,SYNTAX<22分,合并LVEF≤35%


























