
探讨原发性肝癌外科治疗的临床经验。
回顾性分析1986年1月至2019年12月南京医科大学第一附属医院肝胆中心手术治疗的10 966例原发性肝癌患者的临床资料。采用寿命表法进行生存率和肿瘤复发率的计算,Log-rank检验比较不同组别的差异,采用Cox回归模型进行多因素分析。选取2009—2019年随访数据更详尽的2 884例肝细胞癌病例纳入长期生存分析,其中接受肝切除患者2 549例,男性2 107例,女性442例,年龄(56.6±11.1)岁(范围:20~86岁);接受肝移植患者335例,男性292例,女性43例,年龄(51.0±9.7)岁(范围:21~73岁)。比较肝切除与肝移植的效果、解剖性肝切除与非解剖性肝切除的效果等。
10 966例原发性肝癌患者中,10 331例行肝切除,635例行肝移植。根据收治时间,将10 331例行肝切除的原发性肝癌患者分为3组:1986—1995年组(712例)、1996—2008年组(3 988例)、2009—2019年组(5 631例)。1986—1995年组肝细胞癌肝切除患者的5年生存率为32.9%。2009—2019年组原发性肝癌患者肝切除后5年总体生存率为51.7%,其中肝细胞癌、肝内胆管细胞癌和混合性肝癌的5年总体生存率分别为57.4%、26.6%和50.6%。进一步分析行首次肝切除的肝细胞癌患者(2 549例),其1、3、5、10年累积总体生存率分别为88.1%、71.9%、60.0%、41.0%,围手术期病死率为1.0%;行一期肝移植的肝细胞癌患者247例,1、3、5、10年累积总体生存率分别为84.0%、64.8%、61.9%、57.6%,行补救性肝移植88例,1、3、5、10年累积总体生存率分别为86.8%、65.2%、52.5%、52.5%,两组患者总体生存率的差异无统计学意义(P>0.05)。2 549例接受首次肝切除和247例接受一期肝移植患者的总体生存率和复发率相比,符合米兰标准的肝切除和肝移植患者的1、3、5、10年总体生存率分别为96.3%、87.1%、76.9%、54.7%和95.4%、79.4%、77.4%、71.7%(P=0.754),1、3、5年复发率分别为16.3%、35.9%、47.6%和8.1%、11.7%、13.9%(P<0.01);超米兰标准无大血管侵犯的肝切除和肝移植患者的1、3、5、10年总体生存率分别为87.2%、65.9%、53.0%、33.0%和87.6%、71.8%、71.8%、69.3%(P=0.003),1、3、5年复发率分别为39.2%、57.8%、69.7%和29.7%、36.7%、36.7%(P<0.01);超米兰标准有大血管侵犯的肝切除和肝移植患者的1、3、5、10年总体生存率分别为62.1%、36.1%、22.2%、15.0%和62.9%、31.8%、19.9%、0(P=0.387),1、3、5年复发率分别为61.5%、74.7%、80.8%和59.7%、82.9%、87.2%(P=0.909)。影响肝细胞癌肝切除患者生存率及无复发生存率的独立预后因素有性别、术前辅助治疗、症状、AST、术中或术后输血、肿瘤数目、肿瘤最大径、肝硬化、大血管侵犯、微血管侵犯和病理分化(P值均<0.05)。采用倾向性评分匹配法匹配解剖性肝切除和非解剖性肝切除患者资料,得到443对病例,非解剖性肝切除术后患者的生存率与解剖性肝切除的差异无统计学意义(P=0.895),但非解剖性肝切除术后患者的复发率高于解剖性肝切除(P=0.035)。
近十年,肝癌手术治疗的生存率较之前明显升高。对于肝功能储备较好的肝细胞癌患者可以先行切除手术,复发后再行补救性肝移植,补救性肝移植的效果与一期肝移植相当。在确保阴性切缘的前提下可以选择保留更多肝脏组织的非解剖性肝切除。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2018年全球癌症统计数据显示,全年新增肝癌84万例,死亡78万例,发病率和死亡率在所有癌种中分别居第6位和第4位[1]。我国肝癌患者众多,新发病例数和死亡例数均占全球一半以上(约55%)。近年来,肝癌治疗领域的研究尽管已有较大进展,包括肝癌分子学分期的应用、靶向治疗和免疫治疗等综合治疗理念的实施等,但外科手术治疗仍是早中期肝癌患者的首选治疗方案,亦是患者获得长期生存的主要途径。我们回顾性分析了我院肝胆中心30多年来手术治疗的10 966例原发性肝癌患者的临床资料,现总结报告如下。
1986年1月至2019年12月我院肝胆中心连续收治原发性肝癌拟行根治性肝切除和肝移植患者10 966例,其中接受肝切除治疗10 331例,接受肝移植治疗635例。
2009—2019年共有4 342例原发性肝癌患者接受肝切除且资料完整,其中肝细胞癌3 369例,肝内胆管癌790例,混合型肝癌76例,肝脏其他原发性恶性肿瘤(肝母细胞瘤、肝胚胎性肉瘤、肝肉瘤样癌、肝神经内分泌癌、肝淋巴上皮瘤样癌等)107例。3 369例肝细胞癌患者中,排除合并其他恶性肿瘤97例、复发性肝细胞癌308例、院内死亡34例、pM1或pN1 43例、pR1切除24例、随访失败(无死亡日期,存活但总生存时间<6个月)314例,最终2 549例首次肝细胞癌肝切除患者纳入长期生存分析。
2009—2019年共有420例原发性肝癌患者接受肝移植且资料完整,其中肝细胞癌380例,肝内胆管癌或混合型肝癌32例,肝脏其他原发恶性肿瘤8例。380例肝细胞癌患者中,排除合并其他恶性肿瘤2例、失访及院内死亡43例,最终335例肝细胞癌肝移植患者纳入长期生存分析。
随访截止时间为2020年8月26日。
根据肝功能储备情况和肿瘤大小、位置选择手术方式。Child-Pugh评分≤7分者可行非解剖性肝切除或解剖性肝切除。2008年之后,我们开始检测肝细胞癌患者的吲哚菁绿15 min潴留率,参照Makuuchi标准[2]选择解剖性肝切除的范围。
1.解剖性肝切除术:主要采用鞘内解剖法,将目标肝叶、肝段的Glisson鞘打开,分别解剖出相应的门静脉和肝动脉分支并阻断,根据缺血线确定切肝平面。鞘外解剖主要用于肝外Glisson鞘暴露较清楚的患者,结合降低肝门板手法,直接暴露目标肝蒂,再结扎离断,然后根据缺血线离断肝实质。
2.非解剖性肝切除术:于距肿瘤边缘1 cm处采用血管钳夹法,使用超声刀或超声外科吸引器离断肝实质,完整切除肿瘤。若肿瘤紧贴重要血管,考虑到肝细胞癌往往有包膜且很少直接侵犯血管,因此,行肿瘤完整切除即可。
最常采用的血流控制方式为全肝入肝血流阻断法,即Pringle法。单次阻断时,阻断时间<20 min;多次阻断时,单次阻断15 min,间隔5 min后行再次阻断。局限于左右半肝内的较大肿瘤,采取左右半肝的区域性阻断,即在肝外鞘内分离出门静脉左右支、肝动脉左右支,阻断肿瘤同侧门静脉和肝动脉分支。行解剖性半肝切除时,先在肝外鞘内解剖出拟切除半肝的门静脉和肝动脉分支并结扎离断,除非出血量较多,否则原则上断肝时不阻断对侧入肝血流。对于肝脏周边较小的肿瘤,可不阻断入肝血流,直接用超声刀、超声外科吸引器等切除,或术中用手指挤压周围肝脏组织压迫止血,待肿瘤切除后再缝扎创面血管止血。肿瘤位于第二、三肝门时,可行入肝和出肝血流全阻断。
主要采用经典原位肝移植和背驮式肝移植,尾状叶或邻近第二肝门的肝癌多采用经典原位肝移植,严重肝硬化合并重度门静脉高压的肝癌多采用背驮式肝移植。
自2012年,本中心开始有计划、有组织地收集肝胆肿瘤患者的临床资料,采用Epidata 3.1软件进行数据录入,包括基本信息、术前实验室检查、术中及术后情况,每年定期对患者进行电话随访。2017年,随着我院临床数据中心的建立和专科科研系统的发展,本中心将所有既往临床资料整合进入肝胆肿瘤数据库,并以手术日期为基准,连续纳入我科拟行根治术的肝胆恶性肿瘤患者资料,自动获取我院临床数据中心及其他外部数据源信息,及时录入临床信息并开展数据核查。根据系统提醒定期随访患者,按每6个月一次的频率进行电话随访,记录患者术后复发及后续治疗情况。本研究中涉及的病例均来自本中心的肝癌长期随访队列。
采用Stata 13.0软件进行统计学分析。符合正态分布的连续性变量以表示,不符合正态分布的连续性变量以M(QR)表示;分类变量采用例数和百分比表示。中位生存时间指生存率为50.0%时对应的生存时间。采用寿命表法估计总体生存率和肿瘤复发率,采用乘积极限法(亦称Kaplan-Meier法)绘制总体生存率和肿瘤复发率曲线,采用Log-rank检验比较不同组别生存率的差异,采用多因素Cox回归模型寻找影响预后的主要因素。不同组间定性资料构成比的比较采用χ²检验,定量资料组间比较采用t检验或秩和检验(不符合正态性、方差齐性检验时)。为解决两组间临床特征不均衡的问题,我们采用了倾向性评分匹配的方法[3],首先构建Logistic多因素回归方程,以手术方式分组(0=非解剖性切除,1=解剖性切除)作为应变量,以年龄、性别、血小板计数、AST、总胆红素、术前辅助治疗、有无症状、腹水、肝硬化、肝萎缩、肿瘤数目、肿瘤最大径、病理学分级、微血管侵犯、大血管侵犯为自变量(甲胎蛋白缺失值较多,未纳入模型匹配),共有2 427例患者资料纳入多因素Logistics回归方程,计算分组概率(即倾向性得分)。然后采用1∶1最近邻匹配方法,卡钳值为±0.02,得到443对匹配后的数据。以P<0.05为差异有统计学意义。
根据收治时间不同,将10 331例行肝切除术治疗的原发性肝癌患者分为1986—1995年组(712例)、1996—2008年组(3 988例)和2009—2019年组(5 631例)(图1)。1986—1995年肝细胞癌肝切除患者的5年总体生存率为32.9%[4]。因1996—2008年组病例数据丢失较多,未统计其总体生存率。2009—2019年组原发性肝癌肝切除(4 342例)患者的5年总体生存率为51.7%,其中肝细胞癌、肝内胆管细胞癌和混合型肝癌的5年总体生存率分别为57.4%、26.6%和50.6%。

2009—2019年有2 549例肝细胞癌患者接受首次根治性肝切除,男性2 107例(82.66%),女性442例(17.34%),年龄(56.6±11.1)岁(范围:20~86岁),中位年龄57(15)岁,合并乙肝1 944例(76.27%),合并丙肝61例(2.39%),合并肝硬化1 968例(77.21%),有症状肝细胞癌988例(38.76%)。接受腹腔镜手术236例(9.26%)。手术方式分别为右半肝及右半肝+尾状叶切除(154例)、左半肝及左半肝+尾状叶切除(100例)、右前叶切除(12例)、右后叶切除(38例)、肝中叶切除(9例)、左外叶切除(147例)、解剖性单段肝切除(68例)、非解剖性肝切除(2 021例)。合并门静脉取栓93例,肝静脉取栓13例,腔静脉取栓9例,胆管取栓31例。手术时间(160±81)min(范围:30~720 min),中位手术时间144(100)min;术中中位出血量为150(300)ml,术中输血689例(27.03%),中位输血量950(690)ml。单发肿瘤1 971例(77.32%),肿瘤最大径为(5.8±4.0)cm,中位肿瘤最大径5(5)cm;术中发现肿瘤破裂135例(5.30%),合并门静脉癌栓或侵犯、肝静脉癌栓或侵犯、胆管癌栓或侵犯、腔静脉癌栓或侵犯274例(10.75%)。肝切除术后肿瘤肝内复发1 884例(73.91%),肝外复发196例(7.69%),肝外肝内同时复发469例(18.40%)。
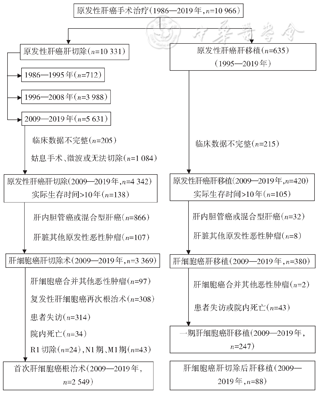
2009—2019年2 592例(其中Ⅲb期43例)接受首次肝切除的肝细胞癌患者,按中国原发性肝癌诊疗规范分期,Ⅰa期1 175例(45.33%)、Ⅰb期635例(24.50%)、Ⅱa期205例(7.91%)、Ⅱb期119例(4.59%)、Ⅲa期415例(16.01%)、Ⅲb期43例(1.66%),5年总体生存率分别为77.2%、62.5%、 40.8%、37.4%、23.8%、0,5年复发率分别为45.9%、63.4%、84.3%、80.1%、80.2%、100%(图2)。不同中国分期患者总体生存率的差异有统计学意义(P<0.01),Ⅱa期和Ⅱb期患者的总体生存率差异无统计学意义(P>0.05);不同中国肝癌分期患者肿瘤复发率的差异有统计学意义(P<0.01)。

采用Log-rank检验比较不同因素对患者总体生存率和肿瘤复发率的影响,结果见表1、2。将单因素分析结果中P<0.10的因素纳入多因素Cox回归,并采用逐步回归的方法保留P<0.05的因素。结果显示,性别比例、术前辅助治疗、症状、AST、术中术后输血、肿瘤数目、肿瘤最大径、肝硬化、大血管侵犯、微血管侵犯、病理学分级是影响患者总体生存率和肿瘤复发率的因素,仅影响总体生存率的因素还有肝脏破裂,仅影响无瘤生存率的因素还有总胆红素和肝切除方式(表3)。
接受首次肝切除根治术的2 549例肝细胞癌患者术前资料的预后单因素分析
接受首次肝切除根治术的2 549例肝细胞癌患者术前资料的预后单因素分析
| 变量 | 例数 | 总体生存 | 肿瘤复发 | ||||
|---|---|---|---|---|---|---|---|
| 中位时间(月) | 5年生存率(%) | P值 | 中位时间(月) | 1年复发率(%) | P值 | ||
| 年龄 | |||||||
<60岁 | 1 489 | 94.1 | 60.4 | 0.790 | 34.2 | 34.6 | 0.033 |
≥60岁 | 1 060 | 73.4 | 58.9 | 39.1 | 26.0 | ||
| 性别 | |||||||
女 | 442 | 114.1 | 66.4 | 0.004 | 58.2 | 23.8 | <0.01 |
男 | 2 107 | 76.8 | 58.6 | 33.6 | 32.6 | ||
| 合并慢性病 | |||||||
无 | 1 666 | 94.1 | 60.1 | 0.596 | 34.2 | 33.8 | 0.017 |
有 | 883 | 73.4 | 59.1 | 42.1 | 25.9 | ||
| 术前辅助治疗 | |||||||
无 | 2 387 | 87.1 | 60.3 | 0.033 | 37.7 | 29.9 | <0.01 |
有 | 162 | 69.7 | 55.7 | 13.9 | 47.6 | ||
| 有无症状 | |||||||
无 | 1 561 | 103.3 | 67.8 | <0.01 | 47.2 | 24.7 | <0.01 |
有 | 988 | 55.9 | 48.8 | 21.6 | 41.1 | ||
| 乙肝 | |||||||
阴性 | 605 | 81.4 | 60.2 | 0.432 | 44.2 | 24.5 | 0.006 |
阳性 | 1 944 | 82.7 | 60.0 | 35.2 | 33.1 | ||
| 饮酒史 | |||||||
无 | 2 112 | 85.3 | 60.1 | 0.211 | 37.5 | 30.3 | 0.059 |
有 | 433 | 71.4 | 60.5 | 29.7 | 34.7 | ||
| 甲胎蛋白 | |||||||
<400 μg/L | 1 431 | 97.8 | 67.5 | <0.01 | 44.2 | 24.4 | <0.01 |
≥400 μg/L | 621 | 73.4 | 54.1 | 17.5 | 44.9 | ||
| 总蛋白 | |||||||
≥40 g/L | 1 410 | 113.9 | 65.2 | <0.01 | 42.2 | 28.5 | 0.004 |
<40 g/L | 1 084 | 67.6 | 52.4 | 29.7 | 34.1 | ||
| ALT | |||||||
≤50 U/L | 1 916 | 90.4 | 62.7 | <0.01 | 41.2 | 28.9 | <0.01 |
>50 U/L | 592 | 64.6 | 51.8 | 25.5 | 37.4 | ||
| AST | |||||||
≤40 U/L | 1 559 | 119.6 | 68.6 | <0.01 | 51.3 | 24.4 | <0.01 |
>40 U/L | 951 | 51.8 | 46.8 | 19.8 | 41.5 | ||
| 总胆红素 | |||||||
≤19 μmol/L | 1 898 | 90.4 | 62.1 | 0.002 | 41.1 | 29.9 | 0.001 |
>19 μmol/L | 605 | 64.6 | 53.8 | 26.5 | 34.4 | ||
| Child-Pugh分级 | |||||||
A级 | 2 521 | 85.3 | 60.4 | <0.01 | 37.0 | 30.9 | 0.250 |
B级 | 28 | 36.7 | 21.8 | 38.0 | 47.3 | ||
| 腹水 | |||||||
无 | 2 086 | 101.3 | 64.0 | <0.01 | 41.1 | 28.5 | <0.01 |
有 | 463 | 48.2 | 39.8 | 21.5 | 42.4 | ||
| 肝萎缩 | |||||||
无 | 2 267 | 82.7 | 60.2 | 0.792 | 37.7 | 30.8 | 0.210 |
有 | 282 | 79.4 | 58.2 | 30.1 | 33.3 | ||
| 肝脏破裂 | |||||||
无 | 2 414 | 90.2 | 62.0 | <0.01 | 37.8 | 29.5 | <0.01 |
有 | 135 | 31.3 | 26.0 | 9.0 | 58.5 | ||
注:表内采用Log-rank检验分析总体生存分布和肿瘤复发患者生存分布的差异
接受首次肝切除根治术的2 549例肝细胞癌患者术中和病理学资料的预后单因素分析
接受首次肝切除根治术的2 549例肝细胞癌患者术中和病理学资料的预后单因素分析
| 变量 | 例数 | 总体生存 | 肿瘤复发 | ||||
|---|---|---|---|---|---|---|---|
中位时间 (月) | 5年生存率(%) | Log-rank检验 P值 | 中位时间 (月) | 5年生存率 (%) | Log-rank检验 P值 | ||
| 肝切除方式 | <0.01 | <0.01 | |||||
非解剖性 | 2 021 | 89.0 | 62.7 | 38.1 | 28.4 | ||
解剖性 | 528 | 58.5 | 49.8 | 23.1 | 41.3 | ||
| 出血量 | <0.01 | <0.01 | |||||
<500 ml | 1 591 | 97.8 | 64.4 | 45.4 | 25.8 | ||
≥500 ml | 709 | 51.7 | 45.3 | 17.8 | 44.2 | ||
| 输血 | <0.01 | <0.01 | |||||
无 | 1 683 | 113.9 | 67.5 | 45.9 | 24.9 | ||
有 | 866 | 51.7 | 44.5 | 17.5 | 43.1 | ||
| 术后并发症 | <0.01 | <0.01 | |||||
无 | 1 785 | 104.8 | 65.0 | ||||
有 | 764 | 53.7 | 47.0 | 44.7 | 28.0 | ||
| 肿瘤数目 | <0.01 | 21.4 | 38.1 | <0.01 | |||
单发 | 1 971 | 113.9 | 65.7 | 47.2 | 25.4 | ||
多发 | 578 | 38.0 | 38.6 | 11.9 | 50.2 | ||
| 肿瘤最大径 | <0.01 | ||||||
≤5 cm | 1 559 | 119.6 | 70.4 | 52.4 | 21.2 | <0.01 | |
>5 cm | 990 | 43.5 | 43.8 | 15.8 | 46.6 | ||
| 肝硬化 | 0.001 | <0.01 | |||||
无 | 581 | 113.9 | 68.0 | 52.4 | 25.3 | ||
有 | 1 968 | 76.6 | 57.6 | 32.7 | 32.8 | ||
| 大血管侵犯 | <0.01 | <0.01 | |||||
无 | 2 275 | 102.2 | 64.8 | 43.1 | 27.1 | ||
有 | 274 | 17.9 | 21.7 | 5.9 | 63.5 | ||
| 微血管侵犯 | <0.01 | <0.01 | |||||
无 | 1 803 | 114.1 | 67.3 | 48.9 | 22.7 | ||
有 | 746 | 37.5 | 40.0 | 11.6 | 51.5 | ||
| 病理学分级 | <0.01 | <0.01 | |||||
高分化 | 1 259 | 119.6 | 68.2 | 46.4 | 22.2 | ||
中低分化 | 1 236 | 60.1 | 50.4 | 23.3 | 40.4 | ||
注:表内共记录2 052例患者的甲胎蛋白,2 300例患者的出血量,2 495例患者的病理学分级,术后并发症指Clavien-Dindo分级Ⅲ~Ⅳ级并发症
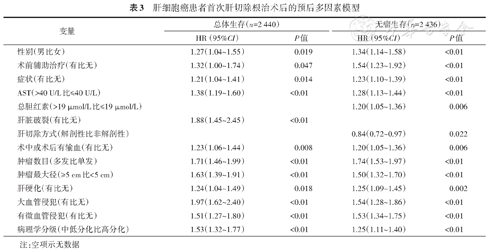
肝细胞癌患者首次肝切除根治术后的预后多因素模型
肝细胞癌患者首次肝切除根治术后的预后多因素模型
| 变量 | 总体生存(n=2 440) | 无瘤生存(n=2 436) | ||
|---|---|---|---|---|
| HR (95%CI) | P值 | HR (95%CI) | P值 | |
| 性别(男比女) | 1.27(1.04~1.55) | 0.019 | 1.34(1.14~1.58) | <0.01 |
| 术前辅助治疗(有比无) | 1.32(1.00~1.74) | 0.047 | 1.54(1.23~1.92) | <0.01 |
| 症状(有比无) | 1.21(1.04~1.41) | 0.014 | 1.23(1.10~1.39) | <0.01 |
| AST(>40 U/L比≤40 U/L) | 1.38(1.19~1.60) | <0.01 | 1.28(1.13~1.44) | <0.01 |
| 总胆红素(>19 μmol/L比≤19 μmol/L) | 1.20(1.05~1.36) | 0.006 | ||
| 肝脏破裂(有比无) | 1.88(1.45~2.45) | <0.01 | ||
| 肝切除方式(解剖性比非解剖性) | 0.84(0.72~0.97) | 0.022 | ||
| 术中或术后有输血(有比无) | 1.23(1.06~1.44) | 0.008 | 1.20(1.05~1.36) | 0.006 |
| 肿瘤数目(多发比单发) | 1.71(1.46~1.99) | <0.01 | 1.74(1.53~1.97) | <0.01 |
| 肿瘤最大径(≥5 cm比<5 cm) | 1.63(1.39~1.91) | <0.01 | 1.50(1.32~1.70) | <0.01 |
| 肝硬化(有比无) | 1.24(1.04~1.49) | 0.018 | 1.25(1.09~1.45) | 0.002 |
| 大血管侵犯(有比无) | 1.97(1.62~2.40) | <0.01 | 1.54(1.28~1.86) | <0.01 |
| 有微血管侵犯(有比无) | 1.51(1.27~1.80) | <0.01 | 1.53(1.34~1.75) | <0.01 |
| 病理学分级(中低分化比高分化) | 1.53(1.32~1.77) | <0.01 | 1.25(1.11~1.40) | <0.01 |
注:空项示无数据
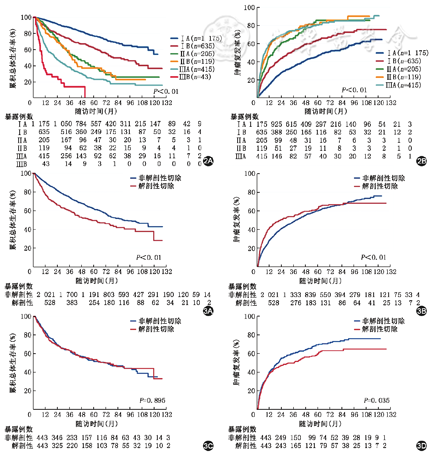
由表4可见,非解剖性切除组和解剖性切除组中患者的基本情况和肿瘤特征不均衡,进行1∶1倾向性评分匹配后得到443对患者,再次比较两组间的基本情况和肿瘤特征,差异无统计学意义(P值均>0.05)。2 549例首次接受肝切除的肝细胞癌患者中,行非解剖性肝切除2 021例,行解剖性肝切除528例。未调整混杂因素时,非解剖性肝切除术后患者的总体生存率高于解剖性肝切除(P<0.01)(图3A),非解剖性肝切除复发率低于解剖性肝切除(P<0.01)(图3B)。进一步比较443对匹配后的患者生存分布可见,非解剖性肝切除术后患者的生存率与解剖性肝切除的差异无统计学意义(P=0.895)(图3C),但非解剖性肝切除术后患者的复发率高于解剖性肝切除(P=0.035)(图3D)。这一结论亦与表3中的多因素模型的结论一致。
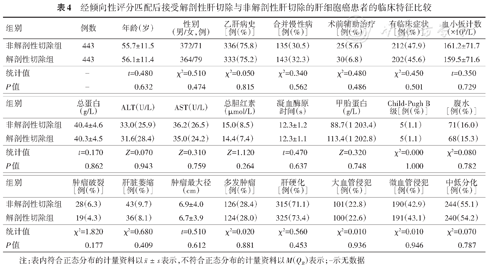
经倾向性评分匹配后接受解剖性肝切除与非解剖性肝切除的肝细胞癌患者的临床特征比较
经倾向性评分匹配后接受解剖性肝切除与非解剖性肝切除的肝细胞癌患者的临床特征比较
| 组别 | 例数 | 年龄(岁) | 性别 (男/女,例) | 乙肝病史 [例(%)] | 合并慢性病 [例(%)] | 术前辅助治疗[例(%)] | 有临床症状 [例(%)] | 血小板计数(×109/L) |
|---|---|---|---|---|---|---|---|---|
| 非解剖性切除组 | 443 | 55.7±11.5 | 372/71 | 336(75.8) | 135(30.5) | 25(5.6) | 212(47.9) | 161.2±71.7 |
| 解剖性切除组 | 443 | 56.1±11.4 | 364/79 | 333(75.2) | 143(32.3) | 30(6.8) | 202(45.6) | 159.5±71.6 |
| 统计值 | - | t=0.480 | χ²=0.510 | χ²=0.050 | χ²=0.340 | χ²=0.480 | χ²=0.450 | t=0.350 |
| P值 | - | 0.632 | 0.474 | 0.815 | 0.562 | 0.486 | 0.501 | 0.729 |
| 组别 | 总蛋白 (g/L) | ALT(U/L) | AST(U/L) | 总胆红素(μmol/L) | 凝血酶原 时间(s) | 甲胎蛋白 (g/L) | Child-Pugh B级[例(%)] | 腹水 [例(%)] |
| 非解剖性切除组 | 40.4±4.6 | 33.0(25.9) | 36.2(26.5) | 15.0(8.5) | 12.3±1.2 | 88.7(1 203.4) | 5(1.1) | 71(16.0) |
| 解剖性切除组 | 40.3±4.5 | 31.6(28.4) | 35.0(24.2) | 14.4(7.4) | 12.3±1.1 | 113.4(1 202.8) | 5(1.1) | 68(15.3) |
| 统计值 | t=0.170 | Z=0.070 | Z=0.310 | Z=1.120 | t=0.470 | Z=0.320 | χ²=0.000 | χ²=0.080 |
| P值 | 0.862 | 0.943 | 0.759 | 0.264 | 0.637 | 0.748 | 1.000 | 0.782 |
| 组别 | 肿瘤破裂 [例(%)] | 肝脏萎缩 [例(%)] | 肿瘤最大径(cm) | 多发肿瘤 [例(%)] | 肝硬化 [例(%)] | 大血管侵犯 [例(%)] | 微血管侵犯 [例(%)] | 中低分化 [例(%)] |
| 非解剖性切除组 | 28(6.3) | 43(9.7) | 6.9±4.0 | 126(28.4) | 315(71.1) | 101(22.8) | 190(42.9) | 244(55.1) |
| 解剖性切除组 | 19(4.3) | 36(8.1) | 6.7±3.9 | 124(28.0) | 325(73.4) | 100(22.6) | 191(43.1) | 240(54.2) |
| 统计值 | χ²=1.820 | χ²=0.680 | t=0.510 | χ²=0.020 | χ²=0.560 | χ²=0.010 | χ²=0.010 | χ²=0.070 |
| P值 | 0.177 | 0.409 | 0.612 | 0.881 | 0.453 | 0.936 | 0.946 | 0.787 |
注:表内符合正态分布的计量资料以表示,不符合正态分布的计量资料以M(QR)表示;-示无数据
335例肝细胞癌肝移植(一期肝移植247例,补救性肝移植88例)患者中,男性292例(87.2%),女性43例(12.8%),年龄(51.0±9.7)岁(范围:21~73岁),中位年龄51(14)岁。合并乙肝302例(90.2%),丙肝5例(1.5%),乙肝+丙肝2例(0.6%),酒精性肝炎5例(1.5%),其他病因21例(6.3%),合并肝硬化317例(94.6%)。有症状肝细胞癌125例(37.3%)。手术方式为原位经典肝移植129例(38.5%),背驮式肝移植206例(61.5%)。单发肿瘤157例(46.9%),肿瘤最大径为(5.2±3.9)cm,中位肿瘤最大径4.0(4.5)cm。合并门静脉癌栓或侵犯、肝静脉癌栓或侵犯、胆管癌栓或侵犯、腔静脉癌栓或侵犯68例(20.3%)。
2009—2019年247例行一期肝移植患者中,符合米兰标准90例、超米兰标准无大血管侵犯91例、超米兰标准有大血管侵犯66例,5年复发率分别为13.9%、36.7%、87.2%,5年总体生存率分别为77.4%、71.8%、19.9%(表5)。超米兰标准无大血管侵犯组的复发率高于符合米兰标准组(P<0.01),但两组总体生存率的差异无统计学意义(P=0.285,Bonferroni校正后P=0.855),超米兰标准有大血管侵犯组的复发率和总体生存率均低于符合米兰标准组(P值均<0.01)和超米兰标准无大血管侵犯组(P值均<0.01)。
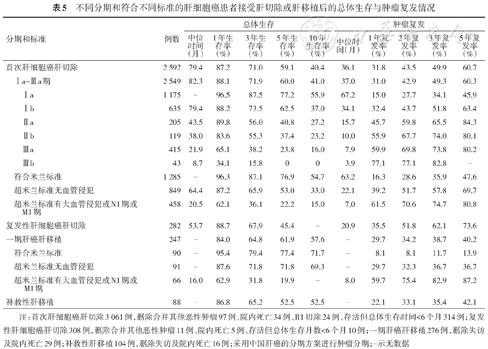
不同分期和符合不同标准的肝细胞癌患者接受肝切除或肝移植后的总体生存与肿瘤复发情况
不同分期和符合不同标准的肝细胞癌患者接受肝切除或肝移植后的总体生存与肿瘤复发情况
| 分期和标准 | 例数 | 总体生存 | 肿瘤复发 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
中位 时间 (月) | 1年生存率(%) | 3年生存率(%) | 5年生存率(%) | 10年生存率(%) | 中位时间(月) | 1年复发率(%) | 2年复发率(%) | 3年复发率(%) | 5年复发率(%) | |||
| 首次肝细胞癌肝切除 | 2 592 | 79.4 | 87.2 | 71.0 | 59.1 | 40.4 | 36.1 | 31.8 | 43.5 | 49.9 | 60.7 | |
| Ⅰa~Ⅲa期 | 2 549 | 82.3 | 88.1 | 71.9 | 60.0 | 41.0 | 37.0 | 31.0 | 42.9 | 49.3 | 60.3 | |
Ⅰa | 1 175 | - | 96.5 | 87.5 | 77.2 | 55.9 | 67.2 | 15.0 | 27.7 | 34.1 | 45.9 | |
Ⅰb | 635 | 79.4 | 88.2 | 73.5 | 62.5 | 37.0 | 34.1 | 32.4 | 43.7 | 51.8 | 63.4 | |
Ⅱa | 205 | 43.5 | 89.8 | 56.0 | 40.8 | 27.2 | 15.7 | 45.7 | 59.8 | 65.5 | 84.3 | |
Ⅱb | 119 | 38.0 | 83.6 | 55.3 | 37.4 | 23.2 | 10.0 | 55.9 | 67.7 | 74.0 | 80.1 | |
Ⅲa | 415 | 21.9 | 65.1 | 38.2 | 23.8 | 16.0 | 7.9 | 59.9 | 69.8 | 73.8 | 80.2 | |
Ⅲb | 43 | 8.7 | 34.1 | 15.8 | 0 | 0 | 3.9 | 77.1 | 77.1 | 82.8 | - | |
| 符合米兰标准 | 1 285 | - | 96.3 | 87.1 | 76.9 | 54.7 | 63.2 | 16.3 | 28.6 | 35.9 | 47.6 | |
| 超米兰标准无血管侵犯 | 849 | 64.4 | 87.2 | 65.9 | 53.0 | 33.0 | 22.1 | 39.2 | 51.7 | 57.8 | 69.7 | |
| 超米兰标准有大血管侵犯或N1期或M1期 | 458 | 20.5 | 62.1 | 36.1 | 22.2 | 15.0 | 7.0 | 61.5 | 70.6 | 74.7 | 80.8 | |
| 复发性肝细胞癌肝切除 | 282 | 53.7 | 88.7 | 67.9 | 45.4 | - | 20.9 | 35.5 | 51.8 | 62.1 | 73.6 | |
| 一期肝癌肝移植 | 247 | - | 84.0 | 64.8 | 61.9 | 57.6 | - | 29.7 | 34.2 | 38.7 | 40.2 | |
| 符合米兰标准 | 90 | - | 95.4 | 79.4 | 77.4 | 71.7 | - | 8.1 | 8.1 | 11.7 | 13.9 | |
| 超米兰标准无血管侵犯 | 91 | - | 87.6 | 71.8 | 71.8 | 69.3 | - | 29.7 | 32.3 | 36.7 | 36.7 | |
超米兰标准有大血管侵犯或N1期或M1期 | 66 | 16.0 | 62.9 | 31.8 | 19.9 | - | 8.0 | 59.7 | 75.4 | 82.9 | 87.2 | |
| 补救性肝移植 | 88 | - | 86.8 | 65.2 | 52.5 | 52.5 | - | 22.1 | 33.1 | 35.4 | 42.1 | |
注:首次肝细胞癌肝切除3 061例,删除合并其他恶性肿瘤97例、院内死亡34例、R1切除24例、存活但总体生存时间<6个月314例;复发性肝细胞癌肝切除308例,删除合并其他恶性肿瘤11例、院内死亡5例、存活但总体生存月数<6个月10例;一期肝癌肝移植276例,删除失访及院内死亡29例;补救性肝移植104例,删除失访及院内死亡16例;采用中国肝癌的分期方案进行肿瘤分期;-示无数据
接受一期肝移植的247例患者的1、3、5年复发率分别为29.7%、38.7%、40.2%,同期行补救性肝移植的88例患者的1、3、5年复发率分别为22.1%、35.4%、42.1%,两组复发率的差异无统计学意义(P=0.587)。一期肝移植患者的1、3、5、10年总体生存率分别为84.0%、64.8%、61.9%、57.6%,同期行补救性肝移植患者的1、3、5、10年总体生存率分别为86.8%、65.2%、52.5%、52.5%,两组总体生存率的差异无统计学意义(P=0.918)(表5)。
2 549例接受首次肝切除(已排除43例Ⅲb期患者)和247例接受一期肝移植患者的复发率和总体生存率相比,考虑到肝癌不同分期对复发率和总体生存率的影响较大,在比较时将患者分为符合米兰标准、超米兰标准无大血管侵犯和超米兰标准有大血管侵犯。符合米兰标准:肝切除和肝移植患者的1、3、5、10年总体生存率分别为96.3%、87.1%、76.9%、54.7%和95.4%、79.4%、77.4%、71.7%(P=0.754),1、3、5年复发率分别为16.3%、35.9%、47.6%和8.1%、11.7%、13.9%(P<0.01);超米兰标准无大血管侵犯:肝切除和肝移植患者的1、3、5、10年总体生存率分别为87.2%、65.9%、53.0%、33.0%和87.6%、71.8%、71.8%、69.3%(P=0.003),1、3、5年复发率分别为39.2%、57.8%、69.7%和29.7%、36.7%、36.7%(P<0.01)。超米兰标准有大血管侵犯:肝切除和肝移植患者的1、3、5、10年总体生存率分别为62.1%、36.1%、22.2%、15.0%和62.9%、31.8%、19.9%、0(P=0.387),1、3、5年复发率分别为61.5%、74.7%、80.8%和59.7%、82.9%、87.2%(P=0.909)。
近十余年来,尽管肝细胞癌的外科治疗效果有了长足进步,但其整体疗效仍较差,进一步完善肝癌筛查体系、加强以外科为中心的综合治疗是改善肝细胞癌治疗效果的关键。
近30余年,本中心共手术治疗了10 966例原发性肝癌。2009—2019年的数据提示,原发性肝癌外科治疗的预后与病理学类型相关,肝细胞癌预后最佳,混合型肝癌其次,肝内胆管细胞癌最差。原发性肝癌中绝大部分为肝细胞癌,且我国的肝细胞癌占全球一半以上,因此,本研究重点关注外科治疗对于肝细胞癌预后的影响。2009—2019年肝细胞癌手术切除患者的5年生存率较1986—1995年显著提高,由32.9%升至60.0%,分析原因主要因为:(1)2009—2019年早期肝癌比例明显增多:1986—1995年最大径≤5 cm的肝癌比例为15.2%[5],至2009—2019年这个比例升至61.2%,肝癌的早诊早治是患者长期生存率升高的关键因素。(2)手术技术和围手术期管理水平的进步:20世纪90年代中期,我中心报道了我国大陆地区首例活体肝移植[6],活体肝移植供肝切取涉及术前精确评估、术中精准操作和术后精细管理,这些新技术、新理念的提高和普及显著提高了常规肝脏手术的安全性,在手术时间、术中出血量及围手术期病死率等数据方面均有所改善。本中心1990年前肝切除手术的平均手术时间为330 min,出血量为2 500 ml[7];近10年手术时间缩至(160±81)min,出血量减至150 ml,病死率为1%。(3)围手术期肝癌综合治疗的普及:本中心在20世纪80年代报告了应用碘化油行肝动脉造影[8],随后又报道应用碘化油抗癌化疗药物乳剂经肝动脉注射治疗不可切除的中晚期肝癌[9],开展了肝癌术前降期及术后辅助介入治疗,并在20世纪90年代中期提出了个体化的肝癌现代综合治疗理念[5]。
对于肝癌手术选择解剖性肝切除还是非解剖性肝切除一直是肝癌外科领域争议的话题。肝细胞癌早期主要通过门静脉系统扩散转移,其卫星灶和门静脉癌栓往往与原发癌灶位于同一肝段,因此,多主张根据解剖结构切除整个肝段;但我国肝细胞癌基本均在肝硬化基础上发展而来,切除过多的功能正常肝脏,反而可能增加围手术期并发症和术后肝功能衰竭的发生率,且不能延长患者生存期,因此,国内不少学者建议采取非解剖性肝切除。在临床实践中,两种切除方式的选择往往受肿瘤最大径、肿瘤分化程度、脉管癌栓、TNM分期、肝功能等因素影响,在比较两种手术方式的效果时,应消除这些因素的影响。我们选取882例肝细胞癌患者进行倾向评分匹配研究,发现非解剖性肝切除组患者的复发率高于解剖性肝切除组,但两组患者复发后生存率的差异无统计学意义,究其原因,主要是因为非解剖性肝切除可以保留较多有功能的肝脏,为复发后行经导管动脉化疗栓塞、免疫治疗、靶向治疗、化疗等综合治疗提供了必要的肝功能储备。解剖性肝切除并不能避免术后复发,一方面因为肝癌的多中心起源,解剖性肝切除并不能解决肝癌的复发问题,另一方面因为解剖性肝切除常会切除一部分有功能的正常肝组织,剩余肝脏体积较小,刺激机体产生较多血管生长因子、趋化因子等细胞因子,在促进肝再生的同时也促进了肝癌的复发。有研究结果显示,与全肝肝移植相比,接受部分肝移植的肝细胞癌患者术后复发率较高,可能与部分肝移植后上调了血管生长因子等细胞因子的表达水平有关[10, 11]。解剖性肝切除往往切除较多的肝脏,复发后因残肝较少、肝功能较差,限制了治疗方式的选择,影响了疗效。可见,在确保阴性切缘的前提下,手术方式和切除范围并不影响肝癌患者的预后。
本中心2009—2019年共施行一期肝细胞癌肝移植247例,补救性肝移植88例。本研究结果显示,符合米兰标准的肝细胞癌患者接受肝切除后的复发率高于肝移植,但生存率无明显差异,进一步分析可以发现,两组患者的生存曲线在5年左右相交,提示术后早期肝移植生存率低于肝切除,5年后肝移植生存率逐步高于肝切除,究其原因可能与肝移植早期并发症和移植后肝癌复发等因素相关。肝移植术后供肝原发性无功能、感染和急性排斥反应等并发症常导致受者早期病死率较肝切除术后因肝功能衰竭、感染等导致的病死率高。肝细胞癌患者肝移植后的复发率低于肝切除术后,随着随访时间的延长,肝移植术后患者的长期生存率逐渐高于肝切除。Fuks等[12]的研究结果显示,一期肝移植与补救性肝移植患者的生存率无差异,并指出肝切除后病理学检查结果提示高复发风险的患者应尽早行肝移植,待复发时可能会因超出米兰标准而失去移植机会,低复发风险患者可在肝切除术后常规随访,复发时大部分患者可获得补救性肝移植机会,且长期生存与一期肝移植类似。我们亦比较了肝细胞癌患者接受一期肝移植和补救性肝移植后的生存率,发现补救性肝移植后患者的生存率与一期肝移植相当。结合本中心的数据,我们认为在供肝严重匮乏的情况下,肝脏储备功能良好能够耐受肝切除的米兰标准内的肝细胞癌,可先行肝切除手术,若病理学检查结果示低复发风险,术后密切随访即可,待肝癌复发时再行补救性肝移植,既节约了供肝资源又不影响患者的长期存活。我们比较了米兰标准和超米兰标准的肝癌肝移植患者的复发率和生存率,结果提示,超米兰标准无大血管侵犯患者的复发率高于符合米兰标准患者,但二者的生存率无明显差异;而超米兰标准有大血管侵犯患者复发率和生存率均不如符合米兰标准患者和超米兰标准无大血管侵犯患者。可见,大血管侵犯对复发率的影响明显大于肿瘤最大径、数目、微脉管癌栓。
近年来,肝癌靶向治疗及免疫治疗的进展突飞猛进,已成为晚期肝癌的一二线治疗方案。免疫治疗联合靶向治疗更是取得了令人瞩目的效果,阿替利珠联合贝伐珠单抗将中晚期肝癌患者的生存期延至20个月以上[13]。免疫治疗联合靶向治疗在Ⅱb期和Ⅲa期肝癌新辅助治疗和术后辅助治疗方面的可行性和安全性尚需进一步研究,希望更多中晚期肝癌患者可以降期后接受手术治疗,同时降低肝癌的术后复发率,综合提高中晚期肝癌的生存率。免疫治疗及靶向治疗在肝癌研究中的进展主要得益于对肝癌免疫微环境的基础研究成果,本中心的研究结果亦显示,肿瘤相关巨噬细胞来源的外泌体可通过CD11b、CD18增强肝细胞癌的转移能力[14],肝细胞癌中circMAT2B表达水平的上调与糖酵解代谢状态呈正相关,并进一步促进肿瘤的恶性生物学行为[15]。另有研究结果显示,5-HT1D可通过蛋白激酶B依赖性和非依赖性途径促进肝细胞癌进展[16]。
综上所述,从30余年来肝细胞癌疗效的改善,我们观察到经手术治疗的原发性肝癌患者的长期生存率明显提高,这主要得益于肝癌早期筛查体系的建立、外科手术技术的进步、肝癌综合治疗的发展。可移植的肝癌患者行手术切除后复发,再行补救性肝移植的总体生存率与一期行肝移植者相当。因此,在供肝匮乏的地区,肝切除术仍是可移植肝细胞癌的首选治疗方法,若肝癌切除后复发,可再行肝移植。手术治疗在确保阴性切缘的前提下,应保留尽量多的剩余肝脏体积,为免疫治疗和靶向治疗等综合治疗提供足够的肝功能储备。当前肝癌治疗已迈入免疫治疗和靶向治疗时代,如何更好地发挥手术治疗在肝癌综合治疗中的作用,尚需要进一步探索。
所有作者均声明不存在利益冲突



























