
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
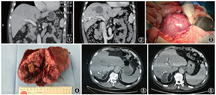
男性,65岁,因“右上腹痛10余天,发现右肝巨大占位”于2018年10月8日入院。患者10余天前无明显诱因出现右上腹中等程度疼痛,呈持续性,不伴发热、恶心、呕吐。外院超声检查结果提示肝脏右叶巨大实性占位,考虑为巨块型肝癌。既往否认高血压病、糖尿病、肝炎、结核等病史,否认药物、食物过敏史。入院体检:腹平软,右上腹肋缘下可触及肝脏肿大,下缘位于肋下4 cm,肝区轻度叩痛。甲胎蛋白56.05 μg/L,癌胚抗原5.89 μg/L。ALT 85 U/L,AST 83 U/L,胆红素正常。乙肝表面抗原、丙肝抗体均阴性。腹部CT增强扫描示肝脏5、8段巨大实性肿物,大小约11.3 cm×7.2 cm×8.7 cm,考虑为肝细胞癌,周围未见转移结节(图1)。PET-CT示右肝巨大占位,考虑恶性肿瘤,其余肝脏、腹腔及全身均未见转移。吲哚菁绿15 min潴留率为13.4%。

多学科综合治疗协作组讨论认为,患者肝右叶巨大肝癌诊断明确,肿瘤与右肝静脉关系密切,无法保留右肝静脉,不宜行肝中叶切除术;左肝体积(肝脏1~4段)仅占标准肝体积的33%,结合肝脏储备功能较差,不建议一期手术切除;为控制肝脏肿瘤生长同时增加左肝体积,可先行经动脉栓塞化疗联合门静脉栓塞治疗,3周后复查CT,如左肝体积增大明显,则行手术治疗,否则可加用靶向药物治疗使肿瘤进一步缩小后再评估是否可行手术治疗。
患者于2018年10月15日行门静脉右支栓塞+经动脉栓塞化疗术,术中分别经肝穿刺栓塞门静脉右前支及右后下支,并经肿瘤供血动脉注射吡柔比星20 mg和栓塞微球。治疗后患者无发热,经保肝、胸腺法新(1.6 mg,2次/周)免疫调节治疗3周后,复查血甲胎蛋白13.26 μg/L,癌胚抗原3.97 μg/L,肝功能正常。CT增强扫描示:肝脏5、8段肿物,最大径9.8 cm,内部坏死,病变侵入左肝管,继发左叶胆管扩张;病变压迫右肝管可能,不除外受累,继发远端肝右叶胆管轻度扩张;肝尾叶及左肝体积较前略增大(图2)。吲哚菁绿15 min滞留率为7%。经过第二次多学科综合治疗协作组讨论,于2018年11月15日在全身麻醉下行根治性右半肝切除+胆管空肠Roux-en-Y吻合术。术中见肝脏右前叶巨大肿瘤(图3, 4),右肝管及肝总管内可及癌栓并向左肝管内突出,行右半肝切除并切除肝外胆管及部分左肝管,左肝管与空肠行Roux-en-Y吻合术。术后病理学检查示:右半肝低分化肝细胞癌,伴大量出血及坏死,肿瘤大小为7.6 cm×5.2 cm×4.8 cm,肿瘤未侵犯肝被膜,可见近瘤旁微血管侵犯灶(M1,低危组),病变紧邻肝手术切缘,胆管断端净,肝门区淋巴结未见转移。术后恢复顺利,围手术期使用注射用胸腺法新(1.6 mg,1次/d)免疫调节治疗。术后复查甲胎蛋白6.63 μg/L,癌胚抗原2.08 μg/L。患者于术后13 d出院。
出院后开始皮下注射胸腺法新(1.6 mg,2次/周)。术后1个月开始口服仑伐替尼(8 mg,1次/d),静脉注射帕博利珠单抗(200 mg,1次/3周,共6次,末次用药时间为2019年4月23日)。术后2个月复查腹部CT示:肝脏未见异常强化灶(图5)。术后5个月CT示:肝实质未见异常强化,肝脏右后切缘囊性灶,较前新发(图6);复查甲胎蛋白5.25 μg/L,癌胚抗原13.56 μg/L;PET-CT示:肝脏右后缘低密度灶,边缘不规则增厚,葡萄糖代谢环形增高,考虑复发可能大;左侧髂骨低密度灶葡萄糖代谢增高,考虑为骨转移。
明确复发并出现骨转移后,患者停用仑伐替尼及帕博利珠单抗,髂骨转移灶于外院行放疗,回到原籍仅维持胸腺法新治疗(1.6 mg,2次/周)。至今仍存活,术后总生存时间达19个月。
近年来肝癌的免疫治疗成为关注的热点,一些免疫调节剂(如胸腺肽α1等)也被证实有一定的抗肿瘤作用[1]。本例巨大肝癌患者在多学科综合治疗协作组模式下经过积极的综合治疗获得根治性切除机会,围手术期应用胸腺法新治疗,术后予帕博利珠单抗联合仑伐替尼辅助治疗。术后5个月出现肝脏局部复发和髂骨转移,反映其肿瘤恶性程度非常高。此后仅应用胸腺法新免疫调节治疗,并行骨转移癌放射治疗,至今总体生存时间超过19个月。可见免疫调节治疗作为系统治疗的一个组成部分,在肝癌的综合治疗中发挥不容忽视的作用。
所有作者均声明不存在利益冲突


























