
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患儿女,10岁,因"诊断系统性红斑狼疮后11个月,咳嗽2周"收住入院。患儿11个月前无明显诱因眉间及鼻根部出现皮疹10 d就诊我院,体检可见眉间及鼻根部出现散在红色皮疹,对称分布,略高出皮面,压之不褪色,无蜕皮。血清抗核抗体阳性(核颗粒型)、滴度1∶10 000,抗Sm抗体(+)、抗SSA抗体(+++)、抗SSB抗体(+++)、抗Ro-52抗体(+++)、抗核糖核酸蛋白抗体阳性(++)、抗核糖体P蛋白抗体(+++),血清补体C3:0.86 g/L、C4:0.093 g/L,丙氨酸转氨酶63 U/L,天冬氨酸转氨酶:43 U/L。免疫球蛋白G、A、M水平和肾功能皆正常,血常规、尿常规、肺和头颅CT无异常。诊断为系统性红斑狼疮(SLE),给予"硫酸羟氯喹0.15 g/d、泼尼松40 mg/d"等治疗5 d好转出院。院外继续口服硫酸羟氯喹片,口服泼尼松逐渐减量(每3周左右减5 mg)。在减量过程中患儿颜面部及双下肢出现新发皮疹,多次查血常规、尿常规未见异常。在继续口服硫酸羟氯喹和泼尼松适当调整剂量同时,给予环磷酰胺静脉冲击治疗。本次为按计划第6次环磷酰胺冲击治疗收入院。入院前1周患儿出现轻微干咳,无发热、呕吐和腹泻,饮食睡眠可,大小便正常。
入院体检:体温:37.0 ℃,心率126次/min,呼吸26次/min,血压119/78 mmHg(1 mmHg=0.133 kPa)。满月面容,颜面部对称性红斑。双肺呼吸音略粗,未闻及干、湿性啰音,右下肺呼吸音减低,未闻及胸膜摩擦音。心律齐,各瓣膜听诊区未闻及杂音,无心包摩擦音。腹软无压痛,肝脾肋下未及,双下肢无水肿。
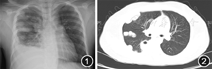
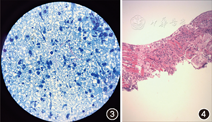
入院后检查:血液:白细胞计数17.19×109/L,中性粒细胞计数14.96×109/L,血红蛋白134 g/L,血小板计数244×109/L,C反应蛋白34.71 mg/L,红细胞沉降率100 mm/1 h。尿液:尿蛋白(±)。肝、肾功能正常。心电图示窦性心动过速。胸X线检查:右肺内高密度影,右侧肋膈角变钝(图1)。胸部CT:双侧肺野内多发结节状、斑片状密度增高影,右肺为著,部分病变内示气泡影,右侧胸膜多发局限性增厚,右侧胸腔内示液性密度影(图2)。查真菌G试验<10 ng/L。行CT引导下经皮肺组织穿刺活检术,术中抽出大量脓性分泌物。穿刺分泌物涂片镜检示:奴卡菌(图3)。病理示:纤维、横纹肌组织呈慢性化脓性炎(图4)。颅脑磁共振(MR):未见明显异常。


诊断:(1)肺奴卡菌病,(2)系统性红斑狼疮。
治疗经过:结合文献资料,应用头孢哌酮舒巴坦100 mg/(kg·d)及复方磺胺甲噁唑片50 mg/(kg·d)抗感染治疗,同时继续应用硫酸羟氯喹(0.15 g/d)、泼尼松片(40 mg/d)治疗原发病。抗感染治疗3 d,复查白细胞计数15.49×109/L,中性粒细胞计数13.06×109/L,C反应蛋白3.40 mg/L,红细胞沉降率57.6 mm/1 h。抗感染治疗2周,复查胸部CT:双侧肺野内多发结节状、斑片状密度增高影,右肺为著,较前部分空洞形成,范围减小(图5)。停用头孢哌酮舒巴坦,将复方磺胺甲噁唑片减量为25 mg/(kg·d)。住院20 d出院。


随访:出院后患儿继续口服硫酸羟氯喹、泼尼松片及复方磺胺甲噁唑片,未再出现咳嗽,未见新发皮疹。治疗2个月后复查胸部CT:双侧肺野内少量结节状、斑片状密度增高影,右肺为著,较前好转(图6)。嘱继续口服复方磺胺甲噁唑片满1年疗程,门诊定期复查。
奴卡菌属于放线菌门、放线菌科、奴卡菌属,为革兰染色阳性的分枝杆菌,形态类似放线菌。广泛存在于空气、土壤、腐烂植物及水生环境中,可通过空气播散,尤其是通过尘埃颗粒[1]。通过多种方式侵入人体,吸入是最常见的侵入方式,故肺部是最常见的感染部位。可经血源播散至脑、皮肤、心脏、肝、肾等脏器,约1/3可侵及中枢神经系统[2]。好发于免疫功能受损的患者,常见原因包括糖皮质激素和免疫抑制剂治疗、恶性肿瘤、器官移植、造血干细胞移植和HIV感染等[3],也可发生在免疫功能正常的宿主,后者多合并基础结构性肺病如支气管扩张、囊性肺纤维化等[4]。本例患儿符合2009年SLE国际临床协作组修订的SLE诊断标准[5],长期应用糖皮质激素和免疫抑制剂,为易感人群。
肺奴卡菌感染表现为肺组织急性、亚急性或慢性化脓性炎。临床表现无特异性,常见有发热(74%)、咳嗽(77%)、咳痰(65%)、呼吸困难(65%)、胸痛(39%)、乏力、食欲不佳等全身症状(42%),其次为皮肤,少数可累及各个脏器引起相应的临床表现[2]。其影像学改变亦为异质性。Blackmon等[6]回顾分析1991—2008年53例肺奴卡菌感染者胸部CT改变,38%患者毛玻璃样间质渗出、64%患者肺实变、57%含有散在结节影、21%患者可见肿块影、15%患者纵隔淋巴结肿大、28%患者胸腔积液。北京儿童医院报道1例为肺部多发结节,伴有空洞[7]。由于本病临床和肺部影像学表现皆缺乏特异性,故诊断依赖病原学证据。本例患儿虽起病隐匿、症状轻微,但肺部影像学改变明显,肺组织穿刺分泌物镜检奴卡菌阳性,符合肺奴卡菌病诊断。临床上,对于合并免疫功能低下患儿肺部出现化脓性病变,胸部X线呈单个或多发结节状阴影伴空洞或胸腔积液,一般抗菌药物治疗无效,排除结核、非典型分枝杆菌等感染,需警惕奴卡菌感染。及早对痰液、胸腔积液及肺组织穿刺行细菌学检查,以利于疾病早期诊断、早期治疗[8]。
磺胺类药物是肺奴卡菌病经验性治疗的首选药物,推荐联合使用甲氧苄啶(TMP)和磺胺甲噁唑(SMZ)。肾功能正常的成人肺奴卡菌病,推荐初始剂量为TMP 5~10 mg/(kg·d),SMX 25~50 mg/(kg·d),分3~4次口服或静脉给药。其他对奴卡菌属敏感的抗菌药物包括:阿米卡星、头孢曲松、头孢噻肟、米诺环素、美罗培南、阿莫西林克拉维酸钾、利奈唑胺[9,10,11],其中利奈唑胺是唯一100%敏感的抗生素[12]。初始治疗推荐联合治疗,经验治疗中推荐TMP-SMZ联合头孢曲松或亚胺培南,若磺胺类耐药可选用利奈唑胺,并根据药敏试验结果及时调整[13]。联合治疗持续至患者临床情况明显改善或药物敏感试验已确定奴卡菌菌种后可单药治疗。对免疫功能正常、无神经系统受累、肺部或多病灶者,抗感染治疗疗程6~12个月;而免疫抑制或中枢神经系统感染者,疗程至少12个月[6]。


























