
近年来,随着流式细胞术及单克隆抗体的发展,细胞的定量分析越来越广泛地应用于实验室检测及相关研究,如造血干细胞移植中CD34+ T淋巴细胞计数,可以确定干细胞动员是否成功;CD4+ T淋巴细胞绝对计数,可以很好地对免疫缺陷疾病病做出诊断,并评估治疗效果。目前,采用流式细胞仪进行细胞计数主要有双平台与单平台2种方法。笔者拟对流式细胞仪双平台与单平台细胞绝对计数方法进行介绍,归纳与总结不同生产厂家提供的流式细胞仪绝对计数的原理与优、缺点,以及流式细胞仪绝对计数方法的临床应用,旨在为临床实验室选择合适的流式细胞仪绝对计数方法提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着流式细胞术的发展,学者们对细胞的研究已不仅局限于定性检测,更注重定量分析。因此,流式细胞定量计数技术越来越受到重视。传统的流式细胞仪结合血细胞分析仪双平台绝对计数方法已较为成熟,自动化程度较高,但细胞计数操作步骤多,耗时长,不同实验室间结果误差大。随着流式细胞仪单平台绝对计数方法的出现,通过加入荧光参比微球(beads)使得流式细胞仪单平台即可获得细胞绝对计数结果。该方法操作步骤简便、省时,细胞绝对计数结果重复性好,但是使用荧光参比微球成本较高。随着相关领域技术的发展,诸多通过计算或固定流式细胞仪进样体积,直接进行细胞绝对计数的方法问世。这些细胞绝对计数方法无需荧光参比微球,步骤简单,成本低廉,结果重复性好,因而得到了广泛的应用。不同生产厂家的细胞绝对计数仪所采用的细胞绝对计数方法各有其优、缺点,笔者拟就流式细胞仪单平台及双平台绝对计数方法的原理与特点进行介绍,并比较其优、缺点及临床应用情况,以供相关领域学者参考。
流式细胞仪结合血细胞分析仪双平台绝对计数方法首先通过流式细胞仪检测荧光抗体标记呈阳性细胞百分比,然后利用血细胞分析仪获得总细胞的绝对计数值,通过两者乘积得到所检测样本中荧光标记呈阳性细胞的绝对计数值。以CD4+ T淋巴细胞绝对计数为例,首先通过流式细胞仪检测获得全血样本中淋巴细胞占全部有核细胞的比例(%)与CD4+ T淋巴细胞占淋巴细胞的比例(%),然后利用血细胞分析仪检测获得全血样本中全部有核细胞绝对计数值。CD4+ T淋巴细胞绝对计数值计算公式:CD4+ T淋巴细胞绝对计数值(个/L)=淋巴细胞占全部有核细胞的比例(%)×CD4+ T淋巴细胞占淋巴细胞的比例(%)×样品中全部有核细胞绝对计数值(个/L)。
流式细胞仪结合血细胞分析仪双平台绝对计数方法费用低,对技术人员水平与配套检测试剂的要求不高,易于实现,目前仍被广泛采用。但双平台法需要流式细胞仪与血细胞分析仪2个分析平台,检测操作步骤多;并且血细胞分析仪的性能差异会影响目的细胞绝对计数结果,因此室间重复性差[1]。
流式细胞仪单平台绝对计数方法是利用特异性抗体,借助荧光参比微球或者细胞悬液样本体积测量等手段进行目的细胞绝对计数的方法。该方法仅需采用1台流式细胞仪即能独立实现细胞绝对计数,操作步骤简单,结果重复性好,且能够有效减低目的细胞绝对计数结果的室间差异。目前,流式细胞仪单平台绝对计数方法已经发展出了3种较为成熟的目的细胞绝对计数方法:①荧光参比微球计数法;②体积测量计数法;③流速校准(flow rate calibration)计数法。这3种流式细胞仪单平台绝对计数方法的原理均不尽相同,并且各具特点。荧光参比微球计数法需使用绝对计数管或在细胞悬液样本管中额外加入荧光参比微球,价格昂贵;后2种方法则不需要荧光参比微球,即可实现目的细胞绝对计数,成本较低,易于推广。
利用荧光参比微球进行流式细胞仪绝对计数,为目前被临床及科研工作者广泛认可的流式细胞仪单平台绝对计数方法之一。CantoⅡ、Calibur型号的流式细胞仪(美国BD公司)及FC500等型号的流式细胞仪(美国贝克曼库尔特公司)均采用该方法进行细胞绝对计数。在待测目的细胞悬液样本制备过程中,先将样本直接加入含已知绝对数量荧光参比微球的绝对计数管中,或者在流式管中加入与待测目的细胞悬液样本等体积、已知绝对数量的荧光参比微球,再加入用于标记待测目的细胞的抗体,待抗体标记后,混匀细胞悬液与荧光参比微球上流式细胞仪检测,同时记录目的细胞与荧光参比微球的计数结果(图1)。因为两者在数量上存在一定的比例关系,根据荧光参比微球的计数结果与绝对数量即可换算出目的细胞的绝对计数值。目前,商售荧光参比微球种类较多,主要有以下3类。
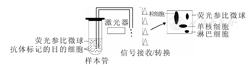

操作人员可提前将已知绝对数量的冷冻干燥荧光参比微球,即TruCOUNT微球(美国BD公司)置于容积为12 mm×12 mm×75 mm的绝对计数管底部,并用使用金属网固定。将待测目的细胞悬液样本与多种颜色荧光标签标记的抗体精确加入绝对计数管底部后,TruCOUNT微球会均匀溶解在样本中。计数过程中同时记录目的细胞与TruCOUNT微球数量,并对结果进行换算。计算公式:目的细胞绝对计数值(个/L)=检测所得目的细胞数量(个)/检测所得荧光参比微球数量(个)×荧光参比微球绝对数量(个/L)。该方法具有操作简单、快速,结果重复性好的特点。值得注意的是,TruCOUNT微球直径小(约为4.2 μm),采用前向散色光(forward scatter,FSC)通道设定阈值,会导致TruCOUNT微球丢失,故需采用荧光信号设置阈值[2]。
Flow-Count微球(美国贝克曼库尔特公司)为1种单独提供、绝对数量已知的荧光参比微球悬液。其工作原理与TruCOUNT微球类似,主要区别在于加入荧光参比微球的方式不同。在样本制备时,手工加入等体积荧光参比微球的方式相对灵活,但增加手工加入荧光参比微球的步骤,加样量不精确亦会引入误差。此外,Flow-Count微球直径较大(10 μm),因此可使用FSC通道设定阈值,而不需要借助荧光信号[2]。
Perfect-Count微球(英国Biorbyt公司)为1种绝对数量与比例已知的混合荧光参比微球(A荧光参比微球+B荧光参比微球)悬液,样本制备步骤与Flow-Count微球类似,检测过程同时采集目的细胞、A荧光参比微球与B荧光参比微球数量。检测结束后,可先通过A、B 2种荧光参比微球的数量与比例判断检测结果的准确性[3]。以A荧光参比微球数量与B荧光参比微球数量的总和作为计算的分母,具体计算公式为:目的细胞绝对计数值(个/L)=检测所得目的细胞数量(个)/[检测所得A荧光参比微球数量(个)+检测所得B荧光参比微球数量(个)]×荧光参比微球绝对数量(个/L)。
目前,商售的绝对计数管与绝对计数荧光参比微球价格较高。为了降低计数荧光参比微球的成本,Harrison等[4]尝试利用价格便宜的自制荧光参比微球CellBeads来取代上述商售微球。该方法利用碘化丙啶(propidium iodide, PI)染色正常白细胞,经多聚甲醛固定后制备成CellBeads。这种利用细胞制备的荧光参比微球,理论上与待测目的细胞在样本悬液中的分散状态类似,混匀效果好,细胞绝对计数结果更为准确。但CellBeads中的PI容易从白细胞中渗出,并染色样本中的死细胞,形成1群介于PI染色呈阳性的CellBeads与PI染色呈阴性的目的细胞之间的PI染色呈弱阳性的死细胞群,影响目的细胞绝对计数结果的准确性。因此,Cao等[5]对自制荧光参比微球进行了改良,采用活细胞染料羟基荧光素二醋酸盐琥珀酰亚胺酯(carboxyfluorescein diacetate succinimidyl ester,CFSE)制备CellBeads。CSFE为一种活细胞透过性荧光染料,其进入细胞后与细胞内蛋白共价结合,可长时间维持荧光并滞留于细胞内部,未结合的CFSE可通过洗涤去除。
自制荧光参比微球虽然成本低廉,但与其他细胞绝对计数方法结果的一致性、重复性尚待进一步验证。采用商售荧光参比微球进行流式细胞仪绝对计数的结果准确性与重复性已得到临床的广泛认可,但是荧光参比微球容易发生沉降或聚集,会减低荧光参比微球的计数值,从而影响检测结果的准确性。此外,如何降低流式细胞仪绝对计数的成本亦为关键问题之一。随着相关技术的发展,诸多流式细胞仪已不需要采用荧光参比微球进行细胞绝对计数,其通过定量待测目的细胞悬液样本体积或检测样本前进流量,即可实现细胞绝对计数,这有效地解决了流式细胞仪绝对计数的成本问题。
体积测量计数法的原理为流式细胞仪通过精确定量进样体积,计算该体积内待测目的细胞悬液样本中的荧光抗体标记呈阳性细胞数,通过计算公式:目的细胞绝对计数值(个/L)=检测所得的目的细胞数量(个)/定量进样体积(L),得到进样量的目的细胞绝对计数值,再根据总体积数,即可得到待测目的细胞绝对计数值。在体积测量法中,如何获得精确的进样体积为决定流式细胞仪绝对计数结果准确性的关键。
A50型流式细胞仪(英国Apogee公司)与Quant型流式细胞仪(德国MACS生物技术公司)等均采用注射泵控制进样体积,实现细胞绝对计数功能。自动步进电机经螺杆传动装置,精准地控制注射泵活塞的前后移动,这一方面为样本进入流动室提供动力,另一方面可匀速推动注射泵,实现平稳、高精度的液流传输。注射泵可定量吸取待测目的细胞悬液样本,仪器通过检测该进样体积内的目的细胞数目即可实现对待测样品目的细胞的绝对计数。该方法不需要额外加入荧光参比微球,检测成本低,操作简单、结果重复性好。但由于注射泵容积有限,每次分析的待测目的细胞悬液样本个数少,不能实现长时间的持续检测。除了注射泵,Accuri C6型流式细胞仪(中国迈瑞公司)采用鞘液蠕动泵与废液蠕动泵驱动的液路系统,同样能实现细胞绝对计数功能。鞘液蠕动泵带动鞘液流,废液蠕动泵在流动室出口处产生负压,拉动鞘液与细胞悬液样本流。细胞悬液样本流量与压力存在一定的换算关系,细胞绝对计数的样本流量可通过2个蠕动泵的压力差值进行换算,同样能够精确定量进样体积,实现细胞绝对计数,并且该方法可实现长时间的持续检测[6,7,8]。
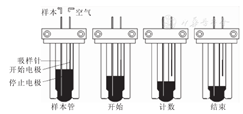
CyFlow型流式细胞仪(德国Partec公司)采用2个高灵敏度的二极管(铂电极)来探测进样体积。2根二极管以不同的高度水平浸泡在细胞悬液样本的液面下,作为"开始电极"和"停止电极"。当细胞悬液样本液面到达"开始电极"时,流式细胞仪开始计数,直到液面到达"停止电极"时,细胞计数结束(图2)。如流式细胞仪每次定量获取200 μL待测目的细胞悬液样本中荧光抗体标记呈阳性细胞数量,根据待测目的细胞悬液样本总体积数,可得到目的细胞的绝对计数值。Pattanapanyasat等[9]报道CyFlow型流式细胞仪与采用荧光参比微球的FACScan型与FACSCount型流式细胞仪(美国BD公司)测定CD4+与CD8+ T淋巴细胞绝对计数结果一致性高(CD4+ T淋巴细胞绝对计数结果:R2=0.96、0.97,CD8+ T淋巴细胞绝对计数结果:R2=0.93、0.95)。Mortazavi等[10]对比了PAS-Ⅲ型流式细胞仪(德国Partec公司)体积测量计数法与基于血液病治疗及移植国际联合会(International Society of Hematotherapy and Graft Engineering,ISHAGE)方案的微球计数法对CD34+ T淋巴细胞进行计数的结果,2组数据一致性高(R2=0.98)。但CyFlow型流式细胞仪每次进行目的细胞绝对计数的样本体积有限,不能进行长时间持续检测。

目前,市面上诸多流式细胞仪的流速均为稳定的,通过对仪器的流速进行校准,即流速校准计数法计算细胞悬液样本前进流量,即可实现目的细胞绝对计数[11,12]。Walker等[13]对流式细胞仪等流速进行校准后,计算FACSCalibur型流式细胞仪(美国BD公司)在一定时间(120 s)内采集的细胞悬液样本体积,实现了CD4+ T淋巴细胞绝对计数。Pattanapanyasat等[14]分别在FACSCalibur型、FACSort型、FACScan型流式细胞仪(美国BD公司)上采用流速校准与荧光参比微球2种方法测定CD4+ T淋巴细胞绝对计数值,研究结果显示3台流式细胞仪采用2种不同细胞绝对计数方法所得到的结果的一致性均比较高(R2=0.97、0.97、0.96)。随着相关技术的革新,利用精密的流量测量组件,通过实时、精确测量细胞悬液样本的前进流量,计算所检测的样本体积,能够更简单、快速地实现流式细胞仪的目的细胞绝对计数功能。例如,FACSVerse型流式细胞仪(美国BD公司)与BriCyte E6型流式细胞仪(中国迈瑞公司)均采用高精度流量传感器对细胞悬液的进样体积进行实时测量,该方法不需要使用荧光参比微球即可实时、精确地测量进样体积。
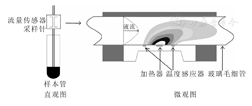
流量传感器由玻璃毛细管与贴在管壁外侧上的加热器、温度感应器等组件组成。加热器在玻璃毛细管外侧加热,当液流流经加热器,会引起加热器原本对称的温度分布发生改变,这种变化可通过毛细管壁上的温度感应器芯片(分布在热源的前方与后方)进行检测。温度分布的变化与液体的流速相关,可实时换算出样本的前进流量。利用流量传感器定量样本体积的绝对计数原理,见图3。这种采用流量传感器测量样本体积的方法无需使用荧光参比微球,即能直接进行目的细胞绝对计数,检测过程简单,结果重复性好,支持长时间连续进样与开放式进样方式。

采用体积测量或流速校准的流式细胞仪进行细胞绝对计数,均要求精确控制样本处理步骤中的移液量与最终稀释比例[15]。越来越多的研究数据表明,体积测量法、流速校准法与荧光参比微球法相比,细胞绝对计数结果重复性好、费用低、操作简便、易于推广,特别适合于资源匮乏地区使用。
流式细胞仪绝对计数方法在临床中应用越来越重要,例如CD4+ T淋巴细胞绝对计数值、CD34+ T淋巴细胞绝对计数值、网织红细胞绝对计数值、血小板绝对计数值、血管中内皮细胞与肿瘤细胞等血液中稀有细胞的绝对计数值。这些指标对于相关疾病的诊断、治疗、预后均具有重要的临床意义[16,17,18,19]。
淋巴细胞亚群中CD4+ T淋巴细胞绝对计数值,常用于人类免疫缺陷病毒(human immunodefieieney virus,HIV)感染的诊断及疾病分型,当CD4+ T淋巴细胞绝对计数值<0.2×109个/L时,HIV感染者均诊断为艾滋病;同时应确定免疫缺陷病及免疫低下疾病的临床合并症,当CD4+ T淋巴细胞绝对计数值<0.2×109个/L时,艾滋病患者很容易发生肺孢子菌肺炎,而CD4+ T淋巴细胞绝对计数值<0.05×109个/L时,艾滋病患者很容易发生巨细胞病毒及分枝杆菌的感染。应用流式细胞仪进行CD4+ T淋巴细胞计数可助于确定HIV感染及疾病分型,对艾滋病患者提早进行预防性治疗[20]。
CD34+造血干细胞绝对计数值主要应用于造血干细胞移植(hematopoietic stem cell transplantation,HSCT)治疗方案,如血液系统肿瘤治疗中异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)与自体造血干细胞移植(autologous hematopoietic stem cell transplantation,auto-HSCT)。回输造血干细胞数量与HSCT的成功与否,以及患者发生移植物抗宿主病的轻重有着重要关系。其次,CD34+造血干细胞计数可用于非血液系统肿瘤的造血干细胞介入治疗,如缺血性心脏病、肝硬化、胰腺炎、糖尿病、脑血管疾病、皮肤溃疡等[21,22,23]。
网织红细胞绝对计数值是反应机体骨髓造血功能的重要指标。正常生理情况下,外周血网织红细胞绝对计数值为(24~84)×109个/L。当网织红细胞绝对计数值增高,外周血红细胞绝对计数值减低,这提示外周血红细胞的破坏增多,骨髓造血活跃,该症状常见于溶血、失血。当骨髓网织红细胞计数及外周血红细胞计数均减低,这提示骨髓增生不良,该症状常见于再生障碍性贫血(aplastic anemia,AA)。网织红细胞绝对计数值亦可作为造血原料缺乏引起的贫血(缺铁性贫血、巨幼细胞性贫血)治疗效果的评价指标。早期网织红细胞计数轻度增高,治疗7~10 d后,网织红细胞计数大幅增高,2周后网织红细胞计数逐步减低[24]。
血小板来源于骨髓中的巨核细胞,其主要参与机体止血过程,正常生理情况下,血小板绝对计数值为(100~300)×109个/L。骨髓增殖性肿瘤,例如慢性粒细胞白血病,真性红细胞增多症(polycythemia vera,PV),原发性血小板增多症(primary thrombocytosis,PT)等,均可以造成骨髓异常增生,引起血小板绝对计数值增高;急、慢性炎症,结缔组织病,肿瘤等则可引起血小板绝对计数值反应性增高,一般情况下此类疾病患者血小板绝对计数值增高值≤500×109个/L,当原发疾病得到控制后血小板绝对计数值可恢复正常水平。血小板绝对计数值减少常见于AA,急性白血病,原发免疫性血小板减少症(primary immune thrombocytopenia,ITP),阵发性睡眠性血红蛋白尿症,骨髓增生异常综合征(myelodysplastic syndrome,MDS),脾功能亢进,弥漫性血管内凝血(disseminated intravascular coagulation,DIC)[25,26]。
循环肿瘤细胞(circulating tumor cell,CTC)是从肿瘤病灶脱离并播散到血液中的肿瘤细胞,其为恶性肿瘤患者出现术后复发与远处转移的重要原因,亦为导致肿瘤患者死亡的重要因素。CTC绝对计数值的检测有助于肿瘤的早期诊断、判断患者的预后、评估抗肿瘤药物的疗效,以及为制定个体化治疗方案提供重要依据[27]。
目前,流式细胞仪绝对计数方法的临床应用越来越广泛。如何降低成本,使得细胞绝对计数的价格更加低廉,是拓展流式细胞仪绝对计数方法相关应用的首要任务。目前,市面上已有多款流式细胞仪无需使用昂贵的荧光参比微球,即可进行细胞绝对计数,这些方法简便快捷,成本低廉,适合在临床中进行广泛推广。
无



























