
1例新生儿时期发现的双侧弥漫性先天性肺动静脉畸形(PAVM)患儿以难以纠正的发绀为主要临床表现,胸部CT平扫无异常,增强CT提示肺内血管异常,数字减影血管造影术明确诊断PAVM。提示对病因不明的难治性全身低氧血症新生儿,应进行影像学鉴别诊断。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患儿 男,28日龄,因“随访发现气促、面色发绀半日”于2020年7月收入复旦大学附属儿科医院。患儿系其母亲第2胎第2产,出生胎龄38+3周,剖宫产出生,出生体重2 945 g,Apgar评分不详,羊水清,脐带、胎盘无异常,否认窒息史及宫内窘迫史。患儿生后出现呼吸急促62次/min,予头罩吸氧后经皮氧饱和度(saturation of pulse oxygen, SpO2)稳定在0.95左右,于当地医院住院,诊断为“新生儿肺炎”,胸X线片提示两肺炎症,超声心动图示动脉导管未闭、房间隔缺损(Ⅱ型)及三尖瓣轻-中度反流,予抗感染及呼吸支持治疗,治疗14 d后病情平稳出院,建议至复旦大学附属儿科医院随访超声心动图。患儿28日龄门诊随访发现气促、面色发绀半日,故收入院。患儿父亲33岁,健康;母亲34岁,有妊娠期糖尿病未予处理,孕期无特殊用药史,未述特殊家族史。姐姐3岁,健康。
入院时体格检查:面色及口唇轻度发绀,SpO2 0.80。无黏膜皮肤毛细血管扩张,呼吸52次/min,未见三凹征,两肺呼吸音粗。余无明显异常。
诊疗经过:患儿入院后因发绀明显予空氧混合仪鼻导管吸氧,C反应蛋白最高116 mg/L,痰培养提示铜绿假单胞菌,痰宏基因检出肺炎链球菌、无乳链球菌等多种细菌,脑脊液检查及血培养无异常,予抗感染治疗,静脉输入丙种球蛋白支持治疗。血、尿串联质谱、甲状腺功能、新生儿遗传代谢筛查未见异常。入院8 d患儿仍有呼吸费力、气促表现,转监护病房,予经鼻高流量吸氧,SpO2仍不能维持在0.90以上,遂予气管插管机械通气,SpO2回升。超声心动图示卵圆孔未闭,胸部CT平扫无明显异常,增强CT提示两肺内小血管偏多,血管畸形待排除,纵隔多发小血管,两肺多发条索影及渗出(图1A),考虑肺动静脉畸形(pulmonary arteriovenous malformation, PAVM)。为明确有无其他内脏血管畸形,完善全身增强磁共振成像(magnetic resonance imaging, MRI)提示脑干前方、右侧额叶表面见一迂曲扩张的静脉显影,考虑为动静脉畸形。入院20 d行数字减影血管造影(digital subtraction angiography, DSA),见右肺动脉呈弥漫性葡萄串样小血管池表现,右上、右下肺静脉显影提前(图1B)。导管分别于右上、右下、左上、左下、肺静脉抽取血液,测血氧饱和度(氧分压)分别为0.863(54.9 mmHg, 1 mmHg=0.133 kPa)、0.812(51.6 mmHg)、0.880(59.2 mmHg)、0.995(117 mmHg),左房血氧饱和度(氧分压)0.927(66.7 mmHg),提示右肺和左上PAVM。同时术中脑血管造影证实大脑前动脉供血的软脑膜动静脉瘘(图1C)。PAVM诊断明确。患儿家属放弃治疗出院。入院27 d基因回报提示KAT6B及SERPING1基因位点变异,为与患儿表型部分相关的临床意义未明位点。
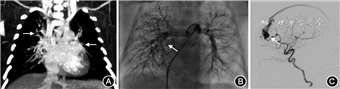

随访:患儿家中长期吸氧支持,5月龄门诊随访,患儿面色发绀伴严重杵状指,吸氧下(3 L)SpO2 0.40~0.70,患儿于5月龄家中死亡。
PAVM是指肺动脉和肺静脉之间存在毛细血管床的异常直接连接,一般人群中发病率极低,尚缺乏确切数据,男女比例为(1.5~1.8)∶1。大部分PAVM直到成年期才被诊断,仅10%的病例在儿童时期被发现[1]。少部分PAVM胎儿时期可通过宫内早期诊断发现,Hellmund等[2]报道1例胎儿在其母妊娠22周时行超声心动图发现严重扩张性心脏肥大,动脉导管逆行灌注,彩色多普勒显示右肺下叶背侧有湍流血流,提示PAVM,患儿36+1周胎龄时剖宫产出生,生后即刻超声心动图和心导管检查显示右肺动脉和左心房之间有瘘,行血管内栓塞封闭瘘管后康复出院。可见PAVM的宫内早期诊断对于制定适当的治疗策略是极其重要的。PAVM可以是单灶性病变,也可是多灶性病变,本例患儿为弥漫型PAVM,是一种罕见的PAVM,其特征是血管畸形累及整个肺节段甚至整个肺,患儿出生后曾被诊断为肺炎感染,予抗感染及呼吸支持治疗后患儿发绀症状仍较明显,随访心脏超声未提示有先天性心脏病,故怀疑肺内血管畸形,完善增强CT后提示肺内血管异常,行DSA术后明确诊断PAVM。这类病例的漏诊并不罕见,Aggarwal等[3]报道了2例PAVM患儿,1例4月龄男婴行胸部X线检查后被误诊为肺炎,行胸部CT后确诊右下叶PAVM,1例新生儿被误诊为肺动脉高压,行DSA术后确诊左下叶PAVM,2例在明确诊断和适当的干预前,都应用了体外膜肺氧合。非增强CT薄层1~2 mm扫描被认为是PAVM诊断的金标准,其足以识别高度特征性的供血动脉、引流静脉和两者之间的囊状或瘘管连接。然而,一些医疗机构倾向于选择增强CT检查,以更好地确定PAVM的血管解剖结构,帮助制定治疗计划。DSA具有更高的空间与时间分辨率,可更准确描绘PAVM的血管结构,如扩张的供血动脉和引流肺静脉,还有助于实时评估早期静脉回流情况[4]。PAVM根据病因可分为先天性、获得性与特发性。大部分PAVM是先天性的,常伴发遗传性毛细血管扩张症(hereditary hemorrhagic telangiectasia, HHT)。Gludovacz等[5]报道1例患儿生后复苏30 min后死亡,尸检提示左PAVM,其母亲及外祖父曾患有HHT。本例患儿增强MRI和DSA发现右额叶、脑干前房异常粗大血管影,提示脑内血管畸形,基因回报未发现HHT相关位点变异,故HHT诊断尚不明确。PAVM的治疗指征包括供血动脉≥2 mm、病灶范围逐渐增大、存在症状性低氧血氧、存在反常栓塞、发生其他严重并发症。自20世纪80年代引入血管内栓塞疗法以来,栓塞已经成为治疗PAVM的主流疗法。血管内栓塞是一种微创手术,可最大限度地减少肺实质的损失,且其创伤性小,可减少外科治疗相关的风险[6]。对于弥漫性PAVM无法进行血管内栓塞,仍需选择手术治疗。Ruf等[7]报道1例患儿在确诊左上肺叶多发性弥漫性PAVM后无法选择血管内栓塞治疗,而进行了左肺动脉分支环扎术,避免了左肺的全切除。本例患儿因病变范围广泛无法进行介入栓塞或手术切除,后期仍需长期随访,如果低氧血症持续进展或病灶范围扩大,可考虑进行部分血管内栓塞或肺移植治疗,但远期预后难以预测。随访中患儿因低氧血症持续进展而死亡。当新生儿出现持续性低氧血症但心脏结构正常时,需考虑PAVM的可能性,应行胸部CT检查,并询问有无HHT家族史,以期早期发现PAVM以避免严重的临床并发症。
所有作者均声明不存在利益冲突



























