
1例6岁2月龄患儿因“确诊ABCA3基因变异所致弥漫性肺间质病4年余,接受肺移植6个月,拔除气管套管”入住深圳市儿童医院呼吸科。确诊初期予泼尼松、阿奇霉素及羟氯喹三联治疗,效果不佳,呼吸困难进行性加重,生长发育严重落后。4岁起反复肺部感染伴慢性呼吸衰竭急性加重多次进入重症监护病房气管插管机械通气,5岁6月龄接受双肺移植,术后因双侧膈肌麻痹,给予经鼻双水平无创通气,随访至患儿6岁7月龄情况良好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
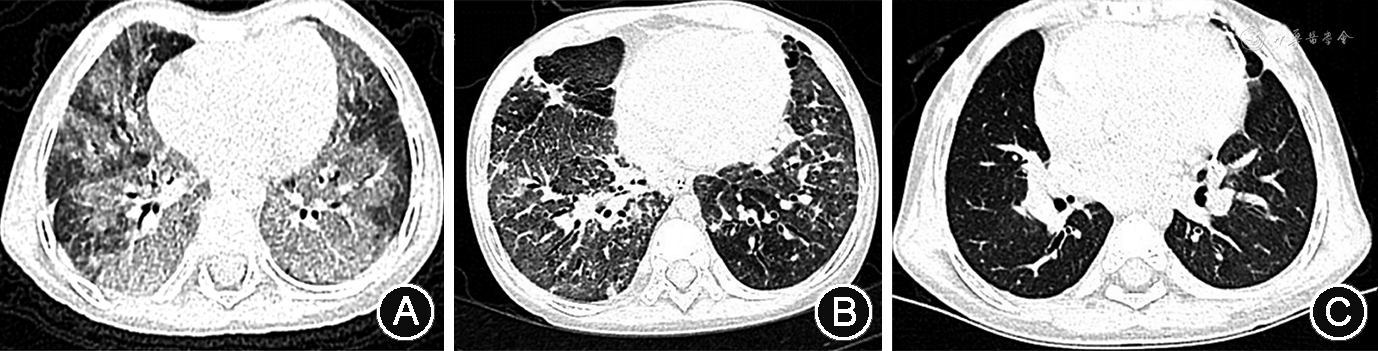
患儿 女,6岁2月龄,因“确诊ABCA3基因变异所致弥漫性肺间质病(diffuse interstitial lung disease,DILD)4年余,接受肺移植6个月,拔除气管套管”于2021年5月在深圳市儿童医院呼吸科病房住院。1岁9月龄患儿因“咳嗽、气促、生长发育落后9个月”于2016年12月在本院就诊,胸部CT提示两肺多发磨玻璃影、透过度不均匀,二代基因测序诊断为ABAC3基因复合杂合变异所致儿童弥漫性肺间质病。确诊初期给予患儿泼尼松、阿奇霉素及羟氯喹三联口服及家庭氧疗(鼻导管1 L/min),间断有咳喘加重或发热,予加强抗感染及抗炎治疗后可缓解。患儿2岁时(2017年3月)复查胸部CT提示患儿双肺弥漫性磨玻璃影进一步加重,双肺透亮度明显降低(图1)。患儿3岁(2018年3月)起因气促、呼吸困难,改为面罩吸氧(4 L/min)。患儿4岁9月龄(2019年12月)因“进行性呼吸困难1年余”再次入住本科,给予经鼻高流量给氧,改为甲泼尼龙每月冲击治疗联合阿奇霉素及羟氯喹口服。患儿5岁(2020年3月)起因“反复出现严重呼吸衰竭,伴有浮肿、腹胀”3次入住本院重症监护病房,胸部CT提示患儿肺部病变明显加重(图1),诊断为“急性肺源性心脏病、重度肺动脉高压、心包积液、腹腔积液、重度营养不良”。患儿5岁6月龄(2020年9月)在外院成功接受双肺移植手术,术后顺利撤出呼吸机,但因出现双侧膈肌麻痹,气管切开中,夜间需接受双水平正压无创通气。患儿系其母第1胎第1产,足月自然出生,出生体重3 150 g,出生情况正常,精神、运动发育正常,体重增长缓慢,5岁6月龄接受肺移植前体重仅11.5 kg。家族中否认类似病史及遗传病史,其父母亲体健,为ABAC3基因变异携带者。

入院体格检查:体温 36.3 ℃,呼吸 28次/min,脉搏100次/min,体重 13 kg,脉搏血氧饱和度0.97(清醒、未吸氧),慢病面容,重度营养不良貌,多毛状,气管切开处干燥、无渗血及渗液,呼吸平稳,无吸气性凹陷,双肺呼吸音清、对称,未闻及干湿啰音,心腹查体无异常,四肢肌力、肌张力正常,神经系统体征阴性,可见轻度杵状指(趾)。
诊疗经过:入院后患儿继续口服环孢素及泼尼松抑制移植后排斥反应,接受支气管镜检查未发现有气道肉芽及明显气道狭窄或软化,胸部CT提示右肺上叶陈旧性实变,无移植后间质性肺损伤改变(图1)。行多导睡眠监测提示低通气及矛盾呼吸,考虑双侧膈肌麻痹所致。遂予堵管、拔除气管切开套管,夜间改为经鼻双水平正压通气,予出院,定期随访复查。
随访:患儿6岁7月龄,已肺移植后1年余,患儿无反复发热、咳嗽、喘息,一般情况好。每3个月复查血常规、肝肾功能、血气分析均正常,复查膈肌超声提示膈肌运动较前有改善。环孢素继续口服中,泼尼松逐渐减量,准备停药。
ABCA3基因编码的三磷酸腺苷结合盒亚家族成员3(ATP-binding cassette subfamily A member 3,ABCA3)蛋白在肺泡Ⅱ型上皮细胞内的板层小体膜表面表达,主要参与脂类的跨膜转运,对于板层小体的形成以及肺表面活性物质的合成和稳态具有重要作用。ABCA3基因变异是引起肺表面活性物质代谢异常的最常见基因缺陷[1]。本例患儿婴幼儿期起病到5岁接受肺移植,临床症状进行性加重,早中期表现为咳喘、气促、生长发育落后,至学龄前期以慢性呼吸衰竭反复急性加重为主要表现。其影像学婴幼儿期表现为炎症性间质性肺炎,学龄前期以肺气肿、纤维化为主要表现。这与国外报道相似,ABCA3基因变异所致儿童DILD的临床、影像具有年龄依赖性[1, 2, 3]。这也提醒临床医生遇到不明原因的影像学表现各异的肺间质病时都要考虑到单基因肺病可能。ABCA3基因变异所致儿童DILD并无有效治疗方案。泼尼松、羟氯喹、阿奇霉素三联是最常用治疗方案,但疗效不确切,治疗效果往往是暂时的[3]。本例患儿药物治疗效果差,婴幼儿期使用泼尼松、阿奇霉素及家庭氧疗病情尚稳定,但到学龄前期临床症状进行性加重,加用羟氯喹以及改用甲泼尼龙冲击治疗均无效。有个案报道ABCA3基因变异所致DILD等待肺移植患儿,使用甲泼泥龙定期冲击三联治疗病情明显好转后无需肺移植[4]。因此泼尼松、羟氯喹及阿奇霉素三联抗炎治疗可能对病情早期、症状轻、进展慢的ABCA3基因变异所致DILD更有效。而对于起病早、病情重的患儿可能需尽早启动甲泼泥龙冲击、羟氯喹及阿奇霉素强效三联抗炎治疗,以更有效减轻肺部炎症,改善症状,减缓肺纤维化进程。ABCA3基因变异所致DILD起病越早,预后越差,生后5年存活率低于20%[3]。对于重症ABCA3基因变异所致DILD患儿肺移植是唯一替代治疗方法。国外总结了1993至2015年44例因肺表面活性物质代谢障碍(包括SFTPB、SFTPC、ABCA3、NKX2-1基因)肺移植患儿的预后[5],5年生存率婴幼儿为56%、儿童为79%,其远期并发症主要为高血压、移植后闭塞性细支气管炎、移植后淋巴组织增生症及肾功能不全等。国内尚无儿童肺移植中长期预后的报道,本患儿肺移植后时间短,需仍需长期随访。另外,本患儿在肺移植前已出现严重并发症(肺心病、重度肺动脉高压、心包积液、腹腔积液、重度营养不良等)。随着我国儿童肺移植技术日趋成熟,其肺移植时机前移是否可更有利于该类儿童的生长发育,值得广大儿科医生关注。
所有作者声明无利益冲突



























