
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
瞳孔检查是眼科和神经科检查的重要项目。该检查具有便捷、无创、无需依赖昂贵设备等优点。因瞳孔的大小和活动是由自主神经系统控制,故瞳孔检查可反映患者无法主观控制的视功能信息。在部分眼科疾病中,瞳孔的改变可能是唯一的阳性体征,瞳孔检查是评价相关疾病的重要客观依据。此外,瞳孔检查对患者的配合程度要求低,对于婴幼儿、老年人及重病患者,仍可行瞳孔检查。掌握正确的瞳孔检查方法,对眼科疾病的临床诊断具有重要意义。
瞳孔检查主要包括以下内容:瞳孔的大小和形态、瞳孔是否对称、瞳孔的对光反应情况、是否存在相对性传入性瞳孔障碍(relative afferent pupillary defect,RAPD)和近反射。
瞳孔受交感神经和副交感神经支配。交感神经兴奋使瞳孔散大,副交感神经兴奋使瞳孔缩小。
瞳孔的交感神经支配为三级神经元链。一级神经元起始于下丘脑后部,向下延伸通过脑干到达脊髓和Budge睫脊中枢突触(C8-T2水平)。在中脑,交感神经走行毗邻滑车神经核。二级神经元离开脊髓后沿腹部和胸部脊髓旁交感神经链走行达肺尖, 在颈部与颈动脉相关联,在下颌角处颈上神经节内形成突触,由此发出三级神经元。支配眼部的交感神经纤维在颈内动脉血管外膜内穿行入颅,进入海绵窦,随后汇入三叉神经眼支入眶。眼交感神经纤维支配瞳孔开大肌、Müller肌和下睑缩肌。支配面部汗腺及血管舒张的交感神经纤维沿颈外动脉分支走行,在颈上神经节处离开[1]。
副交感神经系统起源于视网膜神经节细胞,支配瞳孔的神经纤维与视觉纤维相伴行。瞳孔运动纤维在到达外侧膝状体前离开视束,通过上丘臂到达中脑顶盖前区。双侧中脑顶盖前核通过中间神经元与双眼瞳孔副交感神经纤维相交联。顶盖前核通过轴突与双侧E-W核交联。副交感传出纤维离开E-W核后并入动眼神经到达眶内睫状神经节。节后神经纤维支配收缩瞳孔的瞳孔括约肌和负责调节的睫状肌。瞳孔括约肌神经肌肉接头处乙酰胆碱释放导致瞳孔收缩[1]。
室内光线环境下,健康成年人瞳孔直径为3~4 mm。直径<2 mm者称为瞳孔缩小,直径>5 mm称为瞳孔散大。老年人瞳孔较小,年轻人和焦虑者瞳孔偏大。在暗光线环境下检查,约20%健康人双眼瞳孔直径可相差≥0.4 mm,在通常室内光线环境下仅10%健康人存在此现象,称为生理性瞳孔不等[2]。3%~4%健康人双眼瞳孔直径可相差1.0 mm以上。瞳孔不等可为生理性,也可为病理性[1,3,4]。确定瞳孔不等是生理性还是病理性,需在明光线和暗光线环境下分别测量瞳孔直径。生理性瞳孔不等在明光线和暗光线条件下,瞳孔直径不等的程度相对一致[5,6,7]。
可使用手持式瞳孔尺、手持式瞳孔照相机或红外线瞳孔测量仪测量瞳孔直径。手持式瞳孔照相机的测量数值较手持式瞳孔尺更为精确,可测量瞳孔直径、比较药物试验前后瞳孔的变化以及比较在不同光源强度下瞳孔的变化。红外线瞳孔测量仪的测量数值较手持式瞳孔照相机更为精确,不但可在有光线的条件下测量瞳孔直径,而且可在完全黑暗环境下进行测量[3,5,6]。
病理性瞳孔不等可因交感通路或副交感通路异常所致。若瞳孔直径不等在暗光线环境下更为明显,则较小的瞳孔为异常瞳孔,提示支配瞳孔的交感神经麻痹。若瞳孔不等在明光线环境下更为明显,则较大的瞳孔属异常瞳孔,表明该瞳孔无法正常收缩,提示支配瞳孔的副交感神经麻痹。瞳孔不等患者均应检查眼睑和眼球运动情况[3,4,5,6,7]。
采用裂隙灯检查法可发现影响瞳孔大小和形态的外伤或伴有睫状肌痉挛和瞳孔缩小的前房炎性反应[6]。瞳孔形态异常主要见于虹膜缺失、瞳孔残膜以及炎性反应、缺血或外伤导致的局限性虹膜萎缩。此外,继发于霍纳(Horner)综合征的部分瞳孔括约肌痉挛可引起单侧蝌蚪状瞳孔。检查瞳孔时应注意是否存在瞳孔括约肌自发运动,是否在强光线环境下产生对应的更大程度的瞳孔收缩,是否部分瞳孔括约肌节段较其他部分收缩更强烈,是否可观察到自发性的病理性蠕虫样运动(在突然的裂隙灯强光线照射下,邻近瞳孔缘的未受累的虹膜括约肌节段突然收缩,而相邻的麻痹虹膜节段不收缩,但可因附近正常的虹膜节段收缩而被牵拉移动)。如果瞳孔对光刺激无反应,需检查近反射。
瞳孔对光反应检查包括直接对光反应检查和间接对光反应检查。直接对光反应是指在暗光线环境中,用适度光源直接照射一眼瞳孔时,该眼瞳孔缩小。间接对光反应是指在适度光源照射一眼瞳孔时,对侧眼瞳孔缩小。检查时可使用间接检眼镜或聚光式手电筒光源。光源照射一眼瞳孔时,尽可能避免影响对侧眼。检查时用光源照射一眼瞳孔,观察双眼的瞳孔对光反应。在观察瞳孔间接对光反应时,同时用一个暗光源斜照对侧被观察眼效果更佳[6,8]。
检查瞳孔对光反应时应注意以下几点:(1)要在安静的暗室内进行。检查室越暗,瞳孔越大,越容易发现双侧瞳孔对光反应的细微差别。(2)患者应注视远处固定目标,若检查时患者直接注视光线,瞳孔收缩包含近反射因素,则无法准确评价瞳孔的对光反应情况。(3)使用明光源时,光线越亮,双眼传入通路对光线传导的相对差异越明显。建议使用间接检眼镜或卤素灯进行检查,眼科笔式聚光手电筒也可使用[6,7,8]。
RAPD既往称为Marcus-Gunn瞳孔,即由于单侧或非对称性视神经和视束病变、部分视交叉病变、严重的视网膜病变等,行交替光照试验时"健眼"与"患眼"瞳孔反应不对称的体征[5,6,9,10,11,12,13]。典型的RAPD表现为在交替光照试验时,光源照至"患眼","患眼"瞳孔散大。
典型的RAPD多见于单侧视神经病变和严重的视网膜病变。以下情况可导致RAPD:单侧或双侧严重程度不等的视神经疾病(如视神经炎、外伤性视神经病变、缺血性视神经病变等)、单侧视束病变、部分视交叉受累的疾病,单眼前房积血或玻璃体积血、单眼大范围视网膜脱离或严重的视网膜和黄斑疾病(如视网膜中央动脉阻塞、缺血型视网膜中央静脉阻塞)。以下情况不导致RAPD:白内障、屈光不正、外侧膝状体之后的视路病变、非器质性视力下降(单眼白内障患者即使白内障程度较重,因进入瞳孔的光束经混浊的晶状体向各个方向折射到视网膜,故也无RAPD或仅出现轻微RAPD)。视力为0.1及以上的黄斑疾病,其RAPD通常在0.5 log单位以下[5,6,10,11,12,13,14,15,16,17]。
采用交替光照试验。被检者进入暗室,暗适应约5 min后双眼平视前方。检查者手持光源,从下方与视轴呈15°~45°照射瞳孔。照射瞳孔的角度应相对固定,一眼照射时间2~4 s,然后迅速移至另一眼[16,17,18,19,20]。以平稳的频率在双眼间交替移动,观察并比较双眼瞳孔的直接对光反应情况[5,6,7,9,10,11,12,13,14,15,16]。
(1)在暗室内检查结果更为准确。(2)注视距离应固定,若注视距离不固定,尤其当患者直接注视光线时,瞳孔收缩包含近反射因素,则无法评价对光反应情况。(3)使用明亮的手持聚光光源,光线越亮,双眼传入通路对光线传导的相对差异越明显。但是,当光源太亮时,瞳孔不能迅速重新放大,光线在双眼间交替时,无法观察到瞳孔运动的变化,此时需降低光源强度或将光源移至距眼8~10 cm处。(4)双眼照射时间应相等, 以防止双眼视网膜感光细胞不对称漂白引起的假性RAPD。通常照射时间为2~4 s。(5)连续观察4~6个反应,以确定RAPD存在与否。(6)重复检查时应休息足够的时间[5,6,7,9,10,11,12,13,14,15,16]。
单侧瞳孔固定和单侧瞳孔传出功能障碍常见于单侧瞳孔药物性散大、单侧瞳孔外伤性散大及功能障碍。此时行双眼瞳孔交替光照试验观察"健眼"瞳孔,并以"健眼"的瞳孔反应作为判断标准。检查时,用手持光源从侧方(接近90°)照射健眼,以便清晰观察"健眼"瞳孔的变化,在看清瞳孔的前提下,尽可能避免侧方光线影响瞳孔反应。通过观察"健眼"判断患眼是否存在RAPD。例如对左眼瞳孔固定患者行交替光照试验时,光线照射右眼,右眼瞳孔收缩,光线照射左眼时观察右眼瞳孔,此时右眼瞳孔若散大,则证明左眼RAPD阳性[5,10,11,20,21,22,23]。
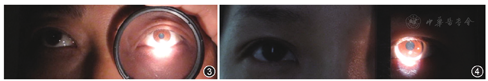
对RAPD进行定量检测时可使用线状中性密度滤镜(图1)或摄影用不同单位的中性密度滤镜片(图2)。使用中性密度滤镜对RAPD行定量检测的原理:采用交替光照试验行RAPD检查时,将中性密度滤镜置于"健眼"前或光源前(图3,图4),中性滤镜可过滤部分光线,适当单位的中性密度滤镜可使双眼瞳孔反应平衡,以此时所用中性密度滤镜的单位表示"患眼"RAPD的程度[5,10,11,19,20,21,22]。需要注意的是,部分伴有单侧瞳孔功能障碍的患者,使用中性密度滤镜行RAPD定量检测时,因"患眼"瞳孔收缩功能障碍,双眼瞳孔对光反应难以达到平衡,增加了RAPD定量测定的难度。当怀疑一眼瞳孔有轻度RAPD时,可使用中性密度滤镜行RAPD诱导试验。采用交替光照试验,光线照射双眼瞳孔时分别将0.3 log单位滤镜置于眼前或光源前。当滤镜置于患眼前时RAPD更明显、置于健眼前无明显RAPD时,证实"患眼"RAPD阳性[5,12,13,22,23,24,25]。



注视近处物体时瞳孔缩小,同时发生调节和集合作用,称为瞳孔近反射。儿童和青少年经常在注视距离移至很近(约10 cm)时,才出现近反射。当存在单侧或双侧瞳孔对光反应异常时,应行近反射检查。行瞳孔近反射检查时,照射光的强度应足够,以便能清晰观察瞳孔,表面颜色鲜艳的物体应缓慢向眼前移动。检查结果通常表现为瞳孔对光反应和近反射同样受损或者正常。部分患者对光反应存在异常,但近反射相对正常,这种情况称为光-近反射分离。
在一些疾病的诊断中,近反射检查尤为重要。通常是在检测光-近反射时瞳孔对光反应阴性,但近反射阳性,这种瞳孔光-近反射分离现象见于强直性瞳孔、Argyll Robertson瞳孔以及背侧中脑综合征。
对于部分瞳孔异常的疾病,可以行瞳孔药物试验。瞳孔药物试验的常用药物包括0.125%或0.1%毛果芸香碱、10%可卡因、1%羟化苯丙胺、1%安普乐定等。
强直性瞳孔又称Adie瞳孔,是一种良性瞳孔异常,其特点为突发的副交感神经麻痹导致瞳孔散大。典型的强直性瞳孔在行0.125%或0.1%毛果芸香碱药物试验时具有特征性改变。低浓度的毛果芸香碱不会使正常瞳孔缩小,但可使Adie瞳孔收缩,这是由于Adie瞳孔去神经支配后出现过度敏感性。应注意在Adie瞳孔的早期,0.125%或0.1%毛果芸香碱不会引起Adie瞳孔缩小,直至去神经支配后过度敏感性出现时,瞳孔才会收缩(图5)。
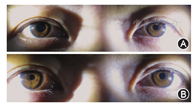

霍纳综合征是由于眼部交感神经功能障碍所致。其明确体征是上睑下垂和瞳孔缩小。0.5%或1%安普乐定(Apraclonidine)眼液可作为确诊霍纳综合征的一线诊断性药物。安普乐定是直接α受体激动剂,其不会使交感神经支配正常的瞳孔散大,但可使任何部位病灶导致的去交感神经支配的瞳孔出现轻度散大。安普乐定眼液点眼30~45 min后,缩小的瞳孔散大,患眼瞳孔大于健眼可使下垂的眼睑上抬。
羟苯丙胺通过促进肾上腺素能神经末梢存储的去甲肾上腺素释放而使正常瞳孔散大。其也会使一级和二级霍纳综合征的瞳孔散大。此时三极(节后)神经元末梢存在去甲肾上腺素,但由于节前交感神经麻痹而未能释放。而当三极(节后)神经元病变时,因神经末梢受损,故无足够的存储去甲肾上腺素可释放,因此三级(节后)神经元病变所致的霍纳综合征瞳孔不散大。


























