
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
光学相干层析血流成像(optical coherence tomographic angiography,OCTA)是一种在平面(en face)OCT的基础上,采用分频幅去相关血流成像(split-spectrum amplitude decorrelation angiography SSADA)方法[1],无创显示视网膜及脉络膜血流形态及变化的新技术。目前,OCTA已应用于中心性浆液性脉络膜病变[2]、脉络膜新生血管[3]、息肉样脉络膜血管病变[4]和糖尿病视网膜病变[5]等多种视网膜、脉络膜病变的诊断和治疗中,具有广阔的临床应用前景。充分了解OCTA的操作技术特点,掌握OCTA的图片特征及读片要点,才能更好地将该技术应用于临床,提高视网膜脉络膜血管疾病的诊疗水平。
OCTA本质上是OCT技术的衍生,而SSADA是一种应用于OCTA,提高图像质量的演算方法,检查者必须明白其成像的原理和特征,才能合理并清晰地对图像进行系统分析。
在正常状态下,血液是流动的,不同时间点通过同一截面的血细胞不同。SSADA通过对同一截面进行多次B扫描,将多幅图像中有差异的像素点(血流)保留,并去除无差异的像素(组织),即完成去相关步骤。而分频幅是对图像清晰度增强的演算方法,将原始的图像分为不同的频谱去除图像噪声,再将其合而为一。与其他演算方法比较,分频幅在去除图像噪声的同时又可最大量地保留细节,使原始的图像资讯不至于丢失[6]。分频幅演算后,不同位置B扫描的去相关图像经过位置校正,可确保无错位。最终,软件将所有的B扫描合并,从而得到完整的三维去相关立体图像。检查者可以选择观察不同层面的视网膜和脉络膜血管的结构形态,并根据实际需要观察的目标深度和层面厚度进行细微调整。
OCTA的图片看似与传统眼底血管造影图片类似,但由于成像原理不同,临床医师不能将分析传统眼底血管造影影像的方法生搬硬套用于OCTA的图片,而是应该充分认识到OCTA与传统眼底血管造影的差异以及两者各自的优势及局限性,将两者结合,方能更好地将OCTA应用于各种视网膜脉络膜血管疾病的诊疗中。
OCTA的图像来源于组织本身,不需要注射造影剂。因此,OCTA图片的获取无创且方便快捷,可在每次就诊时均进行OCTA检查,有利于对疾病变化进行随访观察。此外,对于那些不宜行FFA或ICGA检查的患者也可以行OCTA检查[7]。
尽管FFA检查可观察视网膜毛细血管,但其无法显示全部的血管,如视盘周围放射状毛细血管[8]和深层视网膜毛细血管[9]。而使用OCTA,可以获得视网膜脉络膜血管网络的三维图像,显示视网膜不同层次的血流,观察视盘周围毛细血管网和内、外层视网膜血管丛[10]。
OCTA仅显示血流形态,无法显示传统FFA的渗漏、积存或着染等现象[11]。然而,正是因为无法显示上述现象,OCTA可以更加清晰地显示异常微血管的结构。
由于与蛋白的结合率高且入射光的波长较长,故ICGA可以显示RPE下血管。然而,吲哚氰绿的对比度低,无法明确显示血管的准确位置。OCTA可以分层显示RPE下的血管,不仅能够明确血管的位置,而且具有较高的分辨率[12]。
传统眼底血管造影为动态检查,其成像时间可分为早期、中期和晚期[13],通过比较血管充盈时间,以获得患者视网膜的血流信息[10]。而OCTA是静止的,在不同时间可获得相同的图像。
目前OCTA在后极部的最大扫描范围为8 mm×8 mm,观察周边视网膜病变还需依赖传统眼底血管造影。
鉴于OCTA和眼底血管造影各自的特点,两者应用于不同眼底疾病的诊断。对于累及周边部视网膜和影响视网膜血管屏障功能的疾病,如视网膜静脉阻塞、糖尿病视网膜病变、视网膜血管炎,眼底血管造影检查能够发现周边部的无灌注区、新生血管、视网膜血管壁异常,其检查结果对于治疗时机的选择和疗效评估极为重要。受到扫描范围的限制,OCTA不能很好观察周边视网膜,因此具有一定的局限性。而对于后极部病变,尤其新生血管类疾病,OCTA可以清晰显示异常血管的形态、层次及位置;并且因为是无创检查,可以重复检查以动态观察异常血管的变化,因此OCTA对于此类疾病的随访极为重要。
OCTA在成像过程中,伪影几乎不可避免。因此,了解伪影的来源,准确区分伪影和真正的血流信号,对于正确读片至关重要。OCTA中的伪影有多种来源,包括图像获取过程中产生的伪影、眼部组织本身结构特点导致的伪影、眼球运动相关伪影、图像处理过程中产生的伪影及投射伪影等。
OCTA的图像获取依赖于在同一位置进行多次扫描,因此对扫描速度要求较高。当提高扫描速度时,图像质量就会受到影响,从而在图像获取过程中产生伪影。为了提高图像质量,OCTA需要具有比结构OCT更快的扫描速度。
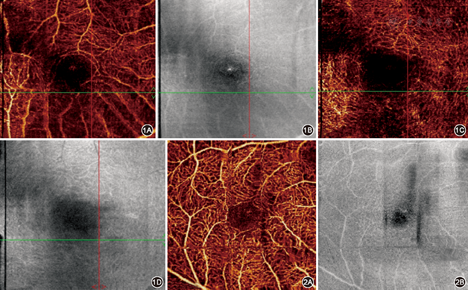
OCT光波在RPE的色素和紧密的脉络膜毛细血管网中会发生散射和衰减;此外,屈光间质混浊,如白内障、玻璃体积血、玻璃体混浊、视网膜出血等,均会引起OCTA信号衰减,使临床医师无法判断该区域是否存在血流(图1)。

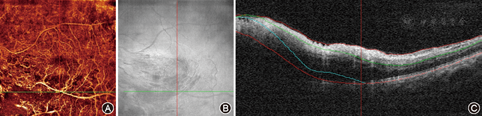
心动周期、呼吸、震颤和微小扫视运动导致视网膜和脉络膜出现轴向运动,从而产生伪影(图2)。
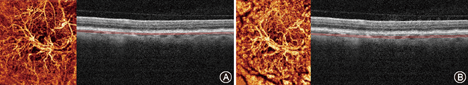
为了减少低信号或噪音引起的假血流伪影,OCTA常通过掩饰处理或阈值处理方法删除低信号或噪音,因此只有足够强的信号才能形成OCTA血流图像。当RPE和脉络膜毛细血管发生萎缩时,脉络膜深层血管的信号增强,使得原本没有血流的RPE层呈现出脉络膜血流。此外,特别需要注意的是通常OCTA会对获取图像进行后期处理,并参照Bruch膜或其他层次对视网膜脉络膜进行分层。但在病理情况下,如黄斑水肿、视网膜下出血等,正常的组织结构发生改变而出现分层错误。分析图像结果前,需要手动调整分层错误(图3)。

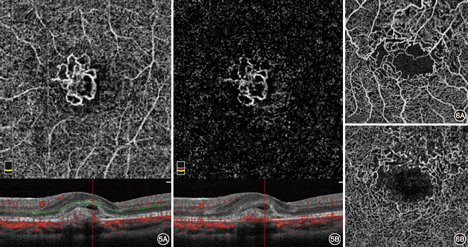
投射伪影是不可避免的,并且可以在所有血管结构下形成,因此了解投射伪影的产生原理对于准确进行临床评估具有重要意义。
光通过血管时可发生反射、折射或被吸收。运动的血细胞的反射光是OCTA成像的基础。然而,当光线穿过运动的血流,可能遇到血管下组织。当光线遇到RPE,可反射回OCT设备。因为血管中有处于不断变化的血流,因此穿过血管被反射的光线也在不断变化,形成类似血流的信号。因此,RPE上会看到类似视网膜血管的血流信号,此为投射伪影。OCTA中的投射伪影可来源于任何层次,视网膜血管层,甚至脉络膜血管层,只要在血管结构以下的层面,均有可能产生投射伪影。RPE层面由于存在色素,故在此层所能观察到的投射伪影最为明显(图4)。

尽管投射可影响OCTA的图像观察,但合理利用投射伪影,可更好地观察纤维血管性RPE脱离的新生血管形态,尤其在行抗VEGF治疗后,病变形成多个层次,即最内层为RPE,下方为新生血管,其下为纤维组织。当分层位置位于RPE下新生血管层所在的位置,在RPE层反射的视网膜血管会影响对新生血管的观察。然而,当将分层位置向下方纤维组织移动后,新生血管在纤维组织上的投影就可清楚显示,从而可以更为清楚观察新生血管的形态(图5)[12]。

在读片过程中,首先应判断扫描模式和扫描范围。目前有黄斑区和视盘区两种扫描模式。黄斑区扫描范围包括2 mm×2 mm、3 mm×3 mm、6 mm×6 mm及8 mm×8 mm,视盘区扫描范围为3 mm×3 mm和4.5 mm×4.5 mm。扫描范围越小,图像质量越高,对细节的分辨率越好。检查者需要根据具体需求选择合适的扫描模式和扫描范围。此外,需要特别注意观察的层面,OCTA可以对立体图像进行自动分层,也可手动调节选取需关注的层面。读片时不可只关注血流en face图像,应该结合结构en face图像、横断面扫描图像,进行综合评估分析。
OCTA虽然可显示视网膜和脉络膜的血流,但与传统眼底血管造影图像比较,存在很大差异。因此,在读片分析过程中,有必要使用新的术语描述血流的变化。
首先需要判断血管形状是否规则,有无血管扭曲或变形(图6)。
血流网络可能稠密、稀疏、增宽、扩张或扭曲。新的OCTA程序可以自动测量黄斑区浅层、深层视网膜层的血流密度和视盘周围放射状毛细血管的密度,这对于动态观察生理和病理状态下眼球微循环变化具有重要意义。对健康人黄斑区各层血流密度和视盘周围放射状毛细血管密度进行测量,发现随着年龄的增长,黄斑区血流密度降低,并且与眼轴和黄斑中心凹下脉络膜厚度无关[14]。
纹理在OCTA的描述中是一个全新概念,其可能为粗糙、颗粒状、微弱或斑点状等表现。
正常情况下,视网膜浅层可见视网膜血管形态自然,无异常扩张、扭曲、缺损,毛细血管网分布均匀,无异常缺损。黄斑拱环形态完整,无血管区直径一般为450~500 μm。深层视网膜黄斑旁血管呈叶片形或扇形分布,毛细血管分布均匀(图7)。外层通常无血管,表现为低血流甚至无血流的暗区。若发现血流信号,常提示脉络膜新生血管,需要进一步排除。脉络膜毛细血管层由于血流丰富,一般表现为均匀明显夹杂的信号图像。值得注意的是,在SSADA OCTA图像中,虽然亮度与血流的速度成正比,但当血流的速度超过其所能检测的上限时,血管将显示为暗色,这种情况多发生在脉络膜大血管层。SSADAD OCTA中脉络膜大血管由于血流快速,血管图像反而显示为黑色。随着扫描范围扩大,所能观察到较细微的血管细节会丢失,若需观察病灶细节,建议使用2 mm×2 mm、3 mm×3 mm两种扫描范围。但是,使用2 mm×2 mm、3 mm×3 mm扫描范围,对于患者固视的要求较高。对于固视差的患者可以使用较大范围的扫描方式。
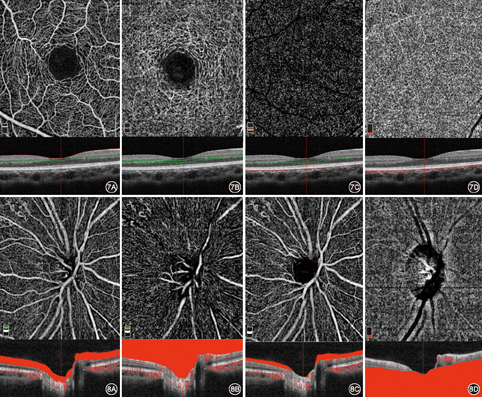

正常视盘的OCTA图像可见大血管走行自然,视盘内及视盘周围各象限的毛细血管分布均匀,无缺损。通常可配合神经纤维层厚度测量,综合评估视盘周围毛细血管的分布情况(图8)。
OCTA作为一种无创、三维、高分辨率的血流成像技术,在未来临床应用中必然有非常广泛的前景。因此,临床医师必须了解OCTA的原理和特点,明确其应用范围和图像特点,才能更加准确把握其临床适应证,更好地将OCTA应用于相应疾病的诊断和随访观察中。


























