
免疫球蛋白轻链型淀粉样变性(immunoglobulin light chain amyloidosis,AL)是一种多系统受累的单克隆浆细胞病,临床表现多样,缺乏特异性,误诊、漏诊率高。本文报道1例以巨舌、肾功能不全、水肿为主要表现的AL临床病例,并回顾总结其临床表现、诊断标准、预后等特征,以期提高其早期诊断,改善患者预后。

淀粉样变性是指以细胞外异常折叠(β折叠)蛋白为主的淀粉样物质在器官组织细胞外沉积所引起的一组疾病,其典型病理特点是受累组织刚果红染色阳性,临床表现多样,缺乏特异性,临床最常见的是免疫球蛋白轻链型淀粉样变性(immunoglobulin light chain amyloidosis,AL),是一种由异常克隆的免疫球蛋白轻链(κ或λ)损害组织器官造成多系统受累的单克隆浆细胞病,病情进展快,误诊、漏诊率高。本文报道1例结合以巨舌、肾功能不全、水肿为主要表现的AL病例。
(1)一般资料:患者男性,65岁,因“水肿1年半,肾功能异常1年,言语不清半年”于2019年10月就诊于吉林大学第一医院。患者入院1年半前出现双下肢水肿,1年前血清肌酐为181 μmol/L,服用中药治疗半个月。半年前无明显原因自觉舌体变大,出现舌根发硬,口齿不清,未诊治,口齿不清进行性加重。1周前双下肢水肿加重,自行服用利尿药后未缓解,就诊于吉林大学第一医院肾病内科,查血肌酐237.9 μmo/L,尿蛋白(+),以“肾功能不全”收入院。患者心率106次/min,血压132/79 mmHg(1 mmHg=0.133 kPa),神清、构音障碍。舌体大,可见齿痕。颈部左侧可触及数枚肿大的淋巴结;双侧下肢轻度水肿,余未见异常。
(2)辅助检查:总蛋白60.7 g/L,白蛋白33.9 g/L,尿素14.22 mmol/L,肌酐245.3 μmol/L,eGFR22.89 ml/min。尿常规结果显示尿蛋白(+),24 h尿蛋白定量和尿微量白蛋白定量分别为0.63 g和26.10 mg。24 h尿LAM轻链定量52.50 mg,24h尿KAP轻链定量115.80 mg。血常规:红细胞为3.87×1012/L,血红蛋白为121 g/L。D-二聚体为3.86 μg/ml,心肌损伤指标:肌酸激酶同工酶为4.99 ng/ml,肌钙蛋白I 为0.057 ng/ml,肌红蛋白为502.2 ng/ml,B-型钠尿肽为104 pg/ml。尿免疫固定电泳:免疫球蛋白κ轻链阳性。血清Free-λ链为457.00 mg/L,血清Free-κ链为146.00 mg/L。计算血清受累轻链和非受累轻链差值(dFLC)为311 mg/L(>18 mg/dl)。心电图示大致正常心电图。心脏超声示右室内径18 mm,室间隔厚度11 mm,左房内径增大;左室腔内肌小梁回声增多、增粗。室间隔、左室后壁增厚。室壁回声增强,可见颗粒样回声。左心室各节段搏动普遍减低;二尖瓣、三尖瓣及房间隔回声增强、增厚,表面不光滑;射血分数为51%,提示不除外心肌淀粉样改变。泌尿超声示双肾大小正常,实质回声增强,皮髓界限欠清晰。全腹CT示中上腹部腹腔脂肪间隙浑浊。
(3)初步诊断:肾功能不全,巨舌症。
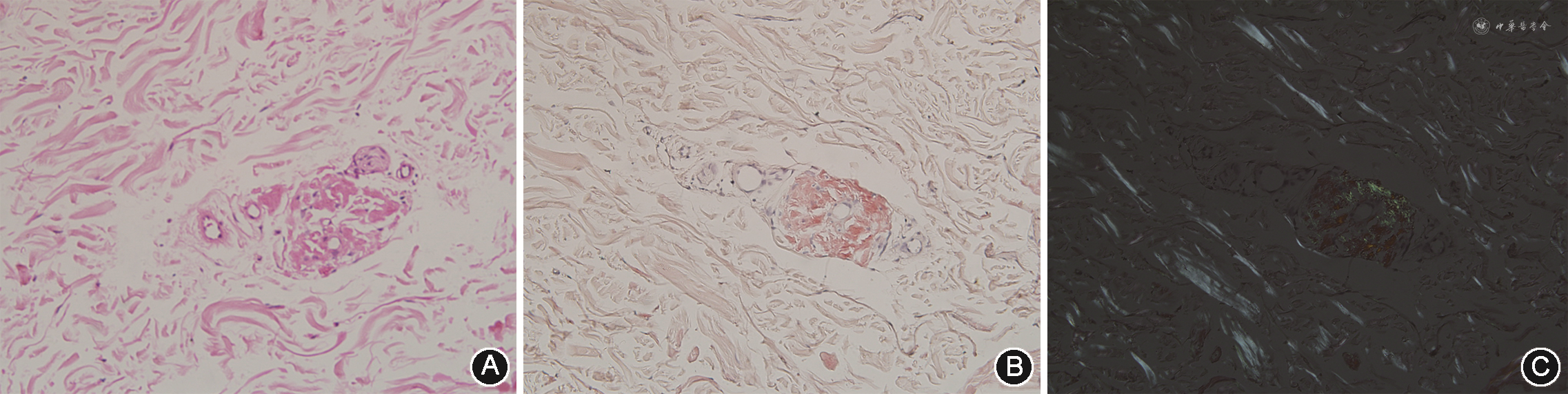
(4)进一步检查:患者舌、肾脏、心脏多器官受损,考虑系统性疾病继发引起,需进一步完善病理学检查,患者年龄较大,肾脏、心脏取活检风险大,且因经济原因拒绝该两项检查,故进一步完善舌、腹部脂肪、骨髓活组织检查。骨髓涂片:骨髓形态偏幼的浆细胞2%。流式细胞术:有核细胞中可见0.15%异常单克隆浆细胞。骨髓活检:考虑浆细胞骨髓瘤。刚果红染色(+)。舌组织活检:鳞状上皮增生,上皮下见少许纤维及横纹肌组织。免疫组织化学染色:Kappa(+),Lambda(+)。免疫荧光:Kappa(++),特殊染色:刚果红(+)(图1)。腹部脂肪活检:真皮内纤维组织增生,皮下脂肪小叶间隔显著增宽;刚果红染色(+),结果提示淀粉样变性。免疫组化:Kappa(+),Lambda(+)。特殊染色:刚果红(+)(图2)。



(5)诊断及随访:确诊为系统性轻链型淀粉样变性病。患者拒绝进一步治疗并出院,3个月后,死于心力衰竭。
淀粉样变性是一组以不溶性纤维蛋白在细胞外沉积为特征的疾病。至今已有超过30余种蛋白被证实可导致淀粉样物质沉积[1, 2]。常见的淀粉样变性包括AL、血清淀粉样蛋白A型淀粉样变性、转甲状腺素蛋白型淀粉样变性、β2微球蛋白型淀粉样变性4种类型[3],其中AL临床最常见,占淀粉样变性患者的70%[1, 2]。AL是一种多系统受累的单克隆浆细胞病,是由骨髓浆细胞异常克隆产生异常的免疫球蛋白轻链(κ或λ)错误折叠形成淀粉样蛋白纤维,并沉积于组织器官,造成组织结构破坏、器官功能障碍并进行性进展的疾病。淀粉样蛋白在病理上的特点是刚果红染色呈砖红色,偏振光显微镜下呈现出苹果绿色双折光,电镜下表现为直径8~14 nm、无分支排列紊乱的纤维丝状结构[1, 2, 4, 5]。
AL临床表现多样且无特异性,如心力衰竭、肾病综合征、肾功能衰竭、体位性低血压、体质量减轻、肝脾肿大、巨舌、眶周紫癜等,常表现为多器官受累,最常见的受累部位是肾脏(66%)和心脏(63%),其次是外周神经系统和自主神经系统(27%)、肝脏(20%)、胃肠道(16%)以及包括舌、皮肤等周围组织在内的软组织(15%)[2, 6, 7, 8, 9]。AL的诊断需满足以下标准[10]:①具有受累器官的典型临床表现和体征;②血尿中存在单克隆免疫球蛋白;③组织活检可见无定形粉染物质沉积,且刚果红染色阳性(偏振光下可见苹果绿双折光);④沉淀物经免疫组化、免疫荧光、免疫电镜或质谱蛋白质组学证实为免疫球蛋白轻链沉积;⑤除外多发性骨髓瘤、瓦氏巨球蛋白血症肾病或其他淋巴浆细胞增殖性疾病。本文报道的病例为老年男性,多器官受累,有巨舌、水肿,检查提示肾功能不全,心脏彩超不除外淀粉样变,尿免疫固定电泳单克隆κ轻链阳性,舌、腹部脂肪、骨髓的病理组织学活检刚果红染色阳性,免疫组化显示κ和λ轻链均为阳性,舌活检免疫荧光Kappa(++),骨髓活检及检查除外多发性骨髓瘤,符合AL诊断标准,可明确该诊断。
AL患者预后较差,若不及时进行治疗,中位生存期为6~12个月[3, 11],影响AL患者预后的重要生物学指标包括N端脑钠肽前体(NT-proBNP)、肌钙蛋白、dFLC及细胞遗传学异常[如染色体14q32、t(11,14)]等。同时器官受累情况也影响患者预后,其中心脏受累是患者死亡的主要原因(总生存中位时间为16个月)[12]。根据修订后的梅奥(Mayo)淀粉样变性分期系统,dFLC≥18 mg/dl、cTnT≥0.025 ng/ml、NT-proBNP≥1 800 pg/ml分别计为1分,分为0~3分的Ⅰ~Ⅳ期。对应总生存中位时间分别为94.1、40.3、14.0和5.8个月[2, 5, 11]。该案例中患者dFLC =311 mg/L,肌钙蛋白I 0.057 ng/ml,得分2分,梅奥分期为Ⅲ期,同时心脏彩超提示病变累及心脏,预后较差。
AL具有多器官易受累、起病隐匿、进展快、临床表现缺乏特异性、病死率高等特点,其因误诊、漏诊导致的晚期确诊是改善预后的障碍,早期诊断和治疗是改善预后的关键[1, 5, 9, 12]。本例患者既往水肿1年半,肾功能不全1年,巨舌症半年,未系统诊治,因舌体大、言语不清就诊,初诊为肾功能不全及巨舌症,但肾功能不全难以解释巨舌、心脏等多器官受损表现,在筛查继发性原因过程中发现尿免疫固定电泳单克隆κ轻链阳性,dFLC值异常,考虑由系统性疾病继发引起,进一步完善骨髓、舌及腹部脂肪组织活检后明确诊断为AL。提示临床上不能忽视患者原因不明、累及多器官的非特性临床表现,应注意将AL纳入相应疾病的鉴别诊断中,必要时对有症状的器官进行组织活检,若受累器官活检操作难度大,不易实施(如心脏活检),可选择易获取的组织(如皮下脂肪、骨髓、唾液腺)进行活检染色[2, 6],以做到早期诊断,及时干预,改善预后。
所有作者均声明不存在利益冲突



























