
发生于颌骨的成骨细胞瘤较少见,其发病机制尚无定论,因复发率高、可发生恶性转化以及缺乏特异性检测指标,临床病理诊断较难。本文报道1例成骨细胞瘤的病史、影像学和病理检测特点,并提出成骨细胞瘤进化发育假说,以期丰富对该疾病的认识,提高临床诊疗水平。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
发生在颌骨的成骨细胞瘤是一种少见的中间型(局部侵袭性)肿瘤,因复发率高并可发生恶性转化而引起人们的重视[1, 2]。该疾病常伴发剧烈疼痛,易与骨肿瘤混淆,且无特征性的组织学特点,缺乏特异性免疫组化和分子检测指标,成为病理诊断的难点之一。本文报道1例成骨细胞瘤的临床病理特点,并进一步探讨该疾病的病理改变机制。
(1)一般资料:患者女性,22岁,2021年2月因主诉“右侧下颌骨反复肿胀,伴右侧舌体麻木1个月”就诊于中国医科大学口腔医学院·附属口腔医院头颈外科,以“右下颌骨肿物”为初步诊断收入院。患者2年前因自觉右下后牙疼痛于外院就诊,考虑患者正畸病史诊断为炎症表现,未予处置。患者配戴保持器半年后自觉疼痛症状明显,于外院行右下第一磨牙根管治疗;根管治疗完成2个月后患者自觉右下颌骨肿胀,行根管冲洗后自觉肿胀消退,停止后又渐肿胀;2020年5月就诊于中国医科大学口腔医学院·附属口腔医院头颈外科,暂考虑炎症嘱观察。2020年6月于外院牙体牙髓病科行右下第一磨牙根管治疗,治疗完成后患者自觉右下后牙伸长感,咬合疼痛,遂行抗炎治疗,患者持续口服消炎药未见有效,行静脉滴注抗生素治疗,患者自述使用抗生素期间肿胀消退,停药后又渐肿胀。
(2)临床及影像学检查:患者双侧颜面部欠对称,右侧下颌区肿胀明显,表面皮肤略发红,皮温略高,无面瘫及局部麻木症状,开口中度受限,开口型基本正常,口内卫生状况可。右侧下颌区自44至磨牙后区牙龈向颊舌侧膨隆明显,触之质韧,似“乒乓球样感”,触痛(+),黏膜表面颜色未见明显异常,44、45、46松动Ⅰ度,47叩痛(+),44—47颊侧前庭沟变浅,余口内黏膜光滑连续,双侧下颌下及颏下未见明显肿大淋巴结。颌骨三维曲面重建CT图像显示,右侧下颌骨区占位性病变,右侧下颌骨骨体部至牙槽骨区见不规则骨性肿块影,密度不均,范围约2.6 cm×4.5 cm×4.0 cm,贯穿牙槽骨,呈膨胀性改变,内见不规则分隔及碎骨片影,病变区域与周围组织分界不清(图1A),邻近颌面部、颌下区脂肪间隙密度增高,双侧颈部及颌下区见多个肿大淋巴结影,余未见异常。
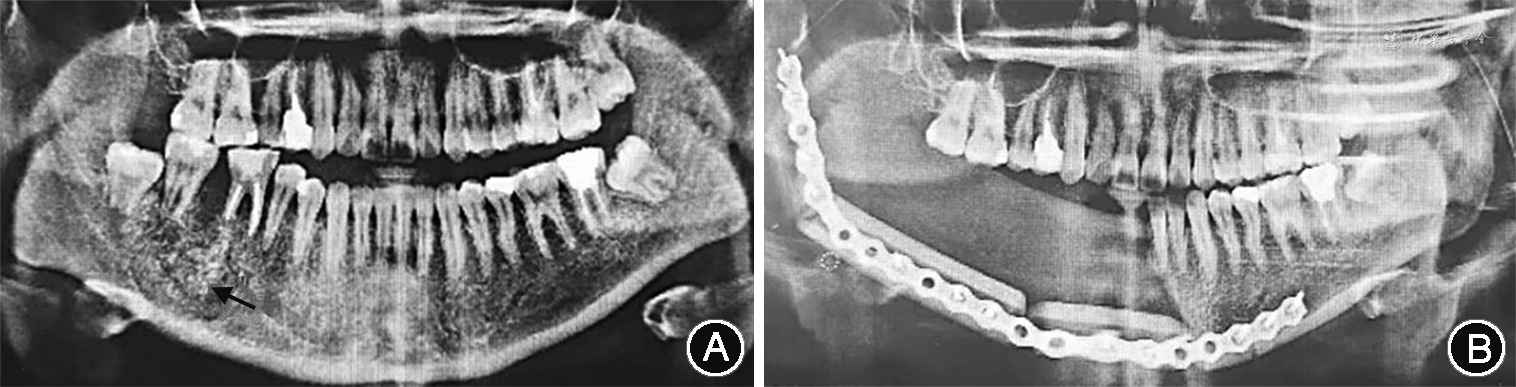

(3)治疗及预后:全身麻醉下手术摘除病灶及节段切除右侧下颌骨骨段,左侧腓骨皮瓣游离移植修复,置入连续钛板(图1B)。患者随诊6个月无复发。
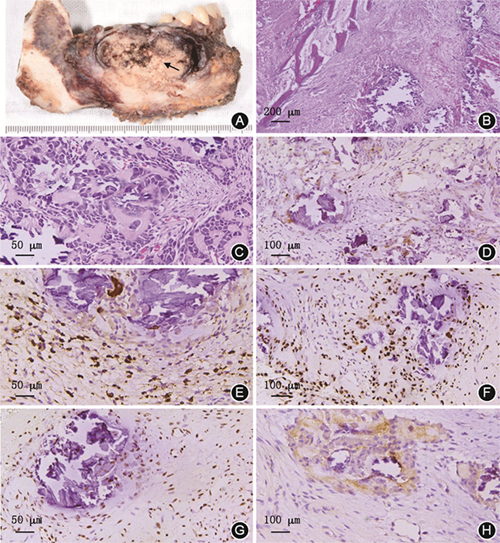
(4)病理诊断:术中切取1块花生瓣大小组织和1块米粒大小组织,粉红色,行冰冻病理检查,术中病理回报:低度恶性骨肿瘤,成骨细胞瘤可能性大,待石蜡切片染色进一步确诊。术后大体标本为9.2 cm×5.5 cm×6.0 cm,带6颗牙,颌骨向唇舌侧膨隆,骨质破坏,界限不清,质地坚实有沙砾感,可有部分软化、出血、坏死或囊性变表现(图2A)。HE染色显示大量异型增生的胞质丰富、胞核浓染的成骨细胞,呈“花边样”排列在类骨质岛边缘,可见病理性核分裂象。肿瘤间质富含血管,有梁状、片状的骨样组织和不同程度的钙盐沉着,并可见散在的多核破骨细胞样细胞和炎性细胞(图2B、2C)。免疫组织化学染色结果显示:细胞角蛋白(-),波形蛋白(+),S100(-),P53(-),Ki67(+),CD68(+),CD38(+),CD138(-),MUM1(-),P63(-),结蛋白(-),癌胚抗原(carcinoembryonic antigen,CEA)(-),HMB-45(-),特异序列AT结合蛋白2(special AT-rich sequence binding protein 2,SATB2)(+),组蛋白H3K36M(+),H3.3G34W(-)。肿瘤细胞Ki67阳性指数约为10%(图2D),CD68和CD38主要表达于多核巨细胞和浆细胞(图2E),成骨细胞胞核呈SATB2阳性表达(图2F),H3K36M表达于成骨细胞、多核巨细胞的细胞核(图2G),肿瘤细胞不表达H3.3G34W(图2H)。最终诊断为成骨细胞瘤。

成骨细胞瘤曾被命名为骨母细胞瘤、侵袭性骨母细胞瘤,是一种在纤维血管基质中由瘤样成骨细胞组成的肿瘤。2020新版WHO骨肿瘤分类将成骨细胞瘤从良性病变归入中间型(局部侵袭性)骨源性肿瘤(ICD-O code:9200/1)。成骨细胞瘤常发生在脊柱和长骨内,发生在颌面部骨的成骨细胞瘤占10%~12%,下颌骨常见[3]。
本病例大体标本中肿瘤界限不清,富含血管,质地坚实有沙砾感,可有部分软化、出血、坏死或囊性变表现。镜下肿瘤内有大量相互交织的类骨质小梁或骨针,周围有一至数层浆细胞样或多边形成骨细胞围绕,肿瘤间质丰富,可见散在的破骨细胞样巨细胞,考虑成骨细胞瘤的可能性大。结合病史和影像学资料可排除成牙骨质细胞瘤(常与1颗或多颗牙齿的牙根相连、X线呈现“光环征”,镜下由牙骨质样组织组成,可见嗜碱性反转线)、骨样骨瘤(肿瘤一般小于2 cm,以骨样组织为主,有夜间痛)、动脉瘤性骨囊肿和巨细胞性肉芽肿(多有外伤史,颌骨的反应性改变)。考虑本病例肿瘤细胞分裂活性较高,需进一步排除恶性骨肿瘤的可能。恶性骨肿瘤的肿瘤细胞往往更大、核浆比例更高、异型性更明显,病理分裂象多见,必要时需结合免疫组化检测。
H3.3G34W(H3F3A突变)是骨巨细胞瘤的可靠诊断与鉴别诊断检测指标,少数年龄大的高级别骨肉瘤可出现该突变,可能是骨巨细胞瘤的恶性转化[4]。H3K36M(H3F3B突变)出现于96%软骨母细胞瘤,是诊断软骨母细胞瘤的特异性指标[5]。本例成骨细胞瘤中H3.3G34W不表达,提示排除骨巨细胞瘤;H3K36M呈弥漫性表达,结合肿瘤细胞形态,排除软骨母细胞瘤。SATB2是一种高度保守的核基因蛋白,主要负责调节成骨细胞分化,SATB2阴性有助于排除骨原发性纤维性肿瘤[6]。本病例中肿瘤细胞中SATB2呈阳性表达,提示肿瘤细胞可能为成骨细胞源性。
成骨细胞瘤的病因尚不明确[7]。结合患者的病史和临床病理特点,本研究提出了成骨细胞瘤进化发育假说。正常颌骨内的成骨细胞呈立方形,衬覆在骨小梁表面,可分泌骨基质(主要为Ⅰ型胶原、糖蛋白、蛋白多糖等有机物质)[8]。成骨细胞来源于骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMMSC),在成骨相关激素、细胞因子和其他诱导剂作用下,BMMSC可定向分化形成成骨细胞[9]。当炎症、创伤性牙科操作时,骨髓腔内应压力、炎症介质等可能改变局部微环境,激活BMMSC分化为成骨细胞,新形成的成骨细胞及活化的原有成骨细胞不断增殖分裂,并分泌幼稚的基质成分。随着环境应激的累积,成骨细胞可出现染色体结构和数目的改变,DNA中出现H3F3A突变以及SATB2表达上调,最终导致成骨细胞瘤的形成。另外,由于颌骨是高度可塑性组织,也是人体骨代谢最活跃的部分,血供单一、骨皮质厚,可能使局部组织细胞对微环境平衡失调的毒性作用更敏感。
综上,成骨细胞瘤的诊断及鉴别诊断应以临床、组织形态学为基础,结合免疫组织化学染色进行。同时应积极开展成骨细胞瘤的发生机制研究,为寻找新的特异性分子标志奠定基础,提高病理诊断准确率。
所有作者声明不存在利益冲突



























