
硬化萎缩性苔藓(lichen sclerosus et atrophicus,LSA)是一种原因不明的可能累及皮肤及黏膜的慢性疾病,好发于女性外阴部。本文报道1例罕见的仅累及口腔,同时还伴有唇部美观缺陷及牙周附着丧失的LSA病例,通过局部药物治疗并结合牙周手术治疗,缓解了患者的临床症状,随访2年病情稳定未复发。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
硬化萎缩性苔藓(lichen sclerosus et atrophicus,LSA)是一种少见的可能累及皮肤及黏膜的慢性疾病。临床表现主要为白色斑块状病损。最常累及女性外阴部,可能造成皮肤萎缩、瘢痕形成甚至排尿困难等功能障碍[1, 2]。LSA典型的病理改变是基底细胞的液化变性、真皮层浅层的玻璃样变、弹性纤维减少及玻璃样变下方出现炎症细胞浸润带[3]。仅累及口腔的LSA较罕见,本文报道1例仅累及口腔,同时还伴有唇部美观缺陷及牙周附着丧失的LSA,通过局部药物治疗并结合牙周手术治疗,患者临床症状缓解,随访2年病情稳定未复发,报道如下。
1.病例资料:
(1)临床资料:患者女性,24岁。因“上唇部紧绷感,唇缘不对称,同时伴有前牙区牙龈萎缩及刷牙不适多年”就诊于南方医科大学口腔医院特诊科。患者既往体健,否认系统性疾病史及药物过敏史,否认吸烟及咀嚼槟榔史。临床检查可见上唇唇红部边界清楚的白色条索状改变,上唇下缘形态不对称(图1A)。患者初诊时下唇红处还可见不规则糜烂及结痂面(图1A),结合病史诊断为复发性唇疱疹,未行用药,1周后自愈。口内检查可见唇红处白色病损向内延伸,累及上唇内侧黏膜、唇系带及11和12附着龈及前庭沟区(图1B)。白色病损边界清楚,触诊质地韧,黏膜弹性下降。11和12唇侧牙龈退缩,其中11唇侧牙龈退缩达根尖部,角化龈缺失,边缘软垢堆积明显,11唇腭侧近远中邻面及中央位点的探诊深度为2~3 mm,唇侧位点均探诊出血(+),余牙口腔卫生良好。12近中侧唇向扭转,11、12均无明显松动。前牙区覆 覆盖关系正常,无咬合创伤。根尖片可见11及12邻面骨吸收,11牙周膜间隙明显增宽,近中牙槽骨不规则吸收(图1C)。锥形束CT示11唇侧骨开裂(图1D)。
覆盖关系正常,无咬合创伤。根尖片可见11及12邻面骨吸收,11牙周膜间隙明显增宽,近中牙槽骨不规则吸收(图1C)。锥形束CT示11唇侧骨开裂(图1D)。


(2)病理学检查:经患者签署病理活检知情同意书,切取患者唇部病损行组织病理学检查,HE染色可见鳞状上皮不全角化,上皮萎缩,钉突消失(图2A);基底细胞液化变性,上皮下裂隙形成(图2A);固有层纤维组织束状融合,伴胶原变性及玻璃样变性(图2B);玻璃样变下方可见淋巴细胞浸润带(图2A);上皮未见异常增生。Verhoeff染色可见固有层弹性纤维的缺乏及断裂(图2C)。
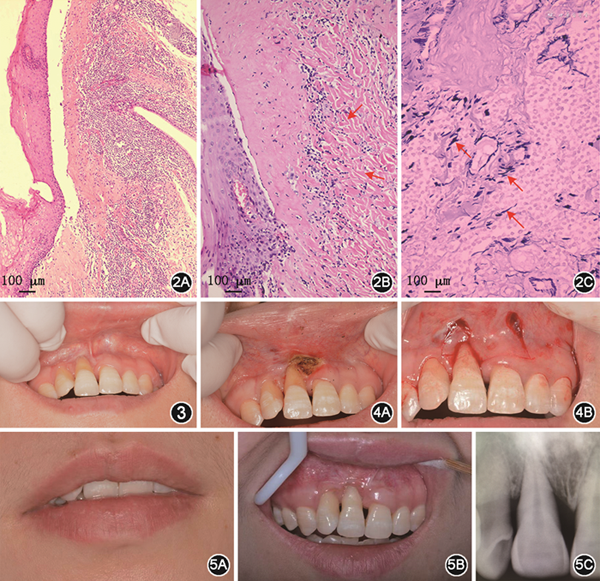

(3)诊断:结合临床及组织病理学改变,该病例诊断为LSA。
(4)治疗:嘱患者于皮肤科及泌尿外科进一步检查,排除皮肤及外阴病损。对患者局部黏膜白色病损区(包括唇红、上唇内侧黏膜、唇系带及11和12的附着龈及前庭沟区)使用0.1%曲氨奈德软膏(香港澳美制药厂)涂抹,3次/d,半个月后减量至2次/d,1个月后减量至1次/d至逐渐停药。同时对患者进行口腔卫生宣教。患者口腔黏膜白色病损用药后明显消退,停药后观察半年未见明显复发(图3)。患者唇部的紧绷感及11唇侧牙龈区牙龈退缩和刷牙不适无改善,故进一步对患者行系带修正术及11唇侧牙龈区牙龈的侧向转位瓣手术(图4)。术后患者唇部紧绷感消失,唇红部形态基本恢复正常,同时11的角化龈获得增量,前庭沟深度增加,患者刷牙不适及牙周卫生维护问题得以解决。
(5)随访:术后2年随访示患者黏膜病损未复发,唇红形态对称(图5A)。11角化龈增加约3 mm,前庭沟深度增加,患者口腔卫生良好(图5B)。11牙周附着丧失无加重且可见近中牙槽骨不规则吸收区有骨修复反应,根尖片示11牙周膜间隙恢复正常,牙槽嵴顶可见硬骨板形成(图5C)。
2.讨论:LSA主要好发于女性患者,成人及儿童均可累及,其发病原因不明[1, 2]。单发于口腔的LSA较罕见。LSA的口腔病损表现为白色斑块状,发作部位不定,可累及唇、颊、牙龈、系带、舌及腭部黏膜。患者可表现为无症状或出现病损区疼痛、烧灼及紧绷感[4]。口腔LSA的病理改变与皮肤LSA类似,表现为基底细胞液化变性,固有层浅层玻璃样变,弹性纤维减少以及玻璃样变下方的淋巴细胞浸润带[5]。一般依据其典型的临床表现及组织病理学特征可诊断该病。临床需与之鉴别的口腔黏膜白色病损包括硬皮病、口腔扁平苔藓、白癜风、口腔白斑、口腔黏膜下纤维化等,其中单发于口腔的硬皮病最易与LSA混淆,二者临床表现相似,主要通过病理学进行鉴别。硬皮病镜下可见大量胶原沉积,往往累及固有层深层,但不伴基底细胞液化变性,也无胶原下方淋巴细胞浸润带[6, 7]。在临床上也有二者共存的病例报道[8]。口腔扁平苔藓临床以白色网纹状病损多见,病理学上可见上皮钉突呈锯齿样改变,淋巴细胞紧邻上皮层下方,围绕钉突呈带状浸润,无上皮下玻璃样变。白癜风患者多伴有皮肤色素脱失斑,呈乳白色,病理表现主要为黑色素密度降低或无黑色素细胞。白斑患者多有吸烟史,病理上可伴不同程度的上皮异常增生。口腔黏膜下纤维化患者多有咀嚼槟榔史,病损多发,可见上皮异常增生,血管消失或狭窄[9, 10]。
虽然在病理表现上LSA仅累及软组织,但通过对本例及既往报道病例汇总分析可以发现:当口腔内LSA累及牙周某些特殊的软组织区域,如附着龈区、前庭沟区及系带区,多伴发相邻牙周硬组织的破坏[11, 12, 13]。在儿童发育期,累及上述牙周部位的口腔LSA可造成对应区域颌骨的发育障碍[14]。口腔LSA导致相应牙周硬组织破坏的原因可能与本病典型的病理特点有关。LSA主要导致黏膜固有层内胶原纤维的玻璃样变,同时弹力纤维明显减少,软组织的弹性大幅下降,不仅失去对牙周硬组织的保护作用,还可产生异常的牵拉力,导致相邻区域硬组织破坏。
目前LSA在治疗上缺乏循证医学依据,因此尚无统一的治疗方案。文献中对无症状患者可不予处理,定期观察随访。针对有症状的患者,口内黏膜病损的治疗方案包括局部和全身药物治疗及手术切除。局部使用的药物有糖皮质激素类药物、他克莫司等免疫抑制剂。口服药物包括糖皮质激素类药物、灰黄霉素、秋水仙碱、甲氨蝶呤等[4, 5]。上述治疗方法可使黏膜病损完全或部分消退。本病例采用曲氨奈德软膏局部药物治疗,黏膜病损基本消退且在2年随访期内无明显复发,但仍需长期观察随访。
既往国外文献中提及LSA的治疗方案均为针对原发黏膜病损的治疗,对累及牙周硬组织的病例回顾分析发现,牙周硬组织破坏并不随黏膜病损的消退而终止[11, 12, 13, 14]。Jiménez等[13]曾报道1例与本病例相似发病部位的口腔LSA,虽然黏膜病损通过治疗后消退,但患者右上中切牙在牙周基础治疗后终因持续加重的牙周附着丧失而拔除。因此,当LSA累及口腔附着龈区、前庭沟区及系带区时,除对原发黏膜病损进行控制外,还应考虑及时行牙周手术治疗,改善膜龈异常,恢复牙周软硬组织间的依存关系,以尽可能保护LSA累及的天然牙区域。
当口腔LSA累及唇红黏膜时,因其颜色改变,患者可出现美观方面的诉求。本例患者同时出现唇红部形状的改变,分析其原因可能是本病累及范围较广,从唇红部一直延续至唇内侧黏膜及唇系带,且患者唇系带附着位置近龈缘,由广泛的病损组织产生较大的牵拉力导致唇红部不对称。后期对本例患者行上唇系带修整术,使患者上唇紧绷感及唇缘不对称得以改善。
LSA是否具有癌变倾向目前仍存争议。单发于口腔的LSA病例较少且追踪时间较短,尚不能得出结论。有文献评估女性外阴部的LSA发生癌变的概率为0.3%~4.9%[2],提示对该类疾病治疗后仍需定期观察,密切随访。
所有作者声明不存在利益冲突



























