
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
抗合成酶综合征(anti-synthetase syndrome,ASS)是特发性炎性肌病(idiopathic inflammatory myopathy,IIM)的一种特殊类型,有特征性的血清抗合成酶抗体阳性,根据不同的抗合成酶抗体又分为不同的ASS的临床亚型,不同的临床亚型在临床特征、预后等方面都会有所不同;抗组氨酰转运RNA合成酶(anti-histidyl-tRNA synthetase,抗Jo-1)综合征是最常见的ASS亚型[1]。现报道1例复发性抗Jo-1综合征患者,以期提高对本类疾病的认识。
患者女,72岁,因"间断发热、咳嗽、咳痰2年,再发1周"于2016年1月24日入院。患者于2014年5月9日无明显诱因出现发热,最高体温37.9 ℃,伴咳嗽,咳少量白黏痰,无呼吸困难,当地医院给予头孢呋辛、莫西沙星治疗无效,体温升至38.3 ℃,并出现双腿乏力,上楼时需上肢协助支撑扶手。于当地医院住院查血常规大致正常,红细胞沉降率(ESR) 45 mm/1 h,肌酸激酶(CK)553 U/L,抗核抗体(ANA)谱:抗Jo-1抗体(+),ANA(-) ,胸部CT(2014年5月22日,图1,图2)可见双肺多发索条影,散在片状实变影,肌电图未见明显异常,考虑"间质性肺疾病合并感染",给予糖皮质激素(激素)治疗:甲泼尼龙40 mg,1次/12 h,静脉滴注,7 d后改为40 mg/d,静脉滴注,7 d后改为口服48 mg/d,联合多种抗生素治疗后临床症状逐渐缓解。出院后甲泼尼龙逐渐减量(每2周减4 mg)。2015年2月(口服甲泼尼龙2 mg/d)患者再次发热,最高体温37.9 ℃,伴咳嗽,咳白黏痰,活动后气短,复查胸部CT(2015年2月23日,图3,图4)可见双肺多发索条、斑片、磨玻璃影,再次住院,期间查肌炎抗体谱:抗Jo-1抗体:96 RU/ml(正常值<15 RU/ml);四肢肌肉核磁共振示"双下肢肌肉萎缩"(具体不详);支气管镜下右下叶后基底段肺活检示"肺泡间隔略增宽,可见不典型机化灶",右上臂肌活检病理示"符合炎性肌病表现"。考虑ASS,再次给予治疗(甲泼尼龙静脉滴注,40 mg,1次/12 h,3 d后改为40 mg, 1次/d)后症状逐渐减轻出院(口服甲泼尼龙40 mg/d)。出院后2周患者因顾虑激素的不良反应,自行调整为甲泼尼松20 mg,1次/d,并逐渐减量,至2015年8月口服甲泼尼龙2 mg/d并长期维持。2016年1月16日患者无明显诱因再次出现发热(体温最高38.3 ℃),伴咳嗽,咳少量白色黏痰,口服头孢克洛250 mg,2次/d,后体温升至39.9 ℃,并逐渐出现活动后气短,胸部CT(2016年1月23日,图5,图6)可见双肺病变明显加重,双肺(双下肺、左舌叶及右中叶明显)大片渗出影,部分为实变,为进一步诊治收入住院。追问病史发现患者2010年无明显诱因出现左侧肘部、右手拇指、示指桡侧皮肤粗糙。起病以来无雷诺现象或光过敏,无口眼干及关节肿痛。既往史:2014年应用激素期间曾有血糖升高,诊断为"类固醇性糖尿病",间断胰岛素对症应用。其余个人史、婚育史和家族史无异常。入院体检:血压132/72 mmHg(1 mmHg=0.133 kPa),脉搏72次/min,肢端氧饱和度91%,技工手、Gottron征阳性,双下肺可闻及爆裂音,心脏及腹部未发现阳性体征,上肢肌力正常,双下肢近端肌力Ⅴ-级,无压痛,双下肢不肿。
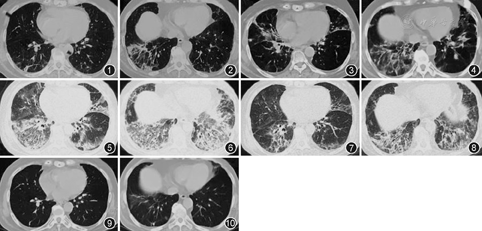

入院后完善系列辅助检查:血常规、尿常规、肝肾功能及电解质、血清免疫球蛋白及补体水平大致正常。动脉血气分析(不吸氧,静息):pH值为7.42、PaCO2为37.2 mmHg,PaO2为61.5 mmHg,HCO3-为24.4 mmol/L。血清CK为2 325 U/L,CK-MB为24.8 μg/L,血清肌钙蛋白I(cTnI)正常;ESR:34 mm/1 h,超敏C反应蛋白为22.67 mg/L;ANA18项:Ro 52强阳性(+++),Jo-1强阳性(+++),抗中性粒细胞胞质抗体、血清1,3-β-D-葡聚糖(G试验)及半乳甘露聚糖(GM试验)均阴性;痰送检多种病原学(包括细菌、真菌及MTB)均为阴性,心脏彩色多普勒超声提示左心室松弛功能减低,左心室射血分数69%,其余未见异常。结合病史及上述辅助检查结果,考虑抗Jo-1综合征、低氧血症,给予甲泼尼龙(40 mg,1次/12 h,静脉滴注14 d)、丙种球蛋白(10 g/d,5 d)、依诺肝素钠(6 000 U/d,皮内注射),第3天患者体温恢复正常,1周后咳嗽、活动后气短等临床症状逐渐改善,复查胸部CT(图7,8)。遂于2016年2月8日起调整方案为激素(口服泼尼松50 mg/d)联合免疫抑制剂(口服吗替麦考酚酯分散片0.5 g,2次/d)并出院门诊随诊。出院后2周起,泼尼松逐渐减量,至2016年6月5日为泼尼松15 mg/d,胸部CT可见肺内病变较前明显吸收(图9,10);建议维持目前剂量泼尼松3~5个月后逐渐减量,吗替麦考酚酯分散片维持剂量口服。随访至2017年1月(泼尼松减量至5 mg/d),患者病情平稳,日常活动无明显不适,复查胸部CT较前变化不大,继续门诊随访。
2003年Dalakas和Hohlfeld[2]提出IIM的不同临床亚型时已提及ASS,但2010年才由Connors等[3]正式制定ASS的诊断标准:血清抗合成酶抗体阳性,并至少具有以下一项临床表现:雷诺现象、关节炎、间质性肺疾病(interstitial lung disease, ILD)、发热(未找到其他导致发热的病因)及技工手(手皮肤增厚、皲裂,尤其是手指尖的皮肤)。之后人们才逐渐认识ASS[1,4,5,6,7,8],本病女性多见,上述临床表现中以ILD最常见,ASS患者的ILD发生率可达67%~100%,明显高于其他IIM亚型(ILD发生率为23%~65%)[9]。患者可没有明显的肌痛、肌无力、向阳征等皮肌炎/多肌炎的常见临床表现。本例患者病程中存在发热和明显的多肌炎的临床和实验室表现,在起病初期存在肌无力表现,每次急性加重阶段均伴有血清肌酶升高,第2次复发阶段四肢肌肉核磁共振和肌活检病理均符合炎性肌病表现,本次入院后体检发现有明确的"技工手"。
根据不同的抗合成酶抗体类型分为不同的ASS亚型,共有20种合成酶,现已发现10种抗合成酶抗体,临床中以抗Jo-1最多见(约占ASS的68%~87%),是1980年首次发现并命名的,见于15%~25%的多发性肌炎患者;而非抗Jo-1的抗合成酶抗体率仅为3%[1,10]。不同亚型的ASS临床表现有所不同,抗Jo-1-ASS在临床上常有IIM的相关表现、血清CK升高等而被拟诊为多肌炎或皮肌炎,但非抗Jo-1-ASS在临床上肌炎相关表现并不明显,可以仅表现为ILD[1];以至于有报道认为,非抗Jo-1-ASS的ILD发生率高于抗Jo-1-ASS[11]。
Marie等[11]、Stanciu等[12]和Zamora等[13]的报道显示,抗Jo-1-ASS的胸部CT表型以非特异性间质性肺炎(nonspecific interstitial pneumonia,NSIP)型为主,其次为机化性肺炎(organizing pneumonia,OP)型或NSIP合并OP型,少部分表现为(usual interstitial pneumonia,UIP)型。鉴于对于已临床诊断ASS的患者常规不推荐肺活检,尤其是外科肺活检。关于Jo-1-ASS的肺病理的文献并不多,Marie等[11]的报道中以NSIP型最多见,其次是OP、UIP型;Zamora等[13]的病例中则以OP最多见,其次为NSIP;少部分表现为UIP型和弥漫性肺损伤(diffuse alveolar damage, DAD)。但Yousem等[14]的报道中则提示,以UIP型最多见,其次是急性或机化性DAD型、纤维化性间质性肺炎基础上的急性加重,少部分表现为NSIP型,但其研究对象中除了常规的抗Jo-1-ASS患者外,还有一部分是尸检标本、抗Jo-1-ASS受者接受肺移植术后的移除肺。本例患者的多次急性加重阶段的胸部CT表现以NSIP并OP型为主。鉴于患者在本次入院后结合临床表现、血清学表现确诊为抗Jo-1综合征而未安排肺活检;不过她在第二次急性加重阶段的经支气管镜肺活检提示肺内有"不典型机化灶"。
激素是治疗抗Jo-1-ASS基础用药[1,10],Stanciu等[15]建议,为减少激素减量后复发率,建议对于有ILD的抗Jo-1-ASS患者联合免疫抑制剂治疗。本例患者本次住院时肺内病变弥漫,存在严重低氧血症,故静脉滴注大剂量激素联合丙种球蛋白,鉴于患者有明确的ILD,且已有两次激素减量后病情反复,此次在病情趋于平稳后及时联合吗替麦考酚酯治疗。随访至今,患者已病情平稳1年余。
抗Jo-1-ASS是最常见的ASS亚型,女性多见,常有发热、肌炎、"技工手"等IIM的临床表现;抗Jo-1-ASS中ILD常见,胸部CT表型及肺脏病理表型以NSIP、NSIP并OP或OP型多见,UIP型少见。治疗上,对于合并ILD的抗Jo-1-ASS患者建议激素联合免疫抑制剂治疗,以减少激素减量后的病情反复。


























