
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,49岁,因"眼干口干2年,干咳6个月,CT检查发现多发囊腔样改变"于2015年11月12日入院。患者半年前无明显诱因出现干咳,无昼夜节律及季节性,非花粉、油烟及食物等诱发,自诉活动后咳嗽加剧,伴活动后喘息,上述症状进行性加重。发病来患者无晨僵、关节痛、肌肉疼痛无力、皮疹及雷诺现象等症状。体检:消瘦状态,双下肺闻及细小爆裂音,四肢关节无畸形,未见杵状指,入院影像学检查CT表现双肺弥漫磨玻璃高密度影并多发囊腔样改变,纵隔淋巴结增大(图1、图2、图3、图4、图5、图6),入院诊断:间质性肺疾病性质待定。
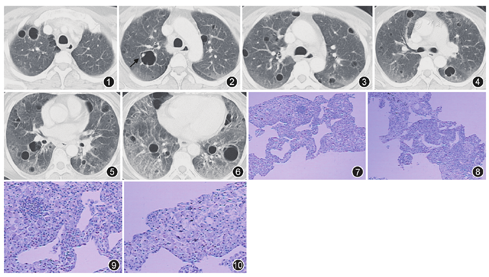

实验室检查:总蛋白为87.5 g/L,白蛋白为25.6 g/L,球蛋白为61.9 g/L,肌红蛋白为638.6 μg/L。ESR 81 mm/1 h。免疫球蛋白G 47.5 g/L,免疫球蛋白A 5.42 g/L,补体C3为0.67 g/L,HIV抗体阴性,类风湿因子(Rh)为1 950 IU/ml。抗中性粒细胞胞质抗体阴性(-),抗髓过氧化物酶抗体阴性(-),抗核抗体谱检测提示抗蛋白酶3抗体阴性(-)。ENA抗SSA抗体(+++),抗SSB抗体(+++),抗核抗体可疑阳性,S 1∶1 000浆细胞颗粒为1∶320,抗双链DNA阴性。双眼Schimer试验:左侧8 mm,右侧6 mm;泪膜破碎时间:左侧6 s,右侧4 s。行右肺下叶经皮肺穿刺,组织病理活检结果显示,肺组织间质大量浆样细胞及少量淋巴细胞浸润,其中部分胞质内可见多量嗜伊红的Russell小体(图7、图8、图9、图10)。BALF行抗酸、吉姆萨等染色,未查到MTB及肺孢子菌等病原菌。
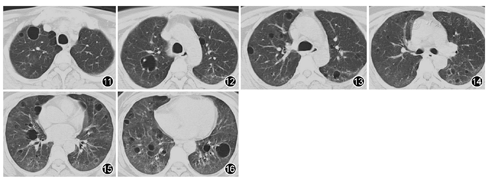
患者为中年女性,工作环境潮湿可能存在霉变,影像学表现可见双肺弥漫多发囊腔影并磨玻璃密度改变,纵隔淋巴结增大,实验室检查发现ESR明显增快,球蛋白增加,白蛋白降低;类风湿因子明显增高,依据其临床症状、体检、实验室检查及肺组织活检病理,经呼吸科与风湿病科会诊讨论考虑为原发性干燥综合征(primary Sjögren′s syndrome, pSS)。于2015年11月19日给予甲泼尼龙琥珀酸钠40 mg,1次/d,静脉滴注22 d后改为口服泼尼松片45 mg,1次/d;并于2015年11月21日联用环磷酰胺200 mg,1次/2 d,静脉滴注,口服来氟米特片10 mg、硫酸羟氯喹片200 mg及白芍总苷胶囊600 mg,2次/d,患者病情控制良好,于2015年12月15日出院,出院时咳喘症状明显减轻,复查胸部CT可见双肺弥漫磨玻璃影明显变淡,空腔似有缩小(图11、图12、图13、图14、图15、图16),总体变化不大。

干燥综合征(Sjögren′s syndrome, SS)是一种多系统的慢性自身免疫性炎症性疾病,特征为外分泌腺高度淋巴细胞浸润致其功能发生障碍。可独立发生(原发性SS)或与其他风湿病症并存(继发性SS),后者可见于类风湿性关节炎、系统性红斑狼疮和系统性硬化症等自身免疫性疾病[1]。本例患者从干咳这一主要症状和CT上的多发囊腔及磨玻璃改变分析,考虑可能的诊断如下:(1)伊氏肺孢子菌肺炎:本病典型影像学改变为双肺弥漫磨玻璃样改变,但1/3的患者可以出现单发或多发薄壁的囊状影[2],本例患者病程迁延,整个病程无感染中毒和慢性消耗症状,HIV抗体阴性,无应用细胞毒药物和免疫抑制剂等病史,支气管肺泡灌洗液未查到伊氏肺孢子菌,通过相关生物化学检查排除诊断。(2)慢性外源性过敏性肺泡炎:患者系宾馆服务员,打扫卫生等工作环境潮湿,推测其存在长期接触具有抗原性的有机气雾颗粒史,故入院时曾怀疑本病,但本病的主要影像改变多为密度稍高的磨玻璃样阴影和弥漫分布的小叶中心性结节影,晚期方见蜂窝肺、肺气肿、支气管扩张等改变。病理见肉芽肿、细支气管炎和淋巴细胞性间质性肺炎等。本例随着后续的检测结果排除诊断。(3)肺朗格汉斯细胞组织细胞增多症(pulmonary langerhans cell hisiocytosis, PLCH):文献男女发病大致相同,但临床男性吸烟者似乎更多见,主要流行病学因素是吸烟,多有反复多次气胸病史。其特征性的结节状和囊状改变多主要分布在中上肺野。一般情况囊状改变要较本例所示更多更弥漫。病理特征为沿着小气道周围分布的朗格汉斯细胞增殖聚集。此患者从病史、发病、影像、病理及实验室检查结果排除此病。(4)淋巴管平滑肌瘤病(lymphangioleiomyomatosis, LAM):本病主要发生于育龄期(平均诊断年龄40岁),女性多见,本例患者属于LAM高危人群[3]。LAM影像以慢性进展的双肺弥漫性囊性病变为特征,囊性病变分布于全肺,典型改变双侧肺部均被弥漫相连的薄壁囊性结构替代,病程中可出现反复发生的气胸和乳糜胸,也可有淋巴结肿大和心包积液,病理显示异常增生的梭状平滑肌样细胞和血管周上皮样肿瘤细胞即LAM细胞。本例患者影像多发囊腔样改变似乎不够密集,病理检查未见LAM的特征性病变,故排除诊断。(5)pSS相关性间质性肺疾病:结缔组织疾病(connective tissue diseases, CTD)是一组临床上越来越常见的自身免疫性疾病。因肺脏和胸膜含有丰富的胶原、血管等结缔组织,且有调节免疫、代谢和内分泌等非呼吸功能,故CTD多损伤肺、胸膜,累及呼吸肌群、胸膜、传导气道、小气道、肺实质、肺间质和肺血管等,诱发结缔组织病相关的疾病表现,其病理改变多表现为间质炎症、肺泡间隔炎症、血管炎、肺泡渗出、肉芽肿形成和胸膜渗出等。本例患者为中年女性,从其起病、症状体征及影像学分析,类风湿因子高达1 950 IU/ml (<20 IU/ml),高度怀疑为类风湿性关节炎继发的干燥综合征,但文献报告pSS患者70%~80%的患者类风湿因子阳性,且常伴有多克隆高球蛋白血症(约见于90%的患者)[4]。本例患者类风湿因子高,但无晨僵、关节痛及畸形等症状,存在口腔干燥、干燥性角结膜炎、双下肺闻及细小爆裂音等表现,多克隆免疫球蛋白增高及肺组织活检病理见大量浆细胞和免疫球蛋白浸润等,因此最终确诊为原发性干燥综合征合并间质性肺炎。
肺部间质性病变表现是SS导致的外分泌腺受累之外的并发症之一,发生率为9%~90%[5,6,7],CT尤其是HRCT可见磨玻璃影、界限不清的小叶中心性结节、薄壁囊腔、网格影甚至蜂窝样改变以及纵隔淋巴结肿大等影像改变[8]。组织病理学表现为非特异性间质性肺炎(NSIP)、寻常性间质性肺炎(UIP)及机化性肺炎(OP)、淋巴细胞性间质性肺炎(LIP) 、淀粉样变性等病理类型[9]。Reina等[9]报道了一组干燥综合征相关性间质性肺疾病的研究结果,共纳入25例进行病理组织检查的患者,最终病理类型为NSIP 12例,UIP 5例,OP 4例,LIP 2例。需要注意的是LIP是SS的特征性肺组织学改变,以LIP/滤泡性细支气管炎为病理表现的肺部间质改变在CT上可表现为界限不清的小叶中心性结节和(或)磨玻璃密度衰减影以及多发薄壁囊腔样等改变[10]。
目前为止仅有几篇文献评估了SS患者胸部影像学上的囊腔影的特性及其价值[1,5,6,11]。SS相关的肺部囊腔样改变在HRCT上显示的最具特征性[12]。典型的囊腔样改变包括囊腔形态变化大,囊腔内部结构简单,形成溶解的肺,常常在囊腔边缘附有血管,多分位于双下叶基底或弥漫性分布,常常伴有磨玻璃影像改变和结节影[5],如本例患者所示,当属以浆细胞淋巴细胞性间质性肺炎为病理基础、弥漫多发囊腔样改变为影像学特征的原发性干燥综合征。
高分辨率CT发现弥漫性囊腔样影像改变在临床相对罕见,且多种疾病可引起此影像学改变[3],面对原因不明的弥漫性囊腔样肺部阴影,在鉴别诊断时应该同时考虑到SS的可能。囊腔的内部结构、囊壁上的偏心血管影、肺实质的特征性如磨玻璃样影像改变等均是指向SS的线索。Gupta等[4]认为通过影像学弥漫多发囊腔样改变结合临床表现等综合分析,在缺乏血清学抗体或者唇腺活检证实的前提下也足以诊断SS相关肺疾病,从而可以避免肺组织活检,提出可通过临床观察和自身抗体检测阳性确诊pSS并发ILD。对于胸部CT等影像学表现为多发薄壁囊腔样改变的患者,需重视干燥综合征的诊断,避免漏诊。


























