
马尔尼菲青霉病及诺卡菌病发病率低,病死率较高,临床表现无特异性,目前暂未见两者合并感染的病例报道,现报道1例马尔尼菲青霉并皮疽诺卡菌肺部感染伴血行感染病例,分析两者感染的临床特点,为其诊断及治疗提供帮助。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
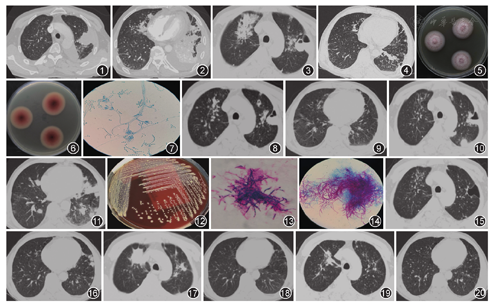
患者男,52岁,因"反复发热、咳嗽、咳痰、胸痛2个月余"于2017年2月14日入住我院呼吸科。患者入院前2个月受凉后出现低热,体温38 ℃左右,咳嗽,咳少量白色黏痰,咳嗽时左侧胸痛,胸部CT检查提示左肺有斑片状阴影及左侧胸腔少量积液。在外院抗感染治疗4 d,左侧胸痛加剧,伴气促胸闷。12月15日我院急诊胸部CT检查示双肺散在斑片状高密度影,左侧包裹性胸腔积液,左下肺膨胀不全(图1,图2),给予莫西沙星0.4 g 1次/d,4 d后胸痛缓解,但仍咳嗽、咳黄痰,于12月23日转入呼吸科。12月24日胸部CT检查示双肺病灶较前增加(图3,图4),12月25日晨出现高热,体温高达39.3 ℃,痰培养结果示马尔尼菲青霉阳性(图5,图6,图7),血培养阴性,给予头孢哌酮/舒巴坦联合伏立康唑抗感染,1 d后体温恢复正常。12月29日复查胸部CT示双肺病灶较前缩小(图8,图9),于2017年1月4日出院,出院后继续口服伏立康唑。1月7日再次出现高热,体温达39 ℃,咳嗽、咳少量黑痰,左侧胸痛及左肩背部疼痛,先后给予头孢哌酮/舒巴坦、莫西沙星联合伏立康唑治疗后,仍有间歇发热,多为中低度发热,偶有高热,稍有胸痛,伴头痛、头晕及乏力,于2017年2月14日第2次入住呼吸科。患者既往有慢性乙型病毒性肝炎、乙型病毒性肝炎相关性肾炎,糖尿病病史1年余,服用泼尼松片和恩替卡韦1年。入院体检:体温39.5 ℃,脉搏120次/min,呼吸26次/min,血压120/80 mmHg(1mmHg=0.133 kPa),意识清,颈软,双肺呼吸音粗,可闻及少量湿性啰音,未闻及胸膜摩擦音。心腹查体未见异常。双下肢轻度水肿。血常规示白细胞计数为12.1×109/L,中性粒细胞占0.96,血红蛋白为119 g/L,血小板为285×109/L。ESR为79 mm/1 h,降钙素原为16 μg/L,C反应蛋白为354 mg/L。血白蛋白为23.6 g/L。糖化血红蛋白为7.6%,乙型病毒性肝炎三对指标HBsAg、HBeAb和HBcAb均阳性,乙型病毒性肝炎DNA定量为126 IU/ml。肾病指标:尿蛋白定性(++),尿蛋白定量为2.3 g/24 h。2017年2月16日胸部CT示右上肺病灶较前缩小,双肺新发多个结节灶(图10,图11)。经基质辅助激光解吸/电离飞行时间质谱(MALDI-TOF-MS)方法鉴定为皮疽诺卡菌,血培养为皮疽诺卡菌(图12,图13,图14)。头颅核磁共振平扫示脑内多发腔隙性梗死灶,轻度脑白质疏松症。支气管镜检查:支气管化脓性炎症,左上叶尖后段、下舌段、下叶基底段支气管黏膜充血水肿,管腔可见脓性分泌物。入院后给予美罗培南(1 g,1次/8 h,静脉滴注)、多西环素(0.1 g,1次/12 h,静脉滴注)、伏立康唑(0.2 g,1次/12 h,静脉滴注),治疗9 d后,患者仍有中低度发热。2017年2月22日血培养结果示皮疽诺卡菌阳性,改用美罗培南、伏立康唑联合磺胺甲 唑/甲氧苄啶0.96 g,3次/d,口服,10 d后患者体温恢复正常,咳嗽、咳痰、胸痛缓解,好转出院,出院诊断为马尔尼菲青霉并皮疽诺卡菌肺部感染伴血行感染。出院后继续口服伏立康唑联合磺胺甲
唑/甲氧苄啶0.96 g,3次/d,口服,10 d后患者体温恢复正常,咳嗽、咳痰、胸痛缓解,好转出院,出院诊断为马尔尼菲青霉并皮疽诺卡菌肺部感染伴血行感染。出院后继续口服伏立康唑联合磺胺甲 唑/甲氧苄啶治疗。2017年3月23日复查胸部CT示双肺病变吸收(图15,图16),停用伏立康唑。2017年6月7日复查胸部CT示双上肺病变进展(图17,图18),考虑可能为马尔尼菲青霉感染复发,停用磺胺甲
唑/甲氧苄啶治疗。2017年3月23日复查胸部CT示双肺病变吸收(图15,图16),停用伏立康唑。2017年6月7日复查胸部CT示双上肺病变进展(图17,图18),考虑可能为马尔尼菲青霉感染复发,停用磺胺甲 唑/甲氧苄啶,改为口服伏立康唑治疗,患者因经济原因只服用伏立康唑10 d。2017年8月20日复查胸部CT示双肺病变较前吸收(图19,图20),但双肺仍有病灶,患者继续口服伏立康唑10 d。2017年10月30日复查胸部CT示双肺多形态病变基本同前,2018年3月6日复查胸部CT示双肺病变基本同前。
唑/甲氧苄啶,改为口服伏立康唑治疗,患者因经济原因只服用伏立康唑10 d。2017年8月20日复查胸部CT示双肺病变较前吸收(图19,图20),但双肺仍有病灶,患者继续口服伏立康唑10 d。2017年10月30日复查胸部CT示双肺多形态病变基本同前,2018年3月6日复查胸部CT示双肺病变基本同前。

马尔尼菲青霉病(penicilliosis marneffei,PSM)是一种地方性疾病,多发于东南亚和中国南部等气候温热潮湿地区,免疫力低下人群易感,主要见于人免疫缺陷病毒感染患者,目前非人免疫缺陷病毒感染患者的PSM逐渐增加,且病死率高,Chan等[1]发现非人免疫缺陷病毒感染的PSM患者的病死率为27.7%(33/119)。马尔尼菲青霉(penicillium marneffei,PM)是青霉属中唯一的温度敏感的双相型真菌,在人体和37 ℃富营养的培养基上呈酵母相,而在室温下或在肺空洞内生长者则呈霉菌相,其主要宿主为竹鼠,在人免疫功能低下时,密切接触竹鼠可能通过呼吸道、消化道或皮肤伤口进入体内,致人类感染。PSM临床表现为发热、皮疹、皮下组织和深部软组织脓肿,肝脾及淋巴结肿大,可累及多个器官,如皮肤、骨髓、肺及肝脏等。
诺卡菌是条件性致病菌,与PM类似,多见于免疫功能低下者,也可见于免疫功能正常人群[2,3,4]。诺卡菌广泛存在于空气、土壤和水生环境中,是一种革兰染色阳性及抗酸染色弱阳性的需氧杆菌。目前国内外诺卡菌病的报道主要为个案或少量病例分析。目前报道的诺卡菌中约25种可能引起人类感染,以巴西诺卡菌及星形诺卡菌多见。诺卡菌可经呼吸道、消化道和皮肤进入人体,呼吸道是主要侵入途径,肺部是主要感染部位[5],肺外诺卡菌病通过血液传播或坏死性肺炎播散到胸膜、心包、纵隔和腔静脉引起感染,肺外感染的常见部位为颅内,脓肿形成是诺卡菌病的特征。根据诺卡菌属临床分离株的药敏试验分型,皮疽诺卡菌为药敏分型Ⅴ型,对环丙沙星、利奈唑胺和亚胺培南敏感,对氨苄西林、广谱的头孢菌素、克拉霉素和除阿米卡星外的所有氨基糖苷类药物耐药[6]。
PSM和诺卡菌病胸部影像学表现多样化,均可表现为肺段或肺叶浸润性病变,结节或粟粒状阴影,可出现空洞、胸膜改变、胸腔积液等[5,7,8,9]。两种病原体感染的临床表现及肺部影像学均缺乏特异性,诊断主要依靠病原学证据,而诺卡菌培养时间长、鉴定较困难。PSM的临床表现、病理组织学表现与结核相似,人免疫缺陷病毒阴性患者常误诊为结核病,当抗结核治疗无效时,应考虑PSM[10]。肺诺卡菌病进展迅速,可出现空洞,尤其是发生在免疫抑制者的感染,需与诺卡菌感染鉴别[11]。
体外药敏试验结果证明PM对多种抗真菌药物敏感,非人免疫缺陷病毒感染者目前首选方案为两性霉素B 0.6~1.0 mg·kg-1·d-1治疗2周,病情稳定后改用伊曲康唑400 mg/d,维持治疗10周,长期维持伊曲康唑治疗可减少复发风险。对于不能耐受两性霉素B的患者可选用伏立康唑,伏立康唑治疗PSM有效且耐受性良好[12],但治疗时间目前无统一标准,氟康唑治疗效果欠佳[13]。诺卡菌感染治疗首选磺胺类药物,诺卡菌大多数对磺胺类药物敏感,但耐药株逐渐增加,其他对诺卡菌敏感的抗菌药物包括阿米卡星、亚胺培南、美罗培南、头孢曲松、头孢噻肟、米诺环素、莫西沙星、左氧氟沙星、利奈唑胺、替加环素和阿莫西林/克拉维酸钾,其中利奈唑胺几乎对所有已知的致病诺卡菌有抗菌活性[14]。诺卡菌病治疗的疗程长,治疗时间主要与病情的严重程度、临床表现和免疫状态相关,治疗时间一般为6~12个月[15]。
本例为中年男性,有乙型病毒性肝炎相关性肾炎及糖尿病,长期服用糖皮质激素,属于两种病原菌的易感人群。其临床表现无特异性,第一次住院痰培养为PM,因为肾病不能耐受两性霉素B,选用伏立康唑抗真菌治疗,但出院后病情进展,使用多种广谱抗生素治疗病情无缓解,待血培养结果示皮疽诺卡菌阳性后,改用磺胺甲 唑/甲氧苄啶,患者症状缓解,提示美罗培南抗皮疽诺卡菌效果欠佳,磺胺甲
唑/甲氧苄啶,患者症状缓解,提示美罗培南抗皮疽诺卡菌效果欠佳,磺胺甲 唑/甲氧苄啶应为首选。该患者除肺部外未发现其他感染灶,使用磺胺甲
唑/甲氧苄啶应为首选。该患者除肺部外未发现其他感染灶,使用磺胺甲 唑/甲氧苄啶后肺部病变较前吸收,且诺卡菌最常见的感染部位为肺部,支持PM并皮疽诺卡菌肺部感染伴血行感染诊断。患者2次送检痰培养及30余次血培养,在培养结果回报前经验性治疗效果差,提示病原学证据对治疗至关重要。
唑/甲氧苄啶后肺部病变较前吸收,且诺卡菌最常见的感染部位为肺部,支持PM并皮疽诺卡菌肺部感染伴血行感染诊断。患者2次送检痰培养及30余次血培养,在培养结果回报前经验性治疗效果差,提示病原学证据对治疗至关重要。
文献报道磺胺甲 唑/甲氧苄啶在体外试验时可提高两性霉素B和伏立康唑对抗球孢子菌的抗菌活性[16],但未见磺胺甲
唑/甲氧苄啶在体外试验时可提高两性霉素B和伏立康唑对抗球孢子菌的抗菌活性[16],但未见磺胺甲 唑/甲氧苄啶可加强伏立康唑抗PM活性的报道。本例使用伏立康唑治疗3个月、磺胺甲
唑/甲氧苄啶可加强伏立康唑抗PM活性的报道。本例使用伏立康唑治疗3个月、磺胺甲 唑/甲氧苄啶治疗1个月肺部病灶明显缩小,停用伏立康唑。磺胺甲
唑/甲氧苄啶治疗1个月肺部病灶明显缩小,停用伏立康唑。磺胺甲 唑/甲氧苄啶治疗3个半月后复查肺部病灶增加,停用磺胺甲
唑/甲氧苄啶治疗3个半月后复查肺部病灶增加,停用磺胺甲 唑/甲氧苄啶,改用伏立康唑治疗10 d,因费用问题停止治疗。2个月复查胸部CT示肺部病灶较前缩小,需考虑PM感染复发的可能,同时也提示抗感染时间长是减少复发的关键。
唑/甲氧苄啶,改用伏立康唑治疗10 d,因费用问题停止治疗。2个月复查胸部CT示肺部病灶较前缩小,需考虑PM感染复发的可能,同时也提示抗感染时间长是减少复发的关键。
所有作者均声明不存在利益冲突



























