
患者男,34岁,因"体检发现肺部阴影5 d"于2017年7月8日入院,经验抗感染治疗失败后,经肺组织穿刺病理诊断为隐球菌肺炎,先后规范应用氟康唑、两性霉素B,病灶仍进展,二次肺组织穿刺除外合并症,并行微生物培养及药敏试验,后根据药敏结果调整治疗方案使病情得以控制和好转。本患者的诊治过程提醒我们,隐球菌抗原检测提高了隐球菌感染的早期识别,药敏试验是靶向治疗的关键。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,34岁,因"体检发现肺部阴影5 d"于2017年7月8日入我院。患者于2017年7月3日体检发现肺部阴影,胸部CT示右肺下叶结节状、斑片状阴影及磨玻璃密度影(图1),结核菌素试验(PPD试验)强阳性。患者无咳嗽、胸闷,无发热、盗汗,无胸痛、消瘦等症状。既往体健,职业为出租车司机,否认家族传染病及遗传病史。体检:体温36.3 ℃,脉率88次/min,呼吸频率21次/min,血压142/89 mmHg(1 mmHg=0.133 kPa),意识清楚,精神可,双肺呼吸音粗,右肺下叶可闻及湿啰音,心率90次/min,律齐,无杂音,腹软,无压痛及反跳痛,双下肢无水肿。
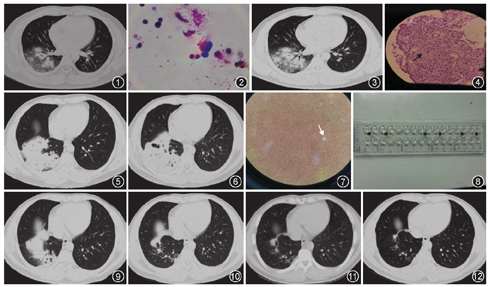

实验室检查:血常规、降钙素原、1,3-β-D葡聚糖检测(G试验)、半乳糖甘露醇聚糖抗原检测(GM试验)、抗核抗体谱、类风湿三项、抗中性粒细胞胞质抗体(ANCA)、癌胚抗原(CEA)、非小细胞癌胚抗原(CA211)、神经元特异度烯醇化酶(NSE)均正常,尿肺炎链球菌抗原、军团菌抗原、结核感染T细胞斑点试验(T-SPOT)、人免疫缺陷病毒(HIV)抗体均阴性。ESR为21 mm/1 h,空腹血糖为8.0 mmol/L,葡萄糖耐量试验及C肽释放试验示2型糖尿病。支气管镜检查(2017年7月10日):脱落细胞学、抗酸杆菌、真菌涂片、致病菌培养等检查均阴性。右下叶基底段支气管行TBLB,病理结果示(右肺下叶)少许肺组织淋巴细胞浸润。灌洗液细胞学检查:中性粒细胞占15.4%,嗜酸粒细胞占8.6%、淋巴细胞占47.2%(图2)。
初步诊断:社区获得性肺炎(CAP)?2型糖尿病。入院后给予头孢呋辛抗感染治疗10 d,于2017年7月18日复查胸部CT(图3)示右肺下叶病灶进展,部分结节融合,磨玻璃影范围增大。治疗过程中,患者出现咳嗽症状,初始治疗失败。
田高清(呼吸与危重症医学科):(1)青年男性,既往体健,体检发现肺部阴影,无不适症状;(2)入院后发现糖尿病;(3)体检右下肺闻及湿性啰音;(4)PPD试验强阳性;灌洗液细胞学检查:淋巴细胞占47.2%;(5)抗感染治疗病灶进展。患者社区发病,右下肺闻及湿性啰音,胸部CT示斑片状浸润影,符合CAP诊断标准[1],抗感染治疗10 d,出现咳嗽症状,胸部CT肺部病灶进展,属于无反应肺炎。初始治疗失败的原因分析如下:(1)CAP经验性抗感染治疗未覆盖致病微生物;(2)病原体耐药的可能;(3)糖尿病合并症影响了肺部病灶的吸收;(4)诊断错误,存在肺结核、肺部真菌感染、非感染性疾病的可能。
孙民峰(放射科):患者胸部CT初始表现为右肺下叶近胸膜处多发结节,周围可见渗出,表现为"晕圈征",可见于肺炎、结核球、肺癌、隐源性机化性肺炎等疾病,经抗感染治疗后,肺部病灶进展,部分结节相互融合。主要与以下疾病相鉴别:(1)肺炎型肺癌:可呈肺炎影像,本患者短期内变化太快,可能性小;(2)肺结核:病灶好发于双肺上叶尖后段或下叶背段;形态学多样,可表现为实变、空洞、结节。结节样病变多沿气道播散,周围可见树芽征、卫星灶及支气管壁增厚。本例患者以结节晕征为主,无卫星灶,且病灶短期进展,不符合肺结核的病变特征;(3)肺隐球菌病(PC):临床症状无特异度,影像学表现多样,可表现孤立或多个结节、下肺多见,双肺分布粟粒样阴影及片状渗出阴影,非免疫缺陷PC患者可出现临床症状的缺失[2],不能除外;(4)隐源性机化性肺炎(COP):多表现为磨玻璃影及肺泡性浸润影,在病程中,病灶多累及多叶段,常有明显的移动及游走性,好发于胸膜下及肺叶外带。本例患者病灶相对局限,不符合COP的典型表现。建议进一步行肺穿刺活检,协助诊断。
张勇(呼吸与危重症医学科):(1)感染性疾病:患者一般状况可,胸部CT示右肺下叶多发的结节影,周围可见渗出,血常规、降钙素原正常,无发热、黄痰等急性感染的证据,符合亚急性或慢性感染表现,肺部感染性疾病治疗成功的关键取决于2个因素:①宿主特征:患者为青年男性,合并糖尿病,可能会导致肺部病灶吸收延迟,也可以解释患者虽然肺部病灶进展,但是临床应答并不明显;②微生物特征:首先考虑耐药的肺炎链球菌等常见菌,其次患者PPD试验强阳性,虽然气管镜灌洗液未检到分枝杆菌,肺结核仍需要排除,同时警惕肺炎支原体、真菌性肺病等。(2)非感染性疾病:①肺结节病及淋巴瘤:患者胸部CT未见肺门及纵隔淋巴结肿大,体检未触及浅表淋巴结肿大,肺结节病及肺黏膜相关淋巴瘤一般起始无明显临床症状,一般病程进展较慢,本例患者10 d复查胸部CT肺部进展明显,不符合结节病及淋巴瘤特点;②系统相关性血管炎:本患者仅有肺部受累,化验尿液分析及肾功能均未见异常,未找到其他脏器受累的证据,抗核抗体谱、抗中性粒细胞胞质抗体亦未见异常。胸部CT及浅表体检均未见明显肿大淋巴结,血管炎等结缔组织疾病引起肺部阴影证据不足,建议患者进一步行CT引导下肺穿刺活检,寻找病理证据。
患者于2017年7月21日行CT引导下肺穿刺活检,7月25日病理结果示:(右肺)肺组织淋巴细胞弥漫浸润,肺泡腔及肺间质内查见大量空泡样结构,过碘酸雪夫(PAS)染色、六胺银(GMS)染色、黏液卡红(MC)染色阳性,考虑隐球菌感染(图4)。取穿刺肺组织蜡块切片行隐球菌抗原检测阳性,隐球菌抗原滴度1∶640;血清行隐球菌抗原检测阳性,隐球菌抗原滴度1∶320。追问病史,患者堂哥家养有鸽子,存在鸽粪接触史。2017年7月29日行腰椎穿刺术,留取标本送检,新型隐球菌涂片阴性,脑脊液生化、脑脊液常规检查未见异常,取脑脊液行隐球菌抗原检测阳性,隐球菌抗原滴度1∶2。患者脑脊液隐球菌抗原检测滴度过低,脑脊液常规、脑脊液生化未见明显异常,且患者无头痛不适等症状,考虑隐球菌脑膜炎暂不成立。
调整方案为氟康唑400 mg 1次/d静脉滴注20 d。2017年8月15日复查胸部CT(图5)可见右肺中下叶病灶较前实变,病灶较前进展,ESR为100 mm/1 h,较入院时明显升高,提示患者抗隐球菌治疗效果不佳,再次组织MDT讨论。
蔡晓珊(病理科):隐球菌的常用染色方法是PAS染色、GMS染色和MC染色。隐球菌荚膜嗜黏液卡红,是隐球菌组织化学染色中最具特异度的染色方法[3]。本例患者PAS染色可以见到隐球菌的具有折光性的荚膜,黏液卡红染色、GMS染色均为阳性,符合典型隐球菌病的病理改变。
刘光福(检验科):隐球菌属于环境腐生菌,共有70多个种,对人致病的主要是新型隐球菌,其又分为3个变种:新生变种、格特变种和格鲁比变种[4]。隐球菌病是由隐球菌引起的深部真菌病,可累及中枢、肺、皮肤及骨骼等,广泛存在于土壤及鸽粪中,呈世界性分布,多见于具有严重疾病或免疫功能异常者,近年来无免疫抑制或基础病者发病亦有增多。该病起病隐匿,首诊误诊率高,因此快速准确地检测病原体对于疾病的治疗有重要的价值。传统的检测手段有墨汁染色、分离培养法等,但存在敏感度和特异度低、耗时较长等缺陷。隐球菌荚膜抗原检测是目前诊断隐球菌病常用实验室方法,隐球菌荚膜抗原检测方法主要有乳胶凝集法(LA)、酶联免疫法(ELISA)和血胶体金免疫层析法(LFA)。我院使用的是LFA检测,LFA相较LA、ELISA,更加准确、稳定和快速[5]。荟萃分析结果显示,LFA诊断隐球菌感染的总体敏感度和特异度分别为97.6%和98.1%[6]。本例患者穿刺肺组织隐球菌抗原检测阳性,文献报道,系统性红斑狼疮、类风湿因子、巨球蛋白以及毛孢子菌属、二氧化碳噬纤维菌属、抗酸杆菌均与新生隐球菌荚膜多糖抗原存在交叉抗原,可引起假阳性[7],应注意排除。
席素婷(呼吸与危重症医学科):患者经氟康唑抗感染治疗,肺部病灶进展,PC的影像学变化取决于患者的免疫状态及所感染微生物菌量及致病力。其病情严重程度多取决于患者的免疫状态。患者入院后检查发现糖尿病,经氟康唑靶向治疗,效果不佳,可能存在免疫抑制状态,导致肺部病灶吸收延迟。另外,本例患者脑脊液隐球菌荚膜抗原阳性,不除外存在肺外播散,需警惕隐球菌脑膜炎[8],同时,要除外是否合并肺结核、肺部感染后机化等疾病,建议再次穿刺活检。
张晓琦(呼吸与危重症医学科):宿主的免疫功能状态决定隐球菌感染的相关临床表现和影像学表现。患者有糖尿病,但血糖控制尚可,免疫抑制状态会影响PPD试验的敏感度,患者PPD试验强阳性,正常免疫状态下,隐球菌感染肺部后可诱导较强的迟发型超敏反应,形成肉芽肿性结节。使肺隐球菌感染范围局限,防止在肺内大范围播散。本例患者肺部病灶以结节及相互融合成片为主,相对局限,考虑免疫状态良好[9]。因此要警惕隐球菌耐药的发生。
张绍坤(呼吸与危重症医学科):患者入院时免疫状态良好,但患者随病情发展,复查血常规淋巴细胞计数由入院时的2.29×109/L降到了1.51×109/L,肺部病灶进展,从一定程度上预示着肺部菌量负荷的增加,机体受到细菌或毒素打击时,会出现免疫抑制。因此患者目前可能存在免疫抑制状态,患者病情进展是与免疫抑制状态相关的。另一方面,免疫抑制患者更容易出现继发感染,患者PPD试验强阳性,应警惕合并肺结核。隐球菌感染的表现,除了与宿主免疫因素、病原体的数量等有关外,不断改变的隐球菌的毒力亦起到重要的作用,相关基因研究[[10,11]]结果显示隐球菌有很强的可塑性和微进化能力,增加了隐球菌耐药的可能性。
胡兆秋(呼吸与危重症医学科):结合患者影像学及病理学、微生物检验,患者隐球菌肺炎诊断成立,病灶进展应考虑3个方面:(1)合并其他疾病:肺结核、淋巴瘤、感染后机化等。(2)延迟吸收:隐球菌肺炎是一种亚急性或慢性感染性疾病,肺部病灶的吸收需要时间,肺部真菌疾病治疗即便有效,病灶的吸收也较其他感染性疾病时间长。(3)耐药:目前隐球菌对氟康唑耐药报道例数较少,警惕存在本例患者隐球菌氟康唑耐药的可能,建议更换氟康唑为伏立康唑或两性霉素B,再次穿刺活检,增加取材量,送检验科做病原体培养、涂片染色,同时切片增加抗酸染色,除外合并机化性肺炎(OP)、肺结核等疾病。
更换为两性霉素B继续抗感染治疗,二次穿刺活检。2017年8月22日肺穿刺病理回报:(右肺)纤维组织内成纤维细胞增生伴多核巨细胞形成,纤维组织及多核巨细胞内查见多量圆形真菌样物,考虑隐球菌病。新鲜肺组织研磨后行隐球菌抗原检测:隐球菌抗原阳性,滴度1∶320。新型隐球菌涂片镜检阳性。并接种培养基进行致病菌培养,拟进一步行药敏试验。
病理未找到合并其他感染或非感染疾病的证据,仍支持单纯隐球菌肺炎。继续给予两性霉素B抗隐球菌治疗,加量至每日50 mg抗隐球菌治疗15 d,2017年8月31日复查胸部CT(图6)可见肺部病灶实变影增大,病灶稍进展。患者出现肾功能异常,血肌酐为108.9 μmol/L,血尿素氮为9.9 mmol/L,尿蛋白为1+,并出现发热。遂组织第三次MDT讨论。
杨国儒(呼吸与危重症医学科):患者目前复查胸部CT肺部病灶进展,在使用两性霉素B过程中,出现明显的肾功能损害,继续使用可能会加重肾脏损害程度,减少两性霉素B使用剂量,每日用量达不到有效剂量,会影响治疗效果。目前考虑本患者隐球菌为耐药菌,全球抗真菌监测研究项目[12]统计分析结果显示氟康唑耐药率呈上升趋势。研究结果证明,非HIV的患者在临床发病之前已经存在隐球菌潜伏感染,本患者耐药可能与天然耐药菌株有关,而非药物诱导产生[13]。目前隐球菌感染的诊断多取决于病理诊断及隐球菌荚膜抗原检测,隐球菌培养阳性病例较少,忽视了隐球菌药敏试验对治疗的积极指导作用,研究证实对于氟康唑耐药的隐球菌,可以考虑以伏立康唑作为氟康唑耐药隐球菌病的替代治疗。建议更换为伏立康唑抗感染治疗,并等待经皮肺穿刺组织培养结果,印证耐药的推测。
2017年9月1日患者穿刺肺组织培养(8月19日留取)致病菌培养基报阳,质谱仪鉴定为新型隐球菌,墨汁染色阳性(图7),药敏试验:氟康唑中介,两性霉素B、5-氟胞嘧啶、伊曲康唑、伏立康唑敏感(图8),其中伏立康唑抑菌浓度MIC≤0.06 mg/L,抑菌浓度最低。
结合药敏试验结果,调整治疗方案,给予伏立康唑(首日300 mg,2次/d,静脉滴注,维持剂量200 mg,2次/d,静脉滴注),氟胞嘧啶(1.5 g,4次/d,口服)抗隐球菌治疗。并随访观察。2017年9月19日患者经伏立康唑治疗14 d复查胸部CT(图9)可见肺部病灶较前明显吸收。出院后序贯口服伏立康唑+氟胞嘧啶治疗2个月,序贯伏立康唑200 mg/d,治疗6个月。2017年10月18日、2017年12月27日、2019年1月8日复查胸部CT(图10,图11,图12)肺部病灶持续吸收好转,现已停药,继续随访观察。
王一民(呼吸与危重症医学科):这是一例青年男性患者,除血糖升高外其他免疫功能大致正常,面对这样的患者,临床医生能够按照规范快速确诊为肺隐球菌病,并在治疗效果不佳的时候抽丝剥茧,寻根溯源最终调整治疗方案,患者好转。这样的经历是值得负责医生欣慰,患者欣喜,同行心悦诚服的。能够开展全面而且精准的病原学检查,是未来综合医院感染性疾病诊治的大势所趋。仅以隐球菌病原诊断为例,一家基层医院能够完成组织培养、微生物鉴定和药敏试验,能够将医生的诊断与鉴别诊断思路利用实验室的工具完成验证,这更是十分不容易的。
肺隐球菌病是一种相对少见的,主要由新生隐球菌感染引起的亚急性或慢性肺部真菌感染。临床表现常不典型,且肺部CT表现多样,可见孤立或多发结节,浸润性实变或者混合病灶等,病理学检查是确诊的金标准,但需要强调的是,临床微生物学在隐球菌感染诊断中同样发挥了重要作用。近年来隐球菌抗原检测的临床广泛应用提高了隐球菌感染的早期识别。质谱鉴定和分子检查,以及恰当的药敏试验都提高了临床的诊断成功率和治疗有效率。
所有作者均声明不存在利益冲突



























