
铜绿假单胞菌是一种多见于免疫功能低下或结构性肺病人群中的机会性致病菌,也是院内感染的常见病原菌。健康人群中社区获得性肺炎(CAP)患者铜绿假单胞菌比较少见,但往往侵袭性较强。本文报道重症社区获得性铜绿假单胞菌肺炎1例(PCAP)。本例患者病情进展迅速,伴多脏器功能衰竭,虽然经明确诊断和积极治疗,但最终仍死于感染性休克。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
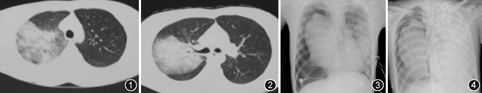
患者男,31岁,因"发热、咳嗽、胸痛3 d,呼吸困难6 h"于2018年5月12日入住中日友好医院。患者2018年5月9日出现发热,体温最高达39.5 ℃,无畏寒、寒战,伴咳嗽,咳黄白色黏痰,痰中偶有带血,感右侧胸背部疼痛明显,就诊于当地诊所,服用"罗红霉素"效果不佳。入院前除就诊1次外,均在家中休息,无其他辅助检查结果。入院当天因胸背部疼痛加重,在当地医院查血常规:白细胞计数为12.2×109/L,中性粒细胞占0. 94;胸部CT示右肺上叶大片实变影伴空洞形成(图1,图2)。入院前6 h患者出现呼吸困难并进行性加重,转至中日友好医院急诊。查血常规示:白细胞计数为4.03×109/L,中性粒细胞占0.92,血红蛋白为150 g/L,血小板计数为107×109/L;降钙素原为16.2 μg/L;丙氨酸氨基转移酶为45 IU/L,总胆红素为14.7 μmol/L,直接胆红素为11 μmol/L,总蛋白为58 g/L,白蛋白为37 g/L,乳酸脱氢酶为696 IU/L,肌酸激酶同工酶为45 IU/L,尿素为21.2 mmol/L,肌酐为351.6 μmol/L,电解质正常;肌钙蛋白T为0.73 μg/L,N端脑钠肽前体为25.3 μg/L;动脉血气分析(FiO21.0):pH值为7.10,氧分压为57 mmHg(1 mmHg=0.133 kPa),二氧化碳分压为57 mmHg,碳酸氢根为17.7 mmol/L,剩余碱为-12.4 mmol/L,乳酸为5.7 mmol/L。给予无创呼吸机辅助通气,1 h后复查动脉血气示酸中毒及氧合水平无改善,且出现嗜睡状态。随后收入呼吸与危重症医学科监护病房。

患者职业为电焊工人。既往体健,无吸烟、饮酒史。
入院查体:体温36.2 ℃,脉率154次/min,呼吸37次/min,血压84/50 mmHg,嗜睡状态,四肢冰凉,口唇发绀,右肺呼吸音低,双肺散在湿性啰音,心律齐,各瓣膜区未闻及杂音。动脉血气分析(FiO21.0):pH值为7.06,氧分压为60.8 mmHg,二氧化碳分压为72.4 mmHg,碳酸氢根为16.4 mmol/L,乳酸为5.8 mmol/L;血常规:白细胞计数为1.09×109/L,中性粒细胞计数为0.5×109/L,血红蛋白为158 g/L,血小板计数为93×109/L;肝功能大致正常,尿素为23 mmol/L,肌酐为410 μmol/L;降钙素原为23.3 μg/L;肌钙蛋白T为1.0 μg/L,N端脑钠肽前体>35 000 μg/L;活化部分凝血活酶时间为52.5 s,D-二聚体为2.78 mg/L。床旁X线胸片可见右侧气胸,肺叶压缩约50%,右肺均匀致密影,左肺团片致密影(图3)。
入院后立即行气管插管呼吸机辅助呼吸[PC模式:PC为14 cmH2O(1 cmH2O=0.098 kPa),PEEP为3 cmH2O,FiO2为1.0],并行胸腔闭式引流术,积极液体复苏纠正休克,经验性应用亚胺培南/西司他汀+万古霉素+奥司他韦+阿奇霉素抗感染治疗,但患者氧合状态仍难以维持。入院5 h后建立静脉-静脉体外膜肺氧合(venovenous-extracorporeal membraneoxygenation,VV-ECMO),随后氧合状态有所改善,但循环衰竭仍难以纠正(去甲肾上腺素剂量为4.8 μg·kg-1·min-1,心率150~160次/min,血压仅为60~70/30~45 mmHg)。心脏彩色超声提示全心收缩功能减低,射血分数约10%。考虑为脓毒性休克合并心源性休克,将VV-ECMO更改为VAV-ECMO维持血压。
2018年5月14日气管镜检查见气管黏膜轻度充血水肿,隆突锐利,双肺各叶段黏膜充血水肿较明显,可见中等量黄褐色稀薄分泌物(图4)。BALF培养结果为铜绿假单胞菌,药敏试验结果见表1。同时,患者右侧胸腔闭式引流液为黄色浑浊液体,经反复送检,培养结果与BALF相同。其他细菌、病毒、真菌、结核等检查均阴性。在明确病原学后,抗菌药物调整为亚胺培南/西司他丁+万古霉素。
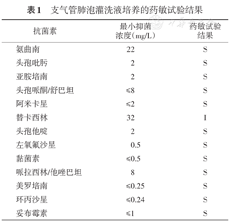
支气管肺泡灌洗液培养的药敏试验结果
支气管肺泡灌洗液培养的药敏试验结果
| 抗菌素 | 最小抑菌浓度(mg/L) | 药敏试验结果 |
|---|---|---|
| 氨曲南 | 22 | S |
| 头孢吡肟 | 2 | S |
| 亚胺培南 | 2 | S |
| 头孢哌酮/舒巴坦 | ≤8 | S |
| 阿米卡星 | ≤2 | S |
| 替卡西林 | 32 | I |
| 头孢他啶 | 2 | S |
| 左氧氟沙星 | 0.5 | S |
| 黏菌素 | ≤0.5 | S |
| 哌拉西林/他唑巴坦 | 8 | S |
| 美罗培南 | ≤0.25 | S |
| 环丙沙星 | ≤0.24 | S |
| 妥布霉素 | ≤1 | S |
采用保护性通气策略,同时保证胸腔闭式引流气泡无明显增多,PC控制在10~16 cmH2O,PEEP控制在3~10 cmH2O,潮气量波动在100~150 ml。ECMO血流量控制在4.5~5.5 L/min,气流量为5~9 L/min,根据氧合状态及循环情况调整ECMO流量,使血氧饱和度维持在90%以上。
监测N端脑钠肽前体持续>35 000 μg/L,肌酸激酶同工酶持续升高,最高达89.4 μg/L,肌钙蛋白I最高达4.3 μg/L。入院第3天床旁心脏超声示心脏收缩功能有所改善(射血分数为54%),当日下午患者VAV-ECMO的A端血流速度明显减慢,且在A端近右侧股动脉端肉眼可见明显暗区,可疑血栓形成。遂离断A端,改为VV-ECMO,同时持续给予胶体为主的液体复苏、连续行肾脏替代疗法(continuous renal replacement therapy,CRRT)。
患者入院时表现为粒细胞缺乏,复查血红蛋白、血小板进行性下降,凝血功能异常,凝血酶原时间最高达21.5 s,活化部分凝血活酶时间最高达58.8 s。外周血涂片见大量异常幼稚细胞,偶见异型淋巴细胞。于2018年5月14日行骨髓穿刺,骨髓病理见幼稚粒系增多,吞噬细胞增多,可见噬血现象。次日查自然杀伤细胞活性为12.81%(正常值参考范围≥15.11%),血清铁蛋白为2 99 μg/L。持续输注血浆、血小板支持治疗,给予重组人粒细胞刺激因子促进造血功能。
虽经过全力积极的抢救,患者仍持续休克难以纠正,入院第6天下午生命体征急剧恶化,呈深昏迷,对血管活性药物无反应,最终家属要求放弃治疗,自动出院。
最终诊断为:(1)重症社区获得性肺炎(铜绿假单胞菌),脓毒性休克,Ⅱ型呼吸衰竭,代谢性酸中毒,脓气胸(右侧);(2)脓毒症心肌病,心源性休克;(3)急性肾损伤;(4)急性肝功能衰竭;(5)噬血细胞综合征?粒细胞缺乏,血小板减少中度贫血,凝血功能异常,电解质紊乱。
本例为青年男性,既往无基础疾病,发病前及入我院前均未住院治疗,以发热、咳嗽、胸痛起病,胸部CT示右上肺实变伴空洞形成,随后出现气胸,迅速进展至双肺病变,并合并脓毒性休克,需要呼吸机及更高级的方式支持治疗。患者BALF和胸腔引流液均培养出敏感铜绿假单胞菌,故重症社区获得性肺炎(铜绿假单胞菌)诊断明确。
铜绿假单胞菌是一种广泛分布在自然界中的革兰阴性杆菌,毒力很强,能够产生多种毒素,包括外毒素和一些酶,是一种多见于免疫功能低下或结构性肺病人群中的机会性致病菌,也是院内感染的常见病原菌,其产生的生物膜可保护菌群,减少宿主内环境和免疫系统的影响[1,2]。社区来源的铜绿假单胞菌感染常见于皮肤、外耳等表皮及软组织感染。肺部感染则多发生在患有慢阻肺、支气管扩张、囊性纤维化等结构性肺病的患者[3]。而既往健康人罹患PCAP的情况罕见,过去近60年中,国内外公开报道的病例约20例[4,5,6,7]。这类肺炎往往进展迅速,并发症多,病死率可达40%~60%。本例患者同时合并脓气胸、脓毒症性心肌病、全血细胞减少及多脏器功能衰竭等并发症,与已有报道的病例相比更加危重。
PCAP患病人群中男女比例为1.15∶1,中位发病年龄为(44±14)岁,发热、咳嗽、胸痛是本病最常见的症状,少数患者体温可达39 ℃以上,还可表现为呼吸困难、肩痛、背痛等,有些患者发病时仅表现为单侧肩痛。右上肺叶最常受累,约有2/3的患者首次X线胸片表现为右肺上叶实变。与其他社区获得性肺炎患者相比,此类患者非常容易出现呼吸功能衰竭和感染性休克[3,8,9]。
PCAP可能与暴露于受污染的气溶胶有关,文献报道有些PCAP患者曾用过家用湿化器和水疗仪,并且从可疑的污染水源中分离培养出了与患者肺内相同的铜绿假单胞菌[10]。此外,从事金属铸造和焊接的工人可能因为吸入受铜绿假单胞菌污染的粉尘而患病,这提示患者可能是由于吸入了污染的气溶胶而感染[11]。南非学者报道,PCAP的暴发还与严重干旱缺水期间居民用水受限有关,这可能与市政供水系统水压升高促进了铜绿假单胞菌生物膜的生长,进而水源受到了污染有关[12]。本例患者从事金属焊接工作,存在可疑的高危职业接触史。我们曾与患者所在工厂进行沟通,希望获取工作环境中的标本进一步分析但被拒绝。另外,吸烟可能也是PCAP的危险因素[9]。
文献报道,与囊性纤维化患者相比,导致急性感染和非囊性纤维化患者感染的铜绿假单胞菌表达Ⅲ型分泌蛋白的菌株更多,Ⅲ型分泌蛋白包括ExoS、ExoT、ExoU及ExoY等外毒素,高表达可明显增加死亡风险[13]。此外,有些不表达Ⅲ型分泌蛋白的铜绿假单胞菌菌株可以分泌另一种引起严重肺损伤和脓毒症的毒素,称为Exolysin(ExlA),这种仅表达ExlA而不表达Ⅲ型分泌蛋白的铜绿假单胞菌在动物实验中表现出了极强的毒力[14,15]。本例患者感染的铜绿假单胞菌的药敏试验结果显示几乎对所有抗菌素均敏感,但在经验性选择亚胺培南/西司他丁+万古霉素的情况下,感染依然未得到有效控制且病情持续恶化,我们推测Ⅲ型分泌蛋白或Exolysin的表达可能是PCAP患者病死率高的机制之一。
另外,患者噬血细胞综合征诊断基本明确。而除了原发噬血细胞综合征外,感染、自身免疫性疾病、肿瘤(特别是血液系统肿瘤)均可引起继发性噬血细胞综合征[16,17]。本例患者外周血涂片及骨髓病理均见幼稚细胞,血液科会诊考虑因未见原始细胞且患者同时应用重组人粒细胞刺激因子也对检查结果造成了一定影响,故急性白血病可能性很小,结合患者同时存在重症肺炎,认为感染引起继发性噬血细胞综合征的可能性较大。
所有作者均声明不存在利益冲突



























