
分析2019新型冠状病毒(2019-nCoV)肺炎患者的临床特征,研究患者血清中炎症相关细胞因子与病情严重程度的相关性。
选取2020年1月在华中科技大学同济医学院附属同济医院隔离病房收治的29例2019-nCoV患者为研究对象,收集临床资料,分析一般情况、临床症状、血液检验及CT影像学的特征。根据相关诊断标准将患者分为普通型(15例)、重型(9例)和危重型(5例)3组。检测各组患者血清中炎症相关细胞因子及其他反映病情变化标志物的表达水平,比较和分析3组患者血清中上述各指标变化的规律及其与疾病临床分型的关系。
(1)2019-nCoV肺炎患者的主要临床症状为发热(28/29),伴或不伴有呼吸道及其他系统症状;2例死亡患者分别合并基础疾病和混合细菌感染。(2)患者外周血一般表现为白细胞总数正常或减低(23/29),淋巴细胞计数减少(20/29),超敏C反应蛋白(hs-CRP)增高(27/29),降钙素原正常。多数患者血清中乳酸脱氢酶(LDH)表达水平明显增高(20/29),白蛋白减低(15/29);而丙氨酸氨基转移酶(ALT), 天冬氨酸氨基转移酶(AST),总胆红素(Tbil),血肌酐(Scr)等指标无明显变化。(3)典型病例的CT表现为单发或多发的斑片状磨玻璃影,伴有小叶间隔增厚;疾病进展时病灶增多、范围扩大,磨玻璃影与实变影或条索影共存,部分重症患者表现为双肺弥漫性病变。(4)3组患者血清中白细胞介素-2受体(IL-2R)、IL-6表达水平差异均具有统计学意义(P<0.05),其中危重型高于重型、重型高于普通型。而3组研究对象血清中的肿瘤坏死因子-α(TNF-α)、IL-1β、IL-8、IL-10、hs-CRP、淋巴细胞计数、LDH表达水平差异均无统计学意义(P>0.05)。
2019新型冠状病毒肺炎的临床特征与一般病毒性肺炎类似;高分辨率CT有助于鉴别诊断;患者血清中IL-2R、IL-6表达水平有助于疾病临床分型,可能有助于预测新冠肺炎的严重程度和预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自2019年12月以来,湖北省武汉市陆续出现2019新型冠状病毒(2019-nCoV)感染的肺炎病例,该传染病迅速先后蔓延至全国其他地区及海外多个国家[1,2]。随后,中国疾病控制中心(CDC)宣布将该病纳入国家"乙类"传染病,采取"甲类"传染病防控措施[3]。根据国家CDC官方网址查询(http://2019ncov.chinacdc.cn/nCoV/),截止到2020年2月3日15∶19,全国累计确诊2019新型冠状病毒肺炎患者17 332例,疑似患者21 558例,死亡361例;其中湖北省武汉市确诊患者5 142例,死亡265例。近期,有关2019-nCoV的基础、临床及流行病学研究不断涌现[4,5,6],有一项研究分析了武汉某定点医院41例确诊2019-nCoV肺炎患者临床资料,发现该病毒可导致严重的呼吸系统症状,一部分患者(13/41)需进入RICU治疗,并具有一定的病死率(6/41)[7]。另外,该研究结果显示,相较于入住普通病房患者,入住ICU的患者血清中炎症因子IL-2、IL-7、IL-10、粒细胞集落刺激因子(GSCF)、干扰素诱导蛋白-10(IP-10)、单核细胞趋化蛋白-1(MCP1)、巨噬细胞炎性蛋白1α(MIP1A)和肿瘤坏死因子α(TNF-α)水平增高[7]。但是,该研究未对炎症因子在新型冠状病毒性肺炎中的临床意义做深入探讨。本文将分析华中科技大学同济医学院附属同济医院收治的2019-nCoV肺炎患者的临床特征,并深入探讨患者血清中各细胞因子及其他炎症相关指标的表达水平变化及其临床意义。
该研究已通过华中科技大学同济医学院附属同济医院医学伦理委员会批准,符合赫尔辛基宣言的原则。按2019-nCoV肺炎疑似病例诊断标准[3]:(1)流行病学史:①发病前14 d内有武汉地区或其他有本地病例持续传播地区的旅行史或居住史;②发病前14 d内曾接触过来自武汉市或其他有本地病例持续传播地区的发热或有呼吸道症状的患者;③有聚集性发病或与2019-nCoV感染者有流行病学关联。(2)临床表现:①发热;②具有上述肺炎影像学特征;③发病早期白细胞总数正常或降低,或淋巴细胞计数减少。有流行病学史中的任何1条,符合临床表现中任意2条就可诊断为疑似病例。患者纳入标准(同时满足2条):(1)2019-nCoV肺炎疑似病例;(2)痰液、咽拭子、下呼吸道分泌物等标本行实时荧光RT-PCR检测2019-nCoV核酸阳性。收集2020年1月14—29日,在华中科技大学同济医学院附属同济医院隔离病房符合上述标准的29例2019-nCoV肺炎患者的临床资料。
所有确诊患者入院时均根据"新型冠状病毒感染的肺炎诊疗方案(试行第四版)"进行临床分型[3],具体如下:(1)普通型:具有发热、呼吸道等症状,影像学可见肺炎表现;(2)重型:符合下列任何一条:①呼吸窘迫,RR≥30次/min;②静息状态下,指氧饱和度≤93%;③动脉血氧分压(PaO2)/吸氧浓度(FiO2)≤300 mmHg(1 mmHg=0.133 kPa);(3)危重型:符合以下情况之一:①出现呼吸衰竭,且需要机械通气;②出现休克;③合并其他器官功能衰竭需要ICU监护治疗。
入院后清晨取空腹静脉血送检验科检查血常规、血生化,并应用酶联免疫吸附试验法检测血清炎症因子(IL-1β、IL-2R、IL-6、TNF-α、IL-8、IL-10),操作严格按照说明书进行,试剂盒购自美国eBioscience公司(EPX650-16500-901)。
采用SPSS 19.0软件,正态分布计量资料以Mean±SD表示,两样本均数比较采用t检验,两个以上样本均数比较采用方差检验;非正态分布计量资料以中位数描述,采用秩和检验;计数资料采用χ2检验,P<0.05为差异有统计学意义。
(1)一般资料:29例确诊患者年龄为26~79岁,中位年龄为56岁;男21例(72%),女性8例(28%);有武汉华南海鲜市场接触史的患者2例(7%);既往有吸烟史2例(7%);有基础疾病患者16例(55%),其中患高血压8例(28%),糖尿病5例(17%),恶性肿瘤1例(3%),慢性肝病2例(6%)。孕妇1例(3%),肺癌术后患者1例(3%)。死亡2例(7%),其中1例合并肺癌,1例合并细菌感染。(2)症状和体征:29例确诊患者中发热28例(97%),咳嗽、咳痰21例(72%),胸闷呼吸困难17例(59%),乏力、肌肉酸痛12例(41%),头痛2例(7%),腹泻4例(14%)。主要体征包括呼吸频率增快(>24次/分)6例(21%)。
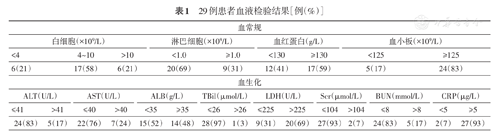
29例患者血液检验结果[例(%)]
29例患者血液检验结果[例(%)]
| 血常规 | ||||||||
|---|---|---|---|---|---|---|---|---|
| 白细胞(×109/L) | 淋巴细胞(×109/L) | 血红蛋白(g/L) | 血小板(×109/L) | |||||
| <4 | 4~10 | >10 | <1.0 | ≥1.0 | <130 | ≥130 | <125 | ≥125 |
| 6(21) | 17(58) | 6(21) | 20(69) | 9(31) | 12(41) | 17(59) | 5(17) | 24(83) |
| 血生化 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ALT(U/L) | AST(U/L) | ALB(g/L) | TBil(μmol/L) | LDH(U/L) | Scr(μmol/L) | BUN(mmol/L) | CRP(μg/L) | ||||||||
| ≤41 | >41 | ≤40 | >40 | <35 | ≥35 | ≤26 | >26 | ≤225 | >225 | ≤104 | >104 | ≤8 | >8 | <5 | ≥5 |
| 24(83) | 5(17) | 22(76) | 7(24) | 15(52) | 14(48) | 28(97) | 1(3) | 9(31) | 20(69) | 27(93) | 2(7) | 24(83) | 5(17) | 2(7) | 27(93) |
29例确诊患者中外周血白细胞总数正常或减低23例(79%),淋巴细胞计数减少20例(69%),血红蛋白和血小板无明显变化趋势。高敏C反应蛋白升高27例(93%),降钙素原正常。血清LDH水平增高20例(69%),15例患者(52%)的血清ALB降低,但绝大部分患者的肝功能(ALT,AST,Tbil)、肾功能(BUN,Scr)指标无明显异常。
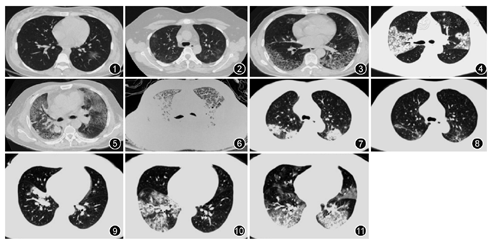
根据29例2019-nCoV肺炎患者的CT影像学表现,总结较为典型的征像如下(图1,图2,图3,图4,图5,图6):(1)单发磨玻璃阴影(GGO);(2)多发外周带磨玻璃阴影;(3)双肺斑片状GGO伴节段性肺实变;(4)铺路石征;(5)双肺弥漫性磨玻璃阴影伴支气管充气征;(6)双肺大面积实变影伴小叶间质增厚。部分患者CT影像学可呈如下动态改变:(1)早期:病变局限,呈斑片状、亚段或节段性磨玻璃影,多伴有小叶间隔增厚;(2)进展期:病灶增多、范围扩大,累及多个肺叶,部分病灶实变,磨玻璃影与实变影或条索影共存,有时会出现"铺路石征";(3)重症期:双肺弥漫性病变,少数呈"白肺"表现,实变影为主,合并磨玻璃影,多伴条索影,支气管充气征。根据临床分型标准[3],29例确诊患者分为普通型患者15例,重型患者9例(其中1例为孕妇)和危重型患者5例(其中肺癌术后1例)。在15例普通型患者中,有9例患者通过抗病毒+抗细菌+支持治疗,肺部病变明显或者部分吸收,病情缓解(图7,图8)。在14例重型和危重型患者中,7例影像学显示有明显的疾病进展(图9,图10,图11),其中有2例死亡。

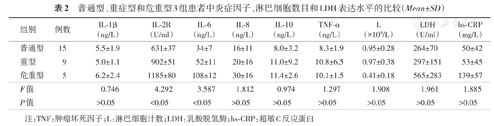
普通型、重症型和危重型3组患者中炎症因子、淋巴细胞数目和LDH表达水平的比较(Mean±SD)
普通型、重症型和危重型3组患者中炎症因子、淋巴细胞数目和LDH表达水平的比较(Mean±SD)
| 组别 | 例数 | IL-1β(ng/L) | IL-2R(U/ml) | IL-6(ng/L) | IL-8(ng/L) | IL-10(ng/L) | TNF-α(ng/L) | L(×109/L) | LDH(U/ml) | hs-CRP(mg/L) |
|---|---|---|---|---|---|---|---|---|---|---|
| 普通型 | 15 | 5.5±1.9 | 631±37 | 34±7 | 16±11 | 8.0±3.2 | 8.3±1.9 | 0.95±0.28 | 264±70 | 50±42 |
| 重型 | 9 | 5.0±1.1 | 902±51 | 52±11 | 20±16 | 11.0±9.2 | 10.8±6.5 | 0.97±0.38 | 297±151 | 53±45 |
| 危重型 | 5 | 6.2±2.4 | 1185±80 | 108±12 | 30±16 | 11.4±2.6 | 10.1±1.5 | 0.41±0.18 | 565±283 | 139±57 |
| F值 | 0.746 | 4.292 | 3.587 | 1.812 | 0.974 | 1.297 | 1.908 | 1.961 | 1.885 | |
| P值 | >0.05 | <0.05 | <0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 |
注:TNF:肿瘤坏死因子;L:淋巴细胞计数;LDH:乳酸脱氢酶;hs-CRP:超敏C反应蛋白
普通型、重症型和危重型3组血清IL-2R与IL-6水平差异均有统计学意义(均P<0.05),危重型组>重型组>普通型组;而3组患者血清中的IL-1β、IL-8、IL-10、TNF-α、hs-CRP、淋巴细胞和LDH水平差异均无统计学意义(均P>0.05)。
2019-nCoV属于β属的冠状病毒,常为多形性,直径为50~200 nm。S蛋白是病毒的主要蛋白之一,其编码基因可用于病毒分型。N蛋白包裹病毒基因组,可作为诊断抗原[8,9]。经过病毒序列比对分析,推测2019-nCoV的自然宿主可能是蝙蝠等野生动物[10]。在从蝙蝠到人的传染过程中也很可能存在未知的中间宿主媒介[10]。初期感染人群的地理分布与武汉华南海鲜市场关系密切,武汉市以外地区的感染病例多数为与武汉市旅行相关的输入性病例。目前,该病毒存在明确的人传人现象[11],因而医务人员感染、社区内传播的病例正在快速增加。
在本研究中,我们分析了29例确诊为2019-nCoV肺炎患者的临床资料,总结该疾病的临床特征:(1)绝大多数患者都有不同程度的发热,多数伴有呼吸道症状。本组病例也有很多患者具有非呼吸系统症状,包括头痛、腹泻及乏力等,因而发热门诊医师需要高度重视非呼吸系统症状的识别。29例病例中死亡2例,分别为合并了肺癌和细菌感染。Guo等[12]发现病毒性肺炎的患者有基础疾病、有混合细菌感染时病死率增加,该研究结果与本研究结果一致。(2)外周血中,多数患者白细胞总数正常或减低,淋巴细胞计数减少。很多患者血清中LDH表达水平增高。多数患者C反应蛋白升高,降钙素原一般正常。严重者淋巴细胞进行性减少。在当前严峻的疫情下,我们推荐每个发热患者都需做高分辨率CT(HRCT)而不是X线胸片,因为X线胸片常常会遗漏早期病变。尽管病毒性肺炎的放射学表现一般被认为是非特异性的,很难与其他感染相鉴别[13]。但是,学者研究发现冠状病毒性肺炎仍具有一定较为特别的CT表现,如早期为多发片状磨玻璃状阴影,其内纹理可呈网格状改变[14,15]。本组很多患者具有典型的CT表现:早期呈单发或多发的斑片状磨玻璃影,伴有小叶间隔增厚;进展期表现为病灶增多、范围扩大,磨玻璃影与实变影或条索影共存;重症期表现为双肺弥漫性病变,少数呈"白肺"表现,以实变影为主,合并磨玻璃影,多伴条索影以及空气支气管征。胸腔积液或淋巴结肿大少见[9]。当临床医师遇到快速进展性肺炎患者时,若患者HRCT具有上述较为典型的影像学特征,再结合感染风险和当下流行病学资料,对诊断2019-nCoV肺炎是很有帮助的。虽然不能仅根据影像学特征作出最终诊断,但临床和影像学的结合可以极大地提高对该病诊断的准确性。
国家卫计委修订的"新型冠状病毒感染的肺炎诊疗方案(试行第四版)"中对该疾病进行临床分型,该分型较为简单易行,对我们临床工作具有很好的指导性。但我们同时应该注意到,每个患者对病毒产生的免疫应答是不一样的,具有很大的个体差异,由此产生的临床症状、疾病进展、对治疗药物和疫苗的反应差异很大[16]。因此,我们对2019-nCoV感染的临床分型还应该考虑个体的炎症反应,寻找一些客观指标,帮助提高临床分型的准确性,弥补不足。众所周知,免疫功能可使机体获得防卫能力,抵抗外界感染,良好的免疫功能可帮助机体清除外来微生物,控制感染,使机体恢复健康。但是任何事物都有两面性,当病毒入侵人体时,如果免疫系统被过度激活或者失去控制,就会产生极端的免疫反应,释放大量细胞因子,反过来攻击宿主,这种现象被称之为"细胞因子风暴"。例如SARS、埃博拉等病毒感染的后期,免疫系统对身体产生猛烈攻击,细胞因子风暴成为很多患者最终死亡的主因[17]。研究结果显示,细胞因子和趋化因子在重症感染患者体内明显升高,被认为可反映疾病严重程度[18]。最近Guo等[12]回顾性分析病毒性肺炎患者的临床资料后发现,死亡组患者相较于存活组,CD3+T细胞、CD3+CD4+T细胞、CD3+CD8+T细胞绝对计数水平均明显降低,提示细胞免疫功能低下;而死亡组患者的各项炎症因子水平较存活组更高,这些结果表明死亡组患者体内存在过度的炎症反应。另外,该研究还提出将淋巴细胞计数<0.8×109/L作为预测病毒性肺炎死亡风险模型(MuLBSTA score)的指标之一[12]。本研究收集了29例2019-nCoV肺炎患者,根据临床分型标准,分为危重型、重型和普通型3组,首先通过ELISA检测全部研究对象血清中IL-1β、IL-2R、IL-6、TNF-α、IL-8、IL-10多个细胞因子的表达水平;随后,我们比较3组患者中各细胞因子、淋巴细胞计数、hs-CRP和LDH表达水平的差异。研究结果显示,2019-nCoV肺炎患者外周血IL-2R和IL-6水平均显著增高,危重型组>重型组>普通型组;而3组患者血清中IL-1β、IL-8、IL-10、TNF-α、hs-CRP、淋巴细胞计数和LDH水平无明显差异。在本研究中,虽然发现多数2019-nCoV肺炎患者外周血中淋巴细胞计数明显减低,而hs-CRP明显增高,但统计结果显示淋巴细胞计数和hs-CRP表达水平与疾病严重程度无明显相关性。因此,我们认为IL-2R和IL-6与传统指标(淋巴细胞计数和hs-CRP)相比,在预测病情严重程度方面具有一定的优势。由于IL-2R、IL-6表达水平与病情的严重程度有明显的相关性,病情越重,表达水平越高,因此这两项指标有望用来预测患者的预后。我们推测IL-2R和IL-6参与了2019-nCoV肺炎的发生发展过程,可以作为预后评价的参考指标和治疗靶点之一(如特异性抗体等)。今后,我们将在大样本患者的血清中检测炎症因子的表达水平并评价其临床意义,以期进一步验证本研究结论。同时,我们也将深入研究寻找可能的干预手段,减低过度炎症反应,为临床上治疗重症或危重症的2019-nCoV肺炎提供思路。
所有作者均声明不存在利益冲突



























