
弥漫性泛细支气管炎是一种表现为双肺弥漫性细支气管的慢性炎症性疾病,可与胸腺瘤并存。本文报道1例胸腺瘤合并弥漫性泛细支气管炎的患者,经手术切除胸腺瘤后应用大环内酯类及支气管舒张剂治疗效果良好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,72岁,主因"咳嗽、气短6个月"而来我院门诊就诊。患者6个月前无明显诱因开始出现咳嗽、咳白色痰(偶尔为黄色痰),伴气短,患者间断使用"抗生素"治疗,但咳嗽、气短无明显好转。1个月前当地医院X线胸片示双肺纹理增多。胸部CT示双肺弥漫性小叶核心结节,细支气管管壁增厚,管腔扩张,胸腺区软组织密度影伴强化(图1,图2,图3)。2周前患者出现鼻塞,鼻窦CT示全组鼻窦炎(图4,图5),为求进一步治疗来我院门诊。发病以来体重下降2.5 kg。既往史:高血压2年,冠心病1年,目前应用"氨氯地平和单硝酸异山梨酯"等治疗。无吸烟及药物过敏史,无放射性及毒物接触史,无相关家族病史。体检:体温36.1 ℃,血压124/79 mmHg(1 mmHg=0.133 kPa)。一般情况好,无杵状指,浅表淋巴结未触及肿大。双肺呼吸音粗,双下肺可闻及湿性啰音。腹软无压痛,肝脾肋下未触及,四肢肌力正常,双下肢不肿。血气分析:pH值为7.39,氧分压(PaO2)为66.4 mmHg,二氧化碳分压(PaCO2)为38.9 mmHg,吸入氧浓度(FiO2)为21%。
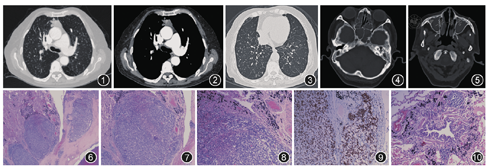

初步诊断:胸腺瘤,弥漫性泛细支气管炎(diffuse panbronchiolitis,DPB)?副鼻窦炎。辅助检查:血、尿、便常规均正常。痰涂片找抗酸杆菌及痰培养均阴性,类风湿因子、抗核抗体谱、抗中性粒细胞胞质抗体(ANCA)及HIV抗体均阴性,血清免疫球蛋白均正常,肺功能显示为阻塞性通气功能障碍,FEV1占预计值%为61.1%,FEV1/FVC为53.3%,支气管舒张试验阴性,一氧化碳弥散功能(DLCO)占预计值%为71.7%。呼出气一氧化氮(FeNO)为14 ppb。肿瘤标志物:癌胚抗原(CEA)阴性,糖类抗原19-9(CA19-9)193 U/ml(正常值<37 U/ml),细胞角蛋白片段21-1(CYFRA21-1)为6.8 μg/L(正常值<3.3 μg/L)。
患者转入胸外科手术治疗,术中探查纵隔肿物为不规则质硬,直径最大4 cm,与周围组织关系不清,行纵隔肿物切除术,将关系紧密的部分纵隔胸膜、心包、右上肺等一并切除,同时切除部分右下肺组织送检,病理见肿瘤组织由密集小淋巴细胞和上皮样细胞组成,间质纤维组织增生,分隔包绕肿瘤组织并呈结节状排列,伴坏死,侵犯心包,并浸润纵隔软组织,形成结节状(图6,图7,图8)。免疫组织化学染色结果符合B2型胸腺瘤(图9)。肺组织病理胸膜下、细支气管周围见较多碳末沉积,细支气管壁弥漫性淋巴细胞浸润,考虑为DPB(图10)。术后患者恢复良好,给予阿奇霉素0.25 g,隔日1次,口服;噻托溴铵18 μg,1次/d吸入治疗;孟鲁司特10 mg,每晚1次口服。1个月后患者气短症状明显改善,1年后复查肺功能FEV1占预计值%为84%,FEV1/FVC为64%。目前仍在随访中,至今病情稳定。
DPB是一种弥漫性双肺呼吸性细支气管的气道慢性炎症性疾病, "弥漫性"是指病变遍布于双肺, "泛"是指炎症累及呼吸性细支气管全层[1],1969年首先由日本学者描述并报道,近几十年才逐渐被大家所认识和接受[2]。本病多发生于东亚地区,以日本最多,亚洲其他国家包括我国也有报道[3]。
目前尚不清楚DPB的确切发病机制,可能与遗传、环境和全身性因素有关。尽管DPB与遗传性疾病囊性纤维化临床表现相似,如鼻窦炎和支气管扩张等,但在DPB患者中未发现外分泌功能、跨膜转导调节因子蛋白和汗液电解质的异常[4]。
DPB可与胸腺瘤并存,在PubMed和CNKI数据库上检索相关文献发现,最早的报道来自于日本,其次是中国和印度[5,6,7,8,9,10,11]。由于某些报道未提供免疫球蛋白的检查结果,所以尚需和Good综合征相鉴别[12]。胸腺瘤和DPB同时发生或相继出现的现象以及Good综合征的发病机制为研究DPB的病因提供了线索,即机体免疫功能紊乱使末梢气道具有过度反应性,同时气道防御功能低下易发生感染[9]。本例患者CA199升高近5倍,既往文献也有DPB患者肿瘤相关抗原升高的报道[8, 13]。胸腺瘤可以合并重症肌无力、Good综合征以及闭塞性细支气管炎等副肿瘤综合征,笔者认为胸腺瘤相关的DPB也有可能是其副肿瘤综合征中的一种。胸腺瘤也可合并非特异性支气管扩张,但病变往往比较局限,可能与胸腺瘤导致的免疫功能异常有关[11]。
DPB临床表现为咳嗽、咳痰,通常会咳出大量脓痰,半数未治疗患者痰量达每日50 ml以上,伴劳累性呼吸困难,通常在咳嗽开始后数月出现,可伴有哮鸣音和体重减轻,杵状指少见[1]。75%的DPB患者可出现慢性副鼻窦炎,通常早于胸部症状数年甚至数十年出现,本例患者的临床表现比较典型。
DPB患者的X线胸片可表现为支气管血管纹理增多和(或)弥漫性边界不清的结节。高分辨率CT可见细支气管管壁增厚和双肺弥漫分布的小叶核心结节影及树芽征,晚期可表现为双肺弥漫性支气管扩张[14]。DPB的组织病理学表现为全层的呼吸性细支气管炎,淋巴细胞、浆细胞组成的透壁性浸润,部分患者支气管管腔及肺泡腔内可见"泡沫样"巨噬细胞(也称为泡沫细胞),最终进展为继发性细支气管扩张[6]。临床诊断DPB通常不需要进行肺活检,而确诊则需要满足临床标准,并符合主要的组织病理学特征[15]。
DPB如果未经治疗,常在数年内发生弥漫性支气管扩张、进行性呼吸衰竭,最终死亡。50%的患者在诊断5年内死亡,75%的患者在10年内死亡。自从使用小剂量大环内酯类抗生素进行长期治疗以来,已使DPB的10年生存率提高到90%以上[16]。基于此,推荐对所有诊断为DPB的患者使用小剂量大环内酯类长期治疗。而考虑到本例患者的DPB可能是胸腺瘤所导致的副肿瘤综合征,所以手术切除肿瘤是必须的选择。
所有作者均声明不存在利益冲突



























