
由新型冠状病毒(SARS-CoV-2)引发的新型冠状病毒肺炎(COVID-19)的全球大流行,对全球公众健康产生了严重影响。新型冠状病毒疫苗的接种可能成为终止新冠疫情的最有效手段之一。当前疫苗开发主要以病毒S蛋白作为抗原,采用不同设计路线。目前正式发表的Ⅰ/Ⅱ期临床试验数据的项目有10项,这些项目所报告之候选疫苗的安全性、免疫原性和疫苗保护效力,尚待Ⅲ期临床研究结果进一步评估。当前新冠疫苗的研发和制备仍面临着诸多风险,也为疾病诊治带来挑战,应扩大全球合作进一步推动疫苗研发、疫情控制。

新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染的暴发引起了新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)的全球大流行。据WHO统计,截至2021年2月15日,共导致全球108 579 352人感染,其中2 396 408人死亡[1]。目前针对COVID-19仍缺乏有效的治疗手段,尚无经过严格“随机、双盲、安慰剂对照研究”证实的抗病毒药物可供使用[2]。而群体免疫的获得需要依靠病毒的自然感染或有效的疫苗接种。但人类尚无法评估前者可能引发的严重后果,因此新型冠状病毒疫苗(简称新冠疫苗)的大规模接种业已成为众望所归的终止新冠疫情的最有效手段之一。目前全球已有242个新冠疫苗研发项目,其中66个疫苗进入临床试验阶段[3],其中部分研究已经公布结果。本文拟从研发策略、评价体系、临床试验进展、风险挑战等方面对研发情况进行综述。
疫苗研发的两个重点为疫苗抗原和技术路线的选择。
1. 新冠疫苗的抗原选择:新冠病毒疫苗的抗原选择主要基于SARS-CoV-2进入宿主细胞的机制。SARS-CoV-2主要结构蛋白之一刺突蛋白(spike protein,S蛋白)可以特异性结合宿主细胞的血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2),使病毒附着在宿主细胞上。之后S蛋白能够进行结构重排,驱动病毒进入细胞[4]。因此,阻断S蛋白与ACE2的结合,被认为可以阻断病毒传播。除灭活病毒疫苗外,目前进入Ⅲ期临床的新冠疫苗都是以S蛋白、S蛋白受体结合区域或S蛋白亚基作为抗原基础[5]。另外,核衣壳蛋白(nucleocapsid protein,N蛋白)、SARS-CoV-2的T和B细胞表位也可能为疫苗设计的潜在靶点。
2. 新冠疫苗的技术路线:疫苗的技术路线主要可分为四大类:病毒疫苗(减毒活疫苗和灭活疫苗)、病毒载体疫苗(根据载体在细胞内是否可复制分为复制型和非复制型)、基于核酸的疫苗(DNA疫苗和RNA疫苗)、基于蛋白的疫苗[重组蛋白疫苗、蛋白亚单位疫苗和病毒样颗粒(virus-like particle,VLP)疫苗]。WHO目前公布的进入临床试验的66项疫苗项目中,有10种为灭活病毒疫苗[3]。灭活病毒疫苗制备技术发展成熟,但灭活过程可使抗原蛋白发生结构变化,相对降低抗原的特异性。病毒载体疫苗利用载体携带疫苗靶点基因进入人体细胞。其中非复制型的腺病毒载体疫苗研发平台较为成熟。但是,由于腺病毒实为呼吸道感染的常见病毒,在部分人群中存在较高的血清抗体阳性率,即预存免疫。预存免疫可显著降低携带疫苗靶点基因的腺病毒载体的转导效率和在人体内的表达水平,从而降低针对目标病毒靶点的免疫反应。新冠疫苗设计中通过使用稀有血清型腺病毒载体[3]、非人灵长类动物腺病毒载体[6]来避免上述的预存免疫。核酸疫苗中核酸序列便于编辑,研发和制备周期短、成本低。同时,产生免疫应答快,无外源性病毒感染风险。但是,其在人体抗感染免疫中的保护效力和安全性还有待进一步研究。基于蛋白的疫苗成分明确、不含有遗传物质,安全性好。但是这类疫苗可能需要佐剂及多次接种的方案来确保起效。VLP疫苗利用空的病毒壳模仿冠状病毒的结构,其所诱导的免疫反应强烈,但制备复杂。
疫苗的效应评价主要基于对疫苗免疫原性的检测,可分为体液免疫、细胞免疫两方面。体液免疫主要评价疫苗靶点的特异性结合抗体滴度和中和抗体滴度。不同疫苗中和抗体滴度的测定由不同测试完成。其中,活病毒中和测试需要在P3实验室进行,因此部分项目应用假病毒中和测试代替。细胞免疫方面,特异性T细胞免疫反应可以通过检测T细胞数量或借助γ-干扰素酶联免疫斑点试验(IFNγ-ELISpot)测定IFNγ水平,间接检测辅助性T细胞活性。目前不同疫苗项目应用不同的技术平台测定疫苗接种后受试者体内的特异性免疫水平,且统计方法不同,因此不同疫苗诱导的抗体几何平均滴度(geometric mean titer,GMT)等数据无法直接比较疫苗优劣。以康复者血清中中和抗体滴度作为参照或可统一标准。而最终的疗效评价则必须建立在疫苗对群体的保护效力之上。但新冠疫苗所诱导的免疫水平是否能直接反映其保护效力尚有待明确[7]。
截至2021年2月12日,处于临床试验阶段的候选新冠疫苗达66种,此外还有176种候选疫苗处于临床前评估阶段。目前正式发表Ⅰ/Ⅱ期及之后临床试验结果的项目有以下10种(表1,2)。包括4种腺病毒载体疫苗:Ad5载体COVID-19、ChAdOx1 nCoV-19、Gam-COVID-Vac、Ad26.COV2.S,3种灭活疫苗:SARS-CoV-2灭活疫苗、CoronaVac、BBIBP-CorV,2种核酸疫苗:mRNA-1273、BNT162b2,1种蛋白亚单位疫苗:NVX-CoV2373。另有3种疫苗[17, 18, 19]通过medRxiv预发表Ⅰ/Ⅱ期或Ⅱ期临床试验结果。其中4种Ⅲ期结果(表3),mRNA-1273、BNT162b2、Ad26.COV2.S获得FDA紧急授权批准使用,国家药品监督管理局附条件批准SARS-CoV-2灭活疫苗、CoronaVac注册申请。

截至2021年2月12日已报道Ⅰ/Ⅱ、Ⅱ、Ⅲ期临床试验结果的新冠疫苗
截至2021年2月12日已报道Ⅰ/Ⅱ、Ⅱ、Ⅲ期临床试验结果的新冠疫苗
| 疫苗名称 | 研发团队 | 技术路线 | 抗原基础 | 研究阶段 |
|---|---|---|---|---|
| ChAdOx1 nCoV-19[6] | 牛津大学/阿斯利康公司 | 腺病毒载体疫苗 | 黑猩猩腺病毒载体ChAdOx1-S蛋白 | Ⅲ |
| Ad5载体COVID-19[8] | 康希诺生物股份公司/北京生物技术研究所 | 腺病毒载体疫苗 | 腺病毒载体Ad5-S蛋白 | Ⅲ |
| Gam-COVID-Vac[9] | 俄罗斯加马利亚研究所 | 腺病毒载体疫苗 | 腺病毒载体Ad26和Ad5-S蛋白 | Ⅲ |
| SARS-CoV-2灭活疫苗[10] | 武汉生物制品研究所/中国医药集团 | 灭活病毒疫苗 | 全病毒+氢氧化铝佐剂 | Ⅲ |
| CoronaVac[11] | 北京科兴生物制品有限公司 | 灭活病毒疫苗 | 全病毒+氢氧化铝佐剂 | Ⅲ |
| mRNA-1273[12] | 美国莫德纳公司/美国国家过敏和传染病研究所 | mRNA疫苗 (脂质纳米颗粒) | 经2个脯氨酸突变的S蛋白(S-2P) | Ⅲ |
| BNT162b2[13] | 德国BioNTech公司/辉瑞公司/中国复星医药 | mRNA疫苗 (脂质纳米颗粒) | 经2个脯氨酸突变的S蛋白(S-2P) | Ⅲ |
| NVX-CoV2373[14] | 美国诺瓦瓦克斯医药公司 | 蛋白亚单位疫苗 | 重组S蛋白 | Ⅲ |
| BBIBP-CorV[15] | 北京生物制品研究所/中国医药集团 | 灭活病毒疫苗 | 全病毒+氢氧化铝佐剂 | Ⅲ |
| Ad26.COV2.S[16] | 美国强生公司 | 腺病毒载体疫苗 | 腺病毒载体Ad26-S蛋白 | Ⅲ |
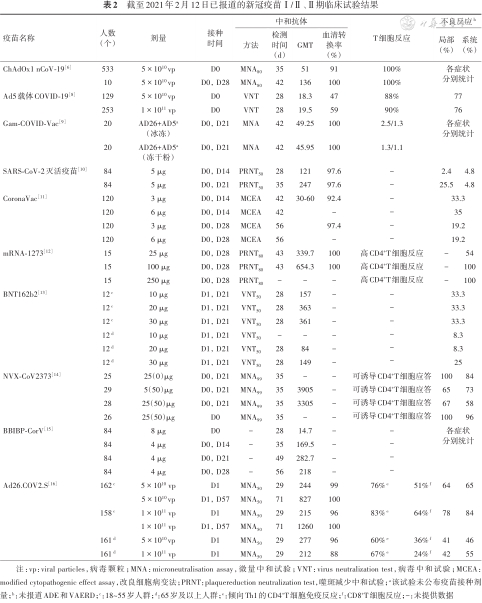
截至2021年2月12日已报道的新冠疫苗Ⅰ/Ⅱ、Ⅱ期临床试验结果
截至2021年2月12日已报道的新冠疫苗Ⅰ/Ⅱ、Ⅱ期临床试验结果
| 疫苗名称 | 人数 (个) | 剂量 | 接种 时间 | 中和抗体 | T细胞反应 | 不良反应b | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 方法 | 检测 时间(d) | GMT | 血清转换率(%) | 局部(%) | 系统 (%) | ||||||
| ChAdOx1 nCoV-19[6] | 533 | 5 × 1010 vp | D0 | MNA80 | 35 | 51 | 91 | 100% | 各症状 分别统计 | ||
| 10 | 5 × 1010 vp | D0, D28 | MNA80 | 42 | 136 | 100 | 100% | ||||
| Ad5载体COVID-19[8] | 129 | 5 × 1010 vp | D0 | VNT | 28 | 18.3 | 47 | 88% | 77 | ||
| 253 | 1 × 1011 vp | D0 | VNT | 28 | 19.5 | 59 | 90% | 76 | |||
| Gam-COVID-Vac[9] | 20 | AD26+AD5a(冰冻) | D0, D21 | MNA | 42 | 49.25 | 100 | 2.5/1.3 | 各症状 分别统计 | ||
| 20 | AD26+AD5a(冻干粉) | D0, D21 | MNA | 42 | 45.95 | 100 | 1.3/1.1 | ||||
| SARS-CoV-2灭活疫苗[10] | 84 | 5 μg | D0, D14 | PRNT50 | 28 | 121 | 97.6 | - - | 2.4 | 4.8 | |
| 84 | 5 μg | D0, D21 | PRNT50 | 35 | 247 | 97.6 | 25.5 | 4.8 | |||
| CoronaVac[11] | 120 | 3 μg | D0, D14 | MCEA | 42 | 30-60 | 92.4 | - - - - | 33.3 | ||
| 120 | 6 μg | D0, D14 | MCEA | 42 | - | 35 | |||||
| 120 | 3 μg | D0, D28 | MCEA | 56 | 97.4 | 19.2 | |||||
| 120 | 6 μg | D0, D28 | MCEA | 56 | - | 19.2 | |||||
| mRNA-1273[12] | 15 | 25 μg | D0, D28 | PRNT80 | 43 | 339.7 | 100 | 高CD4+T细胞反应 高CD4+T细胞反应 高CD4+T细胞反应 | - | 54 | |
| 15 | 100 μg | D0, D28 | PRNT80 | 43 | 654.3 | 100 | - | 100 | |||
| 15 | 250 μg | D0, D28 | PRNT80 | - | - | - | - | 100 | |||
| BNT162b2[13] | 12c | 10 μg | D1, D21 | VNT50 | 28 | 157 | - | - - - - - - | 33.3 | ||
| 12c | 20 μg | D1, D21 | VNT50 | 28 | 363 | - | 33.3 | ||||
| 12c | 30 μg | D1, D21 | VNT50 | 28 | 361 | - | 33.3 | ||||
| 12d | 10 μg | D1, D21 | VNT50 | - | - | - | 8.3 | ||||
| 12d | 20 μg | D1, D21 | VNT50 | 28 | 84 | - | 8.3 | ||||
| 12d | 30 μg | D1, D21 | VNT50 | 28 | 149 | - | 25 | ||||
| NVX-CoV2373[14] | 25 | 25(0)μg | D0, D21 | MNA99 | 35 | - | - | 可诱导CD4+T细胞应答 可诱导CD4+T细胞应答 可诱导CD4+T细胞应答 可诱导CD4+T细胞应答 | 100 | 84 | |
| 29 | 5(50)μg | D0, D21 | MNA99 | 35 | 3905 | - | 65 | 73 | |||
| 28 | 25(50)μg | D0, D21 | MNA99 | 35 | 3305 | - | 67 | 58 | |||
| 26 | 25(50)μg | D0 | MNA99 | 35 | - | - | 100 | 96 | |||
| BBIBP-CorV[15] | 84 | 8 μg | D0 | - | 28 | 14.7 | - | - - - - | 各症状 分别统计 | ||
| 84 | 4 μg | D0, D14 | - | 35 | 169.5 | - | |||||
| 84 | 4 μg | D0, D21 | - | 49 | 282.7 | - | |||||
| 84 | 4 μg | D0, D28 | - | 56 | 218 | - | |||||
| Ad26.COV2.S[16] | 162c | 5 × 1010 vp | D1 | MNA50 | 29 | 244 | 99 | 76%e | 51%f | 64 | 65 |
| 5 × 1010 vp | D1, D57 | MNA50 | 71 | 827 | 100 | ||||||
| 158c | 1 × 1011 vp | D1 | MNA50 | 29 | 215 | 96 | 83%e | 64%f | 78 | 84 | |
| 1 × 1011 vp | D1, D57 | MNA50 | 71 | 1260 | 100 | ||||||
| 161d | 5 × 1010 vp | D1 | MNA50 | 29 | 277 | 96 | 60%e | 36%f | 41 | 46 | |
| 161d | 1 × 1011 vp | D1 | MNA50 | 29 | 212 | 88 | 67%e | 24%f | 42 | 55 | |
注:vp:viral particles,病毒颗粒;MNA:microneutralisation assay,微量中和试验;VNT:virus neutralization test,病毒中和试验;MCEA:modified cytopathogenic effect assay,改良细胞病变法;PRNT:plaquereduction neutralization test,噬斑减少中和试验;a该试验未公布疫苗接种剂量;b:未报道ADE和VAERD;c:18~55岁人群;d:65岁及以上人群;e:倾向Th1的CD4+T细胞免疫反应;f:CD8+T细胞反应;-:未提供数据
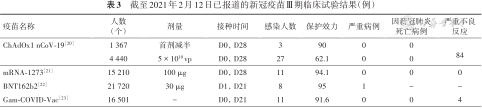
截至2021年2月12日已报道的新冠疫苗Ⅲ期临床试验结果(例)
一种疫苗从设计到问世一般需要几年甚至十数年。但当前疫情要求疫苗研发制备的周期前所未有地缩短。尽管近年来疫苗研发技术飞速发展,但新冠疫苗仍面对风险与挑战。
1.ADE效应和VAERD:在研新冠疫苗的安全性受到了高度关注。除了注射处局部症状和发热、乏力等全身症状这些疫苗的不良反应以外,疫苗接种后反使疾病加重的情况也需关注。这类情况包括抗体依赖性增强(antibody-dependent enhancement,ADE)效应和疫苗增强性呼吸道疾病(vaccine-associated enhanced respiratory disease,VAERD)[24]。ADE效应是指自然感染或者疫苗接种获得的抗体与病毒结合后,不仅未能中和病毒,反而增强病毒的感染能力。该效应由抗体Fc段介导,机制是病毒-抗体复合物对表达抗体Fc受体(FcR)的细胞的结合能力增强,促进病毒入细胞,最终加剧感染[24]。VAERD最初发现于RSV疫苗的临床试验中[25, 26]。VAERD产生主要有两个原因,一是当抗体仅结合但未能成功中和病毒时,免疫复合物沉积和补体激活;二是免疫过程导致的过敏性炎症,即Th2细胞免疫反应。新冠疫苗是否会诱发ADE效应或VAERD不清楚。但这些情况将为COVID-19及COVID-19防治产生的不良反应之间的鉴别带来困难。理论上,ADE效应因其本质仍为病毒感染,因此临床表现与COVID-19相同,影像学可表现为双肺多发、胸膜下或沿支气管血管束分布的磨玻璃、实变影[27]。VAERD本质为炎性反应导致气道高反应、小气道堵塞等[24]。临床和影像学表现也为相应改变。
2. 重复感染带来的有关疫苗保护效力的担忧:全球报道的“重复感染”病例引发了广泛关注。根据文献报道,中国香港[28]、美国内华达州[29]、法国[30]等地的病例研究分别比对患者前后两次患病的病毒序列,结果显示患者的两次患病源于不同毒株,证实为重复感染,而非感染复发。而推测重复感染的原因是初发感染后这些患者体内产生的抗体水平不高,或是原有抗体未能成功中和新暴露的突变株。这些重复感染病例提示我们,新冠疫苗是否能提供针对COVID-19的终生保护或对不同病毒株的预防,仍需进一步研究。
3.全球化合作的意义:COVID-19疫情是对全人类的挑战,制备成功的疫苗也是全人类的福祉。然而,分散、条块、封闭的研究造成了相关公共信息的极度有限,比如,目前不清楚各个疫苗研发项目所设计的疫苗靶点是否来自于S蛋白不同形式和(或)变体,或是与疾病的基因组流行病学相关。这势必会造成全球人力、物力、财力的浪费以及时间的空耗。另外,疫苗的研发和大批量制备的技术难度和经济成本极高,只有少数新冠疫苗项目能够成功。所以,如何整合全球范围内的疫苗资源分配[8]、协调供需之间的矛盾、加强不同研究机构的沟通,既是全人类所面临的挑战,又是疫苗成功研发、疫情全面控制的必备条件。
目前多个候选疫苗研发进入临床、临床前试验阶段,已有10个项目公布Ⅰ/Ⅱ期临床试验数据。这些候选疫苗的安全性和保护效力尚待Ⅲ期临床研究结果进一步评估。当前新冠疫苗的研发和制备仍面临着诸多风险,也为临床诊治带来诊治挑战,应扩大全球合作进一步推动疫苗研发、疫情控制。
所有作者均声明不存在利益冲突



























