
肺普通裂褶菌感染为临床少见疾病,主要表现为变应性支气管肺真菌病和支气管黏液栓,因普通裂褶菌也为丝状真菌,且也可出现血清烟曲霉IgG和(或)烟曲霉IgE增高,极易误诊为变应性支气管肺曲霉病(ABPA)和慢性肺曲霉病(CPA),需引起临床重视。本文报道2例肺普通裂褶菌感染致支气管黏液栓,2例患者均出现血清烟曲霉IgG增高,1例出现烟曲霉IgE增高,BALF真菌培养出白色绒毛状菌落,送检ITS区域 DNA测序鉴定为普通裂褶菌,给予伏立康唑治疗后肺内病灶均基本完全吸收。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
例1 患者男,73岁,因“体检发现肺结节1个月,左下胸痛1 d”于2018年11月入院。1个月前患者体检时查胸部CT提示左肺下叶前内基底段结节,无发热,无咳嗽咳痰,无胸闷气促,无胸痛等不适,遂至当地医院就诊,予“阿莫西林克拉维酸联合阿奇霉素”抗感染治疗2周,复查胸部CT提示病灶无变化,行经皮肺穿刺活检病理提示支气管黏膜及少量肺组织,见肺组织纤维化伴较多淋巴细胞及组织细胞浸润。肺穿刺活检组织感染病原学宏基因组测序(metagenomic next-generation sequencing,mNGS)检测到铜绿假单胞菌,检出序列数7,当时未行相关抗铜绿假单胞菌治疗。1 d前出现左下胸痛,深呼吸及咳嗽时加重,于当地医院复查胸部CT示左肺下叶片状高密度影,较前增大,左侧少量胸腔积液(图1,2),遂来我院就诊,以“肺占位性质待查”入院。患者既往无支气管哮喘病史,有长期种植花草史30余年(卧室阳台及院中均种植花草)。入院体检:生命体征平稳,双肺呼吸音粗,未闻及干湿性啰音,心腹及神经系统未见异常,双下肢无水肿。入院查血常规及C反应蛋白示白细胞计数8.2×109/L,嗜酸粒细胞计数0.28×109/L,中性粒细胞百分比84.8%,C反应蛋白8.5 mg/L,肿瘤标志物CA-125为105.3 U/ml(正常参考值<35.0 U/ml),余肿瘤标志物未见异常。总IgE为180 U/ml(正常参考值<165 U/ml),类风湿因子、补体C3及补体 C4、免疫球蛋白、抗核抗体、血管炎均阴性。多次痰涂片抗酸染色阴性,支气管肺泡灌洗液(BALF)涂片抗酸染色阴性,BALF结核分枝杆菌核酸和利福平耐药突变(Xpert MTB/RIF)阴性。血清及BALF隐球菌荚膜多糖抗原阴性,血清1,3-β-D葡聚糖(G试验)50 ng/L(正常参考值<70 ng/L),BALF半乳糖甘露醇聚糖抗原(GM试验)为0.07 μg/L,血清烟曲霉IgG为440 AU/ml(正常参考值<120 AU/ml),血清烟曲霉IgE<0.1 U/ml(正常参考值<0.35 U/ml),支气管镜检查见左下叶内前基底段(B7+8)黏膜充血水肿,开口见痰黏液栓(图3)。经支气管镜肺活检病理示纤维化组织内见急慢性炎症细胞浸润,局灶肺泡上皮细胞轻度不典型增生。BALF真菌涂片及真菌荧光染色涂片见丝状真菌菌丝(图4),BALF培养生长出多个白色绒毛状菌落(图5),菌落压片后菌丝可见锁状结构和针状结构(图6),外送内转录间隔区(internal transcribed spacer,ITS)区域DNA测序显示,ITS基因扩增可见单一清晰目的条带,测序结果经BLAST(basic local alignment search tool)对比显示与普通裂褶菌序列相似度为100%,诊断为肺普通裂褶菌感染。给予伏立康唑(200 mg,2次/d)治疗1个月后复查胸部CT示左肺下叶团块影基本吸收(图7,8),总疗程4个月后停药随访,但于2021年7月出现左下新发病灶(B9亚段),BALF真菌涂片及培养再次证实肺普通裂褶菌感染,使用伏立康唑(200 mg,2次/d)治疗2个月余后自行停药,复查胸部CT示病灶较前吸收,目前情况良好,无不适。
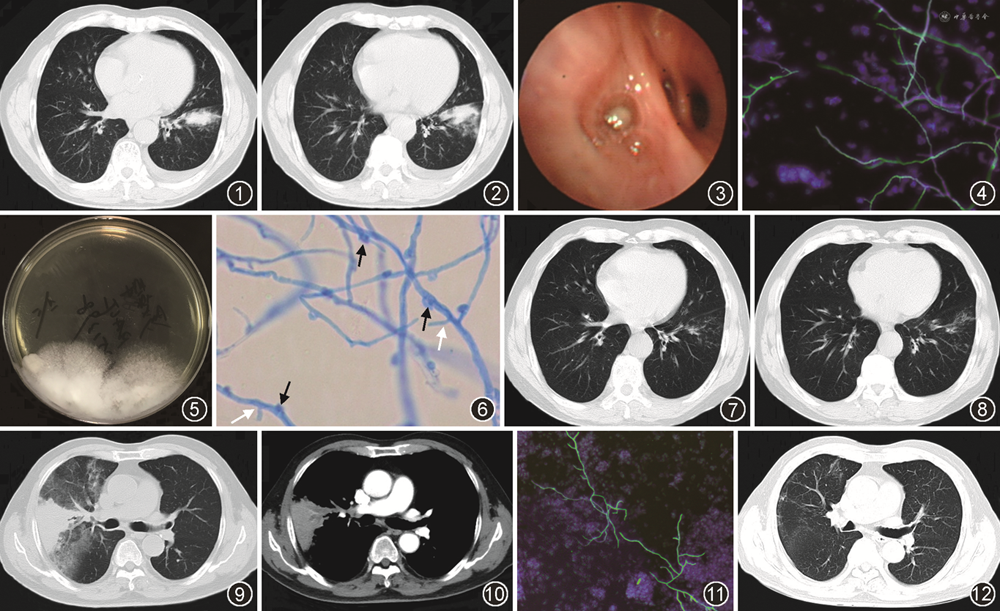

例2 患者男,83岁,因“咳嗽、咳痰2个月”于2021年5月入院,患者于2个月前无明显诱因下出现咳嗽咳痰,咳白色黏痰,偶有咳嗽时伴气促,无发热、胸痛等不适,于当地医院查血常规示白细胞8.6×109/L,嗜酸粒细胞数为0.9×109/L及胸部CT示右肺上叶楔形状高密度影伴周围渗出影,双肺上叶纤维化病灶伴局部轻度支气管扩张,予“哌拉西林他唑巴坦联合左氧氟沙星”抗感染治疗10 d,但症状未见缓解,复查胸部CT示右肺上叶病灶较前明显进展,现患者咳嗽咳痰明显,夜间平卧时咳嗽加剧,时感气促不适,以“阻塞性肺炎”收入院。既往有支气管哮喘病史30余年,予布地奈德福莫特罗粉吸入剂(320 μg:9.0 μg)规律治疗,此次未有急性发作,有高血压病病史10余年,血压控制良好。体检:生命体征平稳,双肺呼吸音粗,双肺未闻及干湿性啰音,心腹及神经系统未见异常,双下肢无水肿。入院后查血常规及C反应蛋白示白细胞9.39 × 109/L,嗜酸粒细胞计数0.83× 109/L,中性粒细胞百分比69.7%,C反应蛋白126.6 mg/L,总IgE为5 U/ml,类风湿因子、补体C3及补体C4、免疫球蛋白、抗核抗体、血管炎均阴性。多次痰涂片抗酸染色阴性,BALF涂片抗酸染色阴性,BALF Xpert MTB/RIF阴性。血清及BALF隐球菌荚膜多糖抗原阴性,血清G试验56 ng/L,BALF GM试验0.15 μg/L,血清烟曲霉IgG 208 AU/ml,血清烟曲霉IgE 0.77 U/ml,行胸部增强CT示右肺上叶前段楔形团片状高密度影,周围可见明显渗出影,增强见血管造影征及低密度状分支状影(图9,10)。支气管镜检查见右上叶开口黏膜水肿、稍肥厚,前段支气管开口见黄白色黏稠胶冻样纵行痰栓,右上开口黏膜活检病理示支气管黏膜慢性炎,局部见炎性渗出物及少许真菌菌丝,特殊染色六胺银(+),真菌D-PAS(+),BALF真菌荧光染色涂片见丝状真菌菌丝(图11),外送ITS区域DNA测序显示ITS基因扩增可见单一清晰目的条带,测序结果经BLAST对比显示与普通裂褶菌序列相似度最高,为99.79%,诊断为肺普通裂褶菌感染,给予伏立康唑(200 mg,2次/d)治疗2个月余后于当地医院复查胸部CT示右肺上叶不张及周围渗出影基本吸收,留少许纤维条索影(图12)。继续治疗2个月(总疗程4个月)后停药随访,目前情况良好,无相关呼吸系统症状。
普通裂褶菌是一种自然界中普遍存在的担子菌类真菌,通常寄生于枯萎、腐烂的有机物中,特别是腐烂的树木[1]。由于普通裂褶菌的致病性弱,所以临床上由普通裂褶菌感染引起的肺真菌病的病例少见。普通裂褶菌担子孢子广泛分布在空气中,经口鼻吸入,鼻窦部和支气管肺部是最常见的感染部位[2]。肺普通裂褶菌感染最常引起变应性支气管肺真菌病(allergic bronchopulmonary mycosis,ABPM)[3, 4, 5, 6, 7]和支气管黏液栓(mucoid impaction of the bronchi,MIB)[8, 9, 10],MIB通常与ABPM相关,并且MIB和普通裂褶菌致ABPM之间存在临床重叠,有研究发现21例普通裂褶菌致ABPM患者中有16例存在MIB[11],且较变应性支气管肺曲霉病(allergic bronchopulmonary aspergillosis,ABPA)更容易出现MIB[11]。目前ABPM无特定诊断标准,多根据ABPA诊断衍生,即存在对特定真菌的致敏,出现类ABPA样症状[12],本文诊断2例病例经支气管镜检查证实均存在MIB,2例患者中有1例存在支气管哮喘病史,但未引起支气管哮喘急性发作或使支气管哮喘难以控制,2例患者中有1例出现血嗜酸粒细胞增高,2例血清总IgE均<1 000 U/ml,根据我国2017年ABPA诊治专家共识[13]及2013年国际人类和动物真菌学会(ISHAM)提出ABPA新的诊断标准[12],2例患者诊断ABPM依据均不足。本文2例患者均出现血清烟曲霉IgG升高,1例出现血清烟曲霉IgE升高,极易误诊为ABPA或慢性肺曲霉病(chronic pulmonary aspergillosis,CPA)。一些病例报道中也发现普通裂褶菌致ABPM出现血清烟曲霉IgG和(或)血清烟曲霉IgE升高[6,14, 15],这可能与烟曲霉和普通裂褶菌致敏原之间存在抗原交叉反应有关[16],研究发现通过使用普通裂褶菌致ABPM患者的血清,提取并鉴定Sch c1(一种来自普通裂褶菌的糖化酶)为普通裂褶菌的主要致敏原,该抗原与烟曲霉存在约50%的同源性[17],这可以解释部分肺普通裂褶菌感染患者出现血清烟曲霉抗体升高的原因。因普通裂褶菌致ABPM与ABPA的血清学鉴别存在一定的重叠,易导致该病被误诊。
肺普通裂褶菌感染因发病率低且临床及微生物医师对其缺乏认识,致使诊断困难,因普通裂褶菌在组织内表现为菌丝型,其菌丝粗细与曲霉菌丝相近,有时与曲霉菌丝不易鉴别,易误诊为曲霉感染。普通裂褶菌在沙保弱培养基(SDA)可长出绒毛状白色菌落[3, 4,8, 9,18],菌落压片在光镜下可见锐角分支状分隔菌丝,菌丝粗细不一,二倍体菌株可见菌丝上的锁状结构和侧边针状结构,是普通裂褶菌在光镜下特征性结构改变[3, 4,18, 19]。而曲霉菌落也呈绒毛状或棉絮状,但颜色多样,有烟绿色、黄色、黄绿色、黑色等,其菌丝粗细均匀有分隔,分支呈锐角,顶端常发展成束,呈放射状排列[20]。本病大多通过痰或BALF培养出普通裂褶菌而明确诊断,还可通过ITS区域DNA测序或mNGS明确普通裂褶菌的诊断,研究发现裂褶菌核糖体ITS区域序列高度保真,通过ITS区域DNA测序是鉴定裂褶菌最准确的方法[18, 19]。本文2例均通过ITS区域DNA测序明确诊断,第1例患者组织mNGS未检出裂褶菌属与送检公司基因库中未包含裂褶菌的真菌序列有关。
普通裂褶菌致ABPM或MIB的治疗主要包括抗真菌治疗和糖皮质激素治疗。抗真菌药物多数使用伊曲康唑、伏立康唑、氟康唑和两性霉素B[3, 4, 5, 6, 7, 8,14, 15,21],2021年欧洲医学真菌学会(ECMM)、国际人类和动物真菌学会(ISHAM)和美国微生物学会(ASM)联合发布了少见真菌感染诊断和管理全球指南,建议普通裂褶菌感染一线使用两性霉素B脂质体后降阶使用泊沙康唑,二线使用伏立康唑[22],但根据目前文献报道,伏立康唑对普通裂褶菌致ABPM或MIB均有较好的疗效,且可作为伊曲康唑无效的补救治疗[6,23]。本文报道2例患者经伏立康唑治疗后病灶均基本完全吸收,治疗效果好。该病抗真菌疗程不确定,一般为3~4个月,也有长达2年未见吸收,因此疗程多需个体化[6]。是否需要联合使用全身或局部糖皮质激素目前尚无指南推荐,从病例报道治疗来看,如有明显致敏反应,如诱发支气管哮喘急性发作、胸闷气促加重、血嗜酸粒细胞及总IgE明显增高,建议加用糖皮质激素治疗,但不建议单纯使用糖皮质激素治疗,这与ABPA全身使用糖皮质激素是基础性用药有所不同[13]。
肺普通裂褶菌感染为临床少见疾病,主要表现为ABPM和MIB,因普通裂褶菌也为丝状真菌,且也可出现烟曲霉IgG和(或)烟曲霉IgE增高,极易误诊为ABPA和CPA,需引起临床重视。因此在临床中遇到局限性MIB,痰或BALF找到丝状真菌,需警惕普通裂褶菌感染可能,如痰或BALF培养出绒毛状白色菌落,光镜下见菌丝上的锁状结构和侧边针状结构,可明确该病诊断,如微生物医师未能认识该菌,可进一步送检ITS区域DNA测序明确。
所有作者声明无利益冲突



























