
生物可吸收支架被吸收后冠状动脉正常收缩性可恢复,有利于血管的正性重构,可在同一病变处多次介入干预,不会产生支架重叠带来的问题,可避免金属支架长期冠状动脉内存留影响冠状动脉血管旁路移植术的实施。该文报道左前降支近段重度狭窄患者置入生物可吸收支架术后3年影像学随访1例,显示了可吸收支架良好的安全性及可行性,有助于了解国产可吸收支架置入后支架降解吸收过程,为临床应用提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,47岁,因"阵发性胸痛半年,加重1周",于2015年5月8日入院。患者有高血压病史10年,最高血压达180/110 mmHg(1 mmHg=0.133 kPa),间断口服"替米沙坦片和左旋氨氯地平片"等药物,血压控制尚可。患者无糖尿病、脑血管病及冠心病家族史,无吸烟和饮酒史。入院后体格检查:体温36.2 ℃,脉搏70次/min,呼吸19次/min,血压171/108 mmHg;双肺呼吸音清,无干湿性啰音;各瓣膜听诊区未闻及杂音;腹软,无压痛。入院心电图示窦性心律,大致正常心电图。肌酸激酶(CK)177 U/L(参考值24~194 U/L);肌酸激酶同工酶(CK-MB)13 U/L(参考值0~25 U/L);心肌肌钙蛋白(cTN)T 0.003 μg/L(参考值<0.1 μg/L)。患者诊断为不稳定性心绞痛和高血压病(3级)。
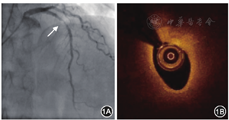
2015年5月11日行冠状动脉造影检查,结果显示:左主干正常;左前降支近段狭窄程度为95%,中远段狭窄程度为30%,血流心肌梗死溶栓试验(thrombolysis in myocardial infarction,TIMI)分级为2~3级;左回旋支远段狭窄程度为70%;右冠状动脉近远段狭窄程度为20%~30%,血流TIMI分级为3级(图1A)。因左前降支近段病变严重,先行球囊预扩张,然后行光学相干断层成像(optical coherence tomography,OCT)检查。OCT结果示最小管腔面积为2.57 mm2,斑块负荷为85.3%(图1B)。以非顺应性高压球囊再次预扩张后,经导丝推送3.5 mm×24 mm NeoVas生物可吸收支架[乐普(北京)医疗器械公司]至左前降支近段病变处,以12 atm(1 atm=101.325 kPa)释放支架。以非顺应性高压球囊后扩张进行支架内整形后,再次行冠状动脉造影和OCT检查(图2)。OCT检查结果示支架扩张满意,贴壁良好,平均管腔面积为7.15 mm2,最小管腔面积为5.85 mm2,斑块负荷为18.6%。术后规律口服阿司匹林肠溶片100 mg(每天1次),替格瑞洛片90 mg(每天2次),阿托伐他汀钙片20 mg(每晚1次)。

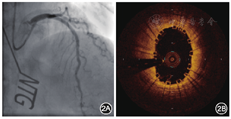

2016年4月27日行冠状动脉造影检查,结果显示:左主干正常;左前降支近段支架通畅,无再狭窄,中远段狭窄程度为30%;左回旋支远段狭窄程度为70%;右冠状动脉近远段狭窄程度为20%~30%(图3A)。OCT检查结果示左前降支近段支架内膜覆盖良好,平均管腔面积为5.78 mm2,最小管腔面积为4.86 mm2,斑块负荷为30.6%,新生内膜面积为2.84 mm2(图3B)。术后口服阿司匹林肠溶片100 mg(每天1次),替格瑞洛片90 mg(每天2次,至2016年5月11日),阿托伐他汀钙片20 mg(每晚1次)。
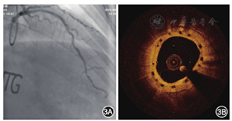

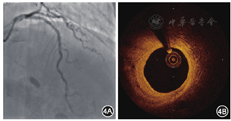
2018年4月13日行冠状动脉造影检查,结果显示:左主干正常;左前降支近段支架内无再狭窄,中远段狭窄程度为40%;左回旋支远段狭窄程度为70%;右冠状动脉近远段狭窄程度为20%~30%;血流TIMI分级均为3级。OCT检查结果示左前降支原支架无再狭窄,内膜覆盖完全,96.3%降解吸收,平均管腔面积为6.50 mm2,最小管腔面积为5.11 mm2,斑块负荷为34.8%,新生内膜面积为2.78 mm2(图4)。术后口服阿司匹林肠溶片100 mg(每天1次),瑞舒伐他汀钙片10 mg(每晚1次)。

20世纪90年代,Stack等[1]首次提出以聚左旋乳酸(PLLA)为材料制备自身可吸收支架,用以抵抗单纯球囊扩张后管腔再狭窄,但由于早期还没有理想的聚合体抑制炎症反应和再狭窄发生,限制了生物可吸收支架的研究与发展。生物可吸收支架是经皮冠状动脉腔内成形术、裸金属支架和药物洗脱支架之后,经皮冠状动脉治疗的第4次革命[2]。近年来,生物可吸收支架逐渐进入研究者的视线。生物可吸收支架在短期内提供血管所需的支撑力,然后逐渐代谢分解,消除对血管的影响。与金属支架相比,生物可吸收支架有以下优点[3]:(1)避免金属支架长期冠状动脉内存留影响冠状动脉旁路移植术的实施;(2)支架被吸收后可恢复血管正常收缩性,有利于血管的正性重构;(3)可在同一病变处多次介入干预,不会产生支架重叠带来的问题;(4)消除了过多支架置入导致的冠状动脉"金属化"。
ABSORB系列研究(包括随后的ABSORB Ⅱ、ABSORB Ⅲ、ABSORB China和ABSORB Japan研究)为验证可吸收支架的有效性和安全性积累了丰富的研究数据[4,5]。ABSORB Ⅲ研究纳入193个中心2 008例冠心病患者,用更大样本进一步验证了生物可吸收支架的有效性。结果显示,与XIENCE支架相比,生物可吸收支架术后1年靶病变失败率具有非劣效性,两组心原性死亡、靶血管心肌梗死和缺血驱动的靶病变血运重建差异均无统计学意义。支架内血栓发生率生物可吸收支架组稍高,但是两组间差异无统计学意义[5]。随后对4项ABSORB试验术后1年数据的荟萃分析结果显示[6],Absorb生物可吸收支架与Xience钴铬依维莫司洗脱支架术后1年患者水平的复合终点(包括全因死亡、所有心肌梗死及任何再次血运重建)差异无统计学意义,器械水平的复合终点(包括心原性死亡、靶血管心肌梗死及缺血驱动的靶病变血运重建)以及单个指标全因死亡、所有心肌梗死和缺血驱动的靶病变血运重建发生率差异均无统计学意义。研究结果提示,在简单至中等复杂病变中应用生物可吸收支架有良好的有效性及安全性。但是,2017年美国心脏病学会(ACC)公布的ABSORB试验结果显示,生物可吸收支架组术后2年确定的/可能的支架血栓发生率为1.9%,而依维莫司洗脱支架组为0.8%。术后1~2年支架内血栓形成率为0.3%,迫使国外多家器械公司叫停其临床应用。
本例患者置入生物可吸收支架前,对靶血管进行了充分的预扩张,保证释放支架成功。释放支架后用后扩张球囊进行整形,以保证支架完全贴壁。OCT检查示平均管腔面积为7.15 mm2,最小管腔面积为5.85 mm2,斑块负荷为18.6%。术后1年复查OCT,平均管腔面积为5.78 mm2,最小管腔面积为4.86 mm2,斑块负荷为30.6%,新生内膜面积为2.84 mm2。术后3年复查OCT,平均管腔面积为6.50 mm2,最小管腔面积为5.11 mm2,斑块负荷为34.8%,新生内膜面积为2.78 mm2。结果显示,可吸收支架术后3年吸收率为96.3%,管腔增大。
虽然本病例显示生物可吸收支架有良好的安全性及可行性,但是既往研究提出生物可吸收支架存在一些不足:(1)容易损伤分支血管。Muramatsu等[7]的研究表明,置入生物可吸收支架后分支血管闭塞率为6.0%,高于Xience V支架4.1%的分支闭塞率(P=0.09);多因素logistic回归分析表明,生物可吸收支架是引起术后分支闭塞的独立预测因子(OR=2.09,95%CI 1.18~3.68)。(2)生物可吸收支架在分叉病变中的应用受到限制。Džavík和Colombo[8]以生物可吸收支架在离体血管模型上采用不同术式处理分叉病变后,推荐Absorb BVS支架用于必要支架技术,但对Absorb BVS支架进行球囊对吻扩张还需慎重。对于需要置入双支架的分叉病变,不论采用Crush技术还是Culotte技术,除非主支管腔直径足够大,方可考虑主支及分支血管均置入药物洗脱支架;否则的话,建议主支血管置入Absorb BVS支架,分支血管置入药物洗脱支架。(3)目前Absorb BVS支架的规格仅有2.5 mm×18 mm、2.5 mm×28 mm、3.0 mm×18 mm和3.0 mm×28 mm 4种,这就使根据病变选择Absorb BVS支架受到限制。
生物可吸收支架在中国尽管刚刚起步,但这一技术将开创介入心脏病学的新纪元。目前尚需积累更多国人应用生物可吸收支架的经验,并验证其安全性和有效性。
所有作者均声明不存在利益冲突



























