
口服抗凝药包括维生素K拮抗剂和非维生素K拮抗口服抗凝药(NOAC)。国际标准化比值是监测华法林的常规实验,用于评估治疗的安全性和有效性,药物代谢基因检查需结合患者个体特征和用药情况综合分析。NOAC不需常规实验监测,在特殊或紧急临床情况下,利伐沙班、阿哌沙班、艾多沙班可使用凝血酶原时间或抗活化因子Ⅹ活性试验监测,达比加群酯可使用活化的部分凝血活酶时间、凝血酶时间、稀释凝血酶时间和蝰蛇毒凝血时间监测。廉价便捷的监测方法能为医生实施安全有效的药物调整、避免药物相关的不良事件提供可靠依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
口服抗凝药主要有两大类,即维生素K拮抗剂(vitamin K antagonists,VKA)和非维生素K拮抗剂口服抗凝药(non-vitamin K antagonist oral anticoagulants,NOAC),前者是以华法林为代表的传统抗凝药物,后者包括直接Ⅹa因子抑制剂和Ⅱa抑制剂。两类药物在作用机制、药物代谢、影响因素以及安全性等方面各具特征,临床常需进行实验监测以确保治疗的有效性和安全性。
华法林能通过阻止凝血因子前体物质γ-羧基化降低血中Ⅱ、Ⅶ、Ⅸ和Ⅹ因子的水平,被广泛用于静、动脉血栓和心腔内血栓的预防和治疗。华法林的治疗窗窄,在不同个体间的量-效关系差异很大,遗传和环境因素均会影响其吸收和代谢,因此需进行常规监测。
凝血酶原时间(prothrombin time,PT)是监测华法林的常规指标,能快速反映治疗后因子Ⅱ、Ⅶ和Ⅹ水平的减低,但由于不同类型PT检测试剂对凝血因子减低敏感性不一,使检测结果变异性较大。1983年,世界卫生组织(WHO)开始推广国际标准化比值(international normalized ratio,INR),并以国际敏感指数(international sensitivity index,ISI)标记检测试剂的敏感度,其计算公式为INR=(患者PT/对照平均PT)ISI。虽然INR使检测结果具有可比性,但由于不同实验室校准INR的能力有差异,因此仍建议在对患者做连续监测时尽可能采用源于同一检测系统的数据。
在华法林治疗的初始阶段,应依据INR调整每天剂量,全过程大约5~7 d。由于凝血因子半衰期不同,给药后降低速率存在差异。口服华法林最初1~2 d,因子Ⅶ水平降低,但对INR影响较弱;随后3~5 d里,因子Ⅱ和Ⅹ的减低对INR影响显著。当INR达到目标值(如2.0~3.0)并维持至少2 d后,平均每周检查1次INR;治疗3~4周后,对于INR稳定的患者,检查间隔可改为4~6周或更久。如INR不稳定,应在调整药物剂量3~7 d后重新监测[1,2]。需注意,一些药物(包括广谱抗生素、抗真菌药、抗抑郁药、抗血小板药物、胺碘酮、非甾体类抗炎药和肾上腺皮质激素替代治疗等)与华法林联合使用时,可在不影响INR的情况下增加出血风险[1]。
近年来出现了INR的即时检测(point-of-care tests,POCT),这种小型设备可在家中和社区诊所检测INR,既方便患者,又节省时间。当INR<2.0时,血栓事件有不对称性增加,当INR>4.5时,出血风险显著增加,需注意,POCT主要适用于华法林治疗的安全性和有效性预警,不能作为药物剂量精细调整的依据[1]。预期未来,严格执行质量控制的监测INR的POCT设备有望成为华法林用药管理的重要补充。
影响华法林抗凝效果的基因主要有细胞色素P450(cytochrome P450)2C9(CYP2C9)、维生素K氧化还原酶C1、CYP4F2和环氧化物水解酶1等。其中,CYP2C9和维生素K氧化还原酶C1基因突变对华法林用药剂量影响更为显著。对于华法林效果不稳定的患者,检测上述基因有助于指导调整华法林剂量和设定INR监测频率[3,4,5]。华法林剂量受CYP2C9基因多态性影响很大,其中CYP2C9*3与中国人群华法林代谢异常相关,可降低华法林代谢速率造成药物蓄积,导致抗凝治疗中患者对华法林需求量降低约30%。此外,辛伐他汀和瑞舒伐他汀可提高华法林的抗凝效应,对CYP2C9*3等位基因携带者尤为明显[3]。维生素K氧化还原酶C1是维生素K循环中的关键酶,能通过影响华法林的代谢清除导致华法林蓄积,与出血风险有关[4]。基因多态性只能解释30%~60%的华法林个体差异,调整药物剂量时还需综合考虑患者的年龄、体重、体表面积、肝肾功能以及合并用药等情况[5]。
NOAC的靶点单一,干扰因素少,药代动力学稳定,通常不需常规监测[6]。近年来,NOAC在复杂临床情况下的安全性问题开始引起关注[7,8,9],但临床对NOAC的监测手段普遍缺乏了解,如哪些患者需要监测[10]、何种方法进行监测以及如何评估等问题日益凸显。
需进行NOAC监测的特殊临床情况包括:严重肾肝损害、药物过量、发生可能致命的大出血、抗凝治疗失败、接受硬膜外间隙阻滞麻醉、紧急手术或有创干预、体重过低或超重、胃肠道吸收不良、同时使用影响NOAC代谢的药物、急性缺血性卒中患者需要溶栓治疗等[11,12,13]。对于上述情况,临床应考虑评估NOAC的抗凝活性或血药浓度变化趋势,指导医生调整治疗方案和药物剂量。
定量检测NOAC血药浓度的参考方法是液相色谱串联质谱,但由于该技术存在步骤繁琐复杂、缺乏标准化等问题,目前仍作为实验室自建项目用于药物研究和方法学验证,不能在临床使用[6,14,15,16]。现阶段,临床上监测NOAC主要采用凝血试验,包括PT、活化的部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶时间(thrombin time,TT)、抗活化因子Ⅹ活性(anti-FⅩa)试验、稀释凝血酶时间(dilute thrombin time,dTT)和蝰蛇毒凝血时间(ecarin clotting time,ECT)等[16,17,18,19,20,21]。
利伐沙班可剂量依赖性抑制血浆中游离Ⅹa因子和凝血酶原复合物中的Ⅹa因子。半衰期为5~13 h(其中高龄人群半衰期较长),血浆蛋白结合率约为92%~95%,在营养充足状态下生物利用度高。利伐沙班口服后2 h血药浓度达到峰值,给药后2~4 h产生最大抑制Ⅹa因子活性的效应。
利伐沙班可使PT和APTT延长,但由于APTT对利伐沙班敏感性较差,临床上主要采用PT进行安全性监测[6,16]。治疗剂量的利伐沙班可延长PT(但不精确),利伐沙班血药浓度为120 μg/L时可使PT延长1.4倍左右[16],290 μg/L时可使PT延长1.9倍[17],出现>2倍延长时提示出血风险,临床在无法获得血药浓度监测手段的情况下,可用PT进行抗凝过度和出血风险的快速初筛[18,19,20]。此外,应使用PT(秒)来监测利伐沙班,INR由于会造成测定结果离散度增加,不适合用于监测[6,14,20]。需注意,不同品牌的PT试剂由于所含组织凝血活酶来源不同,对利伐沙班抗凝活性的敏感性有明显差异,需在使用前进行校准以确保PT监测的有效性和安全性。
采用发色底物法原理的anti-FⅩa对利伐沙班敏感度显著高于PT[21],能准确定量分析利伐沙班血药浓度(检测限>30 μg/L),敏感反映血药峰值和谷值浓度,是评估利伐沙班药代动力学的主要方法[16,19,20],但由于检测精密度的限制,anti-FⅩa可能无法准确定量检测血中<30 μg/L的利伐沙班[22]。在实践中,应注意anti-FⅩa试剂的多样性问题,为确保结果的可靠性,在临床应用前应进行性能验证[16]。
有研究显示,房颤患者每日接受20 mg利伐沙班时,血药峰值和谷值浓度中位值分别为274和30 μg/L,但在临床实践中,患者个体差异、肝肾功能以及合并用药均可影响利伐沙班的代谢过程,一些情况复杂的患者会出现血药浓度大范围波动,进而引发抗凝不足或过度[6,15,16]。因此,anti-FⅩa能帮助医生准确了解利伐沙班是否处于安全和有效的治疗范围,指导药物剂量调整或使用逆转剂[20]。有高度出血风险的患者需进行紧急接受有创治疗时,血中利伐沙班浓度>30 μg/L时应使用逆转剂,对于已发生严重出血的患者,>50 μg/L时就应考虑使用逆转剂[23];对于将要接受溶栓治疗的急性缺血性脑卒中患者,血中利伐沙班浓度<20 μg/L时可接受阿替普酶溶栓治疗,20~100 μg/L之间考虑实施溶栓,>100 μg/L时不宜溶栓[24,25]。此外,外科手术前,anti-FⅩa有助于选择外科手术时机,当测定结果>30 μg/L时,手术前需停药1~3 d(多数患者停用利伐沙班≥3 d时,血药浓度会<30 μg/L),其中中度肾损害或使用抗心律失常药物的患者停药时间相对较长[26,27,28,29]。
阿哌沙班能抑制凝血酶原复合物中的因子Ⅹa、游离因子Ⅹa及与血小板结合的因子Ⅹa,半衰期约为12 h,血浆蛋白结合率为87%,生物利用度为50%,口服后约3~4 h达到血药峰值,约56%通过粪便途径排泄,肾脏清除依赖性低于其他NOAC(25%~29%)。
常规凝血试验对阿哌沙班不敏感[6],血液中含有200 μg/L阿哌沙班时,多数类型的PT仍正常[30]。不同类型PT试剂间对阿哌沙班的敏感性差异也很大,PT延长2倍时,阿哌沙班的血药浓度可处于480 μg/L(相对敏感试剂)至>1 000 μg/L(相对不敏感试剂)范围内[16]。APTT对阿哌沙班的敏感性同样很低,与血药浓度相关性弱[31]。有研究显示,稀释的蝰蛇毒时间(dilute Russell viper venom time,dRVVT)延长也可提示血液中阿哌沙班的存在,但该实验的临床有效性尚待验证[6]。
anti-FⅩa可定量检测阿哌沙班血药浓度,敏感度高,特异性好,试验结果与阿哌沙班治疗范围内血药浓度呈线性相关[30]。有研究报道,阿哌沙班在治疗范围内的试验检测下限为15 μg/L[32],也有研究认为,在低血药浓度(15~50 μg/L)时,抗-FⅩa结果与阿哌沙班浓度间的相关性可能降低[33]。国际血栓和止血学会指南和美国胸科医师学会指南均推荐抗-FⅩa作为阿哌沙班定量检测的首选方法[16,34],阿哌沙班(5 mg,2次/d)预防非瓣膜房颤相关卒中时血药峰值预期浓度预为171(91~321)μg/L,谷值浓度为103(41~230)μg/L;对PE和VTE治疗时的峰值预期浓度为132(59~302)μg/L,谷值浓度为63(22~177)μg/L。
艾多沙班是口服的因子Ⅹa抑制剂,生物利用度为62%,血浆浓度在服药后1~2 h达到峰值,半衰期为10~14 h。肾排泄量约占艾多沙班清除总量的50%,其余代谢部分由胆肠途径排泄。艾多沙班的主要代谢物也具有抗凝血活性,但不足前体药物的10%。
达比加群酯是一种无活性的非肽类前体药物,在口服后通过肠道、肝脏和血液中的非特异性酯酶快速转化为有活性的达比加群,并通过竞争性地与凝血酶活性位点结合,不可逆地抑制游离以及与纤维蛋白结合的凝血酶。患者肾功能正常时,半衰期约为12~14 h,生物利用度较低(3%~7%),给药后1.25~3 h达到血药峰值浓度。
蝰蛇毒凝血时间(ECT)试剂中含有能切割凝血酶原的蝰蛇毒,产生的有活性的中间产物可被达比加群抑制[36]。ECT结果与达比加群血药浓度呈剂量依赖的线性相关[37],当血药浓度处于50~500 μg/L时,ECT与达比加群浓度相关性最佳,通常ECT延长至正常上限>3倍时,提示出血风险增加。血药浓度过低或过高(<40 μg/L或>940 μg/L)会使ECT检测性能下降,血中纤维蛋白原和凝血酶原缺乏也可降低检测的准确性[36]。由于ECT对肝素不敏感,在伴随肝素给药时(尤其肝素与达比加群酯相互桥接时),ECT监测特异性更强[38]。
稀释凝血酶时间(dTT)可有效监测达比加群酯,其实验原理与TT相近,区别是要用正常人混合血浆按1∶8~1∶20的比例稀释血浆标本。当血药浓度在50~500 μg/L时,经校准的dTT与血药浓度呈良好的线性相关[11,16],当dTT显示血药浓度>200 μg/L时,出血风险可能增高。不同的dTT试剂对达比加群的敏感性存在差异,使用前需做性能验证[38]。
当达比加群血药浓度在100~200 μg/L时,APTT呈剂量依赖性延长,当血药浓度更高时(>200 μg/L,相当于达比加群酯150 mg,2次/d),APTT变化趋缓或停滞,与血药浓度的相关性降低(此时评估出血风险需谨慎)[9,11,16,17]。APTT在用药后2~3 h检测(峰值浓度),延长至正常上限2倍以上时,提示出血风险增加[11,16]。不同类型APTT试剂对达比加群的敏感性存在较大差异,不敏感的APTT检测治疗剂量的达比加群仍可处于正常范围[17],所以在使用前应评估APTT试剂对药物的敏感性。
TT对血中的达比加群有高度敏感性,低浓度的达比加群即可使TT过度延长,血药浓度为60 μg/L可造成TT延长超过300 s,由于TT对达比加群的敏感性过高,因此不适合指导剂量调整和安全性监测。另一方面,TT作为一种筛选方法,可识别血液中是否有残留的达比加群抗凝活性,当TT正常时,提示血中达比加群抗凝活性已完全消失[11,16]。NOAC是近年来血栓预防和治疗的常用药物,药代动力学稳定,安全性优于华法林。另一方面,由于NOAC应用时间较短,临床医生对这些药物在特殊情况下的药效学变化缺乏了解,往往困惑于如何在复杂或紧急状态下进行合理干预。随着研究深入,不同凝血试验在NOAC监测中的性能逐渐明晰(表1),PT和APTT反映患者止血状态(主要用于安全性监测),而anti-FⅩa、ECT和dTT则能敏感反映血药浓度波动(提示药代动力学异常),这些实验易于获得,廉价便捷,能为医生实施安全有效的药物调整、避免药物相关的不良事件提供可靠依据。
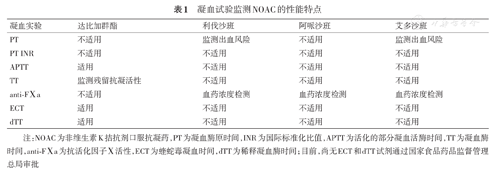
凝血试验监测NOAC的性能特点
凝血试验监测NOAC的性能特点
| 凝血实验 | 达比加群酯 | 利伐沙班 | 阿哌沙班 | 艾多沙班 |
|---|---|---|---|---|
| PT | 不适用 | 监测出血风险 | 不适用 | 监测出血风险 |
| PT INR | 不适用 | 不适用 | 不适用 | 不适用 |
| APTT | 适用 | 不适用 | 不适用 | 不适用 |
| TT | 监测残留抗凝活性 | 不适用 | 不适用 | 不适用 |
| anti-FⅩa | 不适用 | 血药浓度检测 | 血药浓度检测 | 血药浓度检测 |
| ECT | 适用 | 不适用 | 不适用 | 不适用 |
| dTT | 适用 | 不适用 | 不适用 | 不适用 |
注:NOAC为非维生素K拮抗剂口服抗凝药,PT为凝血酶原时间,INR为国际标准化比值,APTT为活化的部分凝血活酶时间,TT为凝血酶时间,anti-FⅩa为抗活化因子Ⅹ活性,ECT为蝰蛇毒凝血时间,dTT为稀释凝血酶时间;目前,尚无ECT和dTT试剂通过国家食品药品监督管理总局审批
所有作者均声明不存在利益冲突
思考题(单选)
1.常规监测华法林的实验指标是:
A.APTT
B.TT
C.INR
D.VKORC1
2.抗活化因子Ⅹ活性(anti-FⅩa)用于哪种药物血药浓度检测:
A.华法林
B.110 mg达比加群酯
C.150 mg达比加群酯
D.利伐沙班
3.APTT可监测以下哪种药物的安全性:
A.华法林
B.达比加群酯
C.阿哌沙班
D.利伐沙班
4.以下哪种特殊情况下应需考虑监测非维生素K拮抗剂口服抗凝药(NOAC):
A.严重或急性肝肾损害
B.女性患者
C.联合使用任何药物
D.长期卧床
5.NOAC拮抗的目标是:
A.凝血因子Ⅱ或Ⅹ前体γ-羧基化过程
B.凝血因子Ⅶ或Ⅺ前体γ-羧基化过程
C.凝血因子Ⅱ或Ⅹ
D.凝血因子Ⅱa或Ⅹa
答题方法详见插页



























