
多形性室性心动过速是临床常见的快速性室性心律失常之一,一般为恶性,常导致严重血流动力学异常,可伴有意识丧失或转化为心室颤动而危及患者的生命。根据发作前后心电图特点,可分为长QT依赖的尖端扭转型室性心动过速和非长QT依赖的多形性室性心动过速,两者在病因、电生理机制、发作前后心电图表现和治疗方法等方面均存在显著不同,是临床需要鉴别的重要问题。该文总结两者的特点,以期帮助临床医生进行更准确地诊断和干预。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多形性室性心动过速(polymorphic ventricular tachycardia, PMVT)是QRS波群形态在1个或多个导联发生变化,R-R间期不等的一类快速性室性心律失常,心室率通常为200~350次/min,临床表现多样,根据持续时间不同可出现乏力、晕厥、意识丧失或阿斯综合征,也可恶化为心室颤动致患者死亡[1]。临床上根据PMVT发作前后QTc间期是否延长及其与PMVT发作的相关性,将广义的PMVT分为两类:(1)发作前后伴有QTc间期延长,且QTc间期延长与室性心动过速发作相关者称为尖端扭转型室性心动过速(torsades de pointes, TdP);(2)QTc间期不延长或仅轻度延长,但QTc间期延长与PMVT发作不相关者称为非长QT依赖性PMVT。由于TdP和非长QT依赖性PMVT的心电图均可表现为尖端扭转图形,部分非长QT依赖性PMVT可伴有QTc间期的轻度延长(但QTc间期延长并不与PMVT发作相关),部分非长QT依赖性PMVT在使用Ⅲ类抗心律失常药物后出现QTc间期延长而PMVT尚未纠正等临床现状,两者的鉴别及处理存在困难。
TdP是1966年由法国临床电生理学家Dessertenne首先在1例有间歇性、完全性房室传导阻滞、QTc间期延长伴反复晕厥的80岁女性患者中记录并做报道[2],属于PMVT的一种特殊类型。其发生于遗传性LQTS(cLQTS)或获得性LQTS(aLQTS)患者,临床表现多样,具有一定自限性,但也可恶化为心室颤动,危及患者生命。典型的心电图表现为QRS波电轴每隔5~15个搏动周期即围绕等电位线翻转1次,呈现尖端扭转图形(图1)。
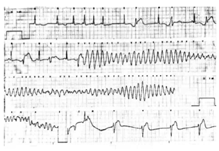

TdP的发病机制尚不清楚,一般认为是触发激动和折返环路的共同参与。任何造成内向除极电流(如INa或ICa)增大或外向复极电流(多种IK)减小的因素,包括基因突变、药物、电解质紊乱、心力衰竭等,均可造成QTc间期显著不均一延长,其一方面导致心室复极离散度增大,形成折返环路的基础,另一方面可致细胞内钙超载,诱发EAD,触发室性期前收缩,其在病变心肌内的传导可出现单向阻滞,从而触发并维持TdP的发生[3]。
TdP发生于cLQTS或aLQTS,后者常见。(1)cLQTS:是基因突变导致离子通道或其相关调节蛋白功能异常,导致内向除极电流增大或外向复极电流减小,复极时间延迟的一组临床综合征。根据突变基因公认的类型有16型,其中LQT1、LQT2和LQT3占90%以上[4]。(2)aLQTS:较cLQTS常见,病因包括延长QTc间期的药物(如Ⅰ类和Ⅲ类抗心律失常药、抗组胺药、大环内酯类抗生素、精神药物、胃和膀胱平滑肌动力药及利尿剂等),代谢异常(如电解质紊乱、甲状腺功能减退症等),缓慢型心律失常(如窦房结功能障碍、二度或三度房室传导阻滞等),心肌梗死,应激性心肌病等[5]。存在携带LQTS相关突变基因的亚临床QTc间期延长者,或存在一些特定基因多型性者,平时心电图QTc可以正常,但对延长QTc的药物有异常增高的敏感性,应用药物时可能发生显著的QTc延长并引起TdP发作。
某些心电图征象提示TdP高风险,临床上应密切监测,高度警惕,及早采取预防及干预措施。(1)QTc间期延长:2010年发表的美国院内TdP防治建议[6]中,推荐QTc正常上限值男性为470 ms,女性为480 ms,随着QTc间期延长,TdP的发生风险显著增高,≥500 ms为高危,≥600 ms为极高危[7]。QTc延长幅度每增加10 ms,TdP风险呈指数式增高5%~7%。但就具体患者而言,目前尚无法确定预测TdP发生的QTc的具体阈值。(2)T-U波形态明显异常:包括T波低平或双向、T波切迹、T波宽大倒置、U波高大、T-U波融合等,研究发现T波波峰到终末(Tp-Te)的间期延长可增加TdP的发生风险。长间歇后出现显著的QTc间期延长和T-U形态异常是发生TdP的强预警信号[6]。(3)T波电交替:罕见,但预警价值高,发生机制与细胞内钙离子浓度的周期性变化有关[8]。
(1)常由"短-长-短"周期诱发:室性早搏后长间歇或高度房室传导阻滞、严重窦性心律失常、窦性停搏所致长间歇,可进一步延长QTc间期,其后室性早搏易诱发TdP,称为"慢频率依赖性"或"间歇依赖性",多见于aLQTS患者[5]。部分cLQTS患者在运动、情绪激动或声音刺激等情况下可直接由室性早搏触发TdP,呈"肾上腺素能依赖性",多见于LQT1和LQT2。(2)尖端扭转图形:TdP的典型心电图表现为QRS波的尖端扭转图形。但临床需要注意的是:①由于PMVT发作时不同折返途径的QRS电轴的向量方向不同,尖端扭转图形可仅见于部分心电图导联;②当心动过速持续时间短,每阵发作仅包含数个QRS波群时,尖端扭转的特征可不明显。因此,对怀疑TdP的患者应争取行12导联或多导联心电图同步描记[1]。但是,尖端扭转图形并非TdP所特有,也可见于非长QT依赖性PMVT如短联律间期室性早搏触发的PMVT[9]。(3)发作呈一定自限性:QTc间期延长在TdP的触发及维持中起关键作用,当TdP发作时,快速增加的心室率可以纠正原有的QTc间期延长和复极不均一性,使心动过速自行终止,故TdP多呈一定自限性,常反复发作。
包括TdP的紧急治疗和LQTS的长程管理。
常伴有血流动力学不稳定,需要立即非同步直流电复律;血流动力学较稳定的TdP患者可在密切监测生命体征的前提下短暂试用药物治疗。(1)静脉应用镁剂:是TdP发作时的一线治疗措施,具有操作简单、疗效肯定、不良作用少等优点。成人的标准使用方案是静脉给予负荷量硫酸镁2 g(心脏骤停患者1~2 min输完,无心脏骤停的患者15 min输完),部分患者还需以3~20 mg/min的速度连续输注。儿童负荷量为25~50 mg/kg,关于儿童静脉维持剂量,尚无数据发表。推荐维持血镁浓度在正常高值以减少TdP复发。(2)心率调控:增快心率可缩短QTc间期,可能终止TdP发作,尤其适用于"慢频率依赖性"或"间歇依赖性"的TdP患者,当静脉补镁治疗无效时可试用。包括临时超速起搏及异丙肾上腺素等,后者多用于临时起搏准备期或不能起搏者,对"肾上腺素能依赖性"TdP患者可能加重电风暴。(3)Ⅰb类抗心律失常药:可缩短动作电位时程,并可能有直接抗心律失常作用,适用于心律失常发作时的急性治疗。(4)补钾:低钾血症是aLQTS合并TdP的常见诱因,应积极纠正,维持血钾4.5~5.0 mmol/L可减少TdP复发,对基线血清钾浓度正常患者,静脉补钾也可能获益。
(1)生活方式干预:不同类型cLQTS患者发作TdP的诱因不同,LQT1患者应避免游泳和过度运动,LQT2患者应避免情绪及声音刺激,如闹铃、手机铃声、婴儿哭声刺激等,LQT3患者在休息和睡眠中发生心律失常的风险最高,而在运动状态下发生风险小[10]。谨慎用药,避免电解质紊乱、心肌缺血等可能引起QTc间期延长的继发因素。(2)β受体阻滞剂:治疗cLQTS的一线用药,对LQT1疗效最佳,LQT2次之,LQT3最差。主要作用机制是降低心脏对儿茶酚胺的敏感性,但不具备直接抗心律失常作用,且存在减慢心率而延长QTc间期的可能。关于不同类型β受体阻滞剂之间的疗效差异尚缺乏随机对照研究的证实,但学界普遍认为纳多洛尔为首选,其次是普萘洛尔,美托洛尔对各型LQTS疗效均较差[11]。(3)左心交感神经去除术:通过外科手术减弱交感神经对心脏的支配作用,主要用于β受体阻滞剂不耐受或效果欠佳、拒绝植入埋藏式心律转复除颤器(implantable cardioverter defibrillator, ICD)或存在ICD禁忌证的患者,有研究显示左心交感神经去除术预防SCD效果与ICD相当,但因技术原因尚未广泛应用[12]。(4)ICD:用于有心脏骤停病史、充分药物治疗后仍发作晕厥、QTc间期显著延长(≥550 ms)、明显的T波电交替等高危患者,减少猝死的疗效确实,但在包括儿童在内的患者中接受度差;部分患者因精神紧张和放电刺激,可能加重TdP发作甚至引起电风暴[13]。(5)靶向治疗:针对离子通道的靶向治疗是目前的研究热点。美西律对晚钠电流具有一定的选择性抑制作用,可用于LQT3患者,对其他LQTS如LQT2和LQT8等可能也有一定疗效[14];新型选择性晚钠电流抑制剂可缩短QTc间期,并有直接的抗心律失常作用,推荐用于LQT3的治疗,但对少数LQT3基因型(如M1652R等)可能疗效不佳[15]。
非长QT依赖性PMVT指PMVT发作前后QTc间期正常或轻度延长,但QTc间期延长与室性心动过速发作不相关。常见病因包括:(1)器质性心脏病:如缺血性心脏病、应激性心肌病、左室致密化不全心肌病、致心律失常性右室心肌病等;(2)遗传性心律失常:如特发性PMVT、短QT综合征、Brugada综合征、早复极综合征和儿茶酚胺敏感性PMVT等。其中,缺血性心脏病最常见[16]。
因基础病的类型不同差别极大。缺血性PMVT与急性心肌缺血导致儿茶酚胺超敏感性,细胞内钾离子蓄积、酸中毒及腺苷蓄积等引起的电化学不稳定性及ATP敏感性钾离子通道(KATP)激活、晚钠电流(INaL)增大等电重构引起心室复极离散度增加等相关[17];其他器质性心脏病发生PMVT常与心肌脂肪替代或纤维化等造成的多发折返机制相关;J波综合征引起的PMVT与2相折返相关;儿茶酚胺敏感性PMVT引起双向性室性心动过速与心动过速交替起源于不同束支区域相关。
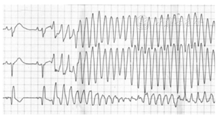

Wolfe等[18]研究发现院内急性心肌梗死患者中缺血性PMVT的发生率为2%,其常见于急性心肌梗死的超急性期,发作前后可伴心肌缺血相关症状或ST-T改变,QTc间期不延长或轻度延长,常由极短联律间期(≤300 ms)的期前收缩(即R on T现象)触发,呈快频率依赖性[19]。
QTc间期延长在ACS患者中并不少见,发生率为19%~60%,但多为一过性改变,在病程的第2~11天达峰,之后逐渐下降[17],与心肌细胞急性缺血及水肿造成离子通道功能异常、复极时间延长有关,随心肌细胞功能恢复而快速好转,此时与TdP的鉴别较为困难。此外,使用静脉胺碘酮进行治疗时,可能PMVT尚未获充分控制而伴QTc间期继发延长,此时易误诊为TdP而停用胺碘酮造成严重后果,故临床医生在使用胺碘酮时,除观察QTc间期改变之外,更要注意心律失常对治疗的反应,作出尽可能正确的诊断,并给予相应治疗。
血流动力学不稳定的患者,立即予直流电复律治疗。血流动力学稳定的患者,给予原发病相应治疗、抗心律失常药物、射频消融术及ICD等。研究显示,补镁、超速起搏、Ⅰ类抗心律失常药这些针对TdP的治疗对非长QT依赖性PMVT的疗效差或无效[16]。
缺血性PMVT的首要治疗手段是血运重建,可能减少心律失常的复发及避免过度使用抗心律失常药物。
对缺血性PMVT,β受体阻滞剂疗效较好,胺碘酮可有效地终止心律失常的发生;对无严重器质性心脏病患者,其他Ⅲ类抗心律失常药如索他洛尔可能有效;维拉帕米有一定疗效,但可能恶化患者的血流动力学。
需强调的是,在胺碘酮用药过程中要严密观察QTc间期和心律失常的发生情况,不可轻易因为QTc间期偏长而停用胺碘酮等可能有效的药物;也更应该避免对TdP患者应用胺碘酮造成心律失常加重甚至电风暴。
对反复发作PMVT或心室颤动的患者,如果其对抗心律失常药物不耐受,异位起搏点相对固定时,可考虑射频消融术,但疗效不理想,且操作困难,复发率高。Brugada综合征患者对右心室流出道心外膜进行基质消融,可能改善Brugada心电图表现及减少心律失常的发生。射频消融术需在经验丰富的中心进行。
可有效降低心脏性猝死风险。
应注意区分两者的临床特征,严密观察治疗反应,及时作出诊断及治疗上的调整。二者鉴别要点见表1。

TdP和非长QT依赖性PMVT的鉴别要点
TdP和非长QT依赖性PMVT的鉴别要点
| 要点 | TdP | 非长QT依赖性PMVT |
|---|---|---|
| 好发人群 | cLQTS和aLQTS | 器质性心脏病及遗传性心律失常 |
| QTc间期 | 显著延长(>500 ms),且与PMVT发生相关 | 正常或轻度延长,且与PMVT发生无关 |
| 触发因素 | 短-长-短周期慢频率依赖性 | 短联律间期室性早搏、R on T现象快频率依赖性 |
| 室性早搏的联律间期 | 一般较长(多≥450 ms) | 相对较短(常<350 ms) |
| 治疗方法 | 停用可延长QTc间期的药物,补镁补钾,心率调控,可用Ⅰb类抗心律失常药、β受体阻滞剂禁用胺碘酮 | 治疗原发病,可用β受体阻滞剂、胺碘酮补镁、Ⅰ类抗心律失常药物及心率调控等疗效差或无效 |
| 对Ⅲ类抗心律失常药物的治疗反应 | 可能出现心律失常的加重,甚至电风暴 | 可能伴有QTc间期轻度延长,心律失常可能好转或消失,停用后心律失常加重 |
注:TdP为尖端扭转性室性心动过速,PMVT为多形性室性心动过速,cLQTS为遗传性长QT综合征,aLQTS为获得性长QT综合征
PMVT是一类恶性室性心律失常,容易造成血流动力学异常、晕厥和死亡。TdP和非长QT依赖性PMVT在病因、发病机制、发病前后的心电图表现、发作特点及治疗方法上均存在明显不同,结合临床特征的鉴别诊断与合理的处理可改善患者的预后。
所有作者均声明不存在利益冲突
1.下列哪一项不属于尖端扭转性室性心动过速(TdP)的预警信号:
A. QTc间期510 ms
B. T波电交替
C. ST段弓背向上型抬高
D. T-U波形态异常
2.下列关于TdP的描述哪一项是错误的:
A. TdP发作呈一定自限性
B. TdP并非在所有导联均呈现典型的尖端扭转图形
C.胺碘酮用于终止TdP的发作
D. TdP常由"短-长-短"周期诱发,呈慢频率依赖性
3.下列关于缺血性多形性室性心动过速(PMVT)描述正确的是:
A.胺碘酮使QTc间期延长,应立即停用
B.静脉用镁剂可有效终止缺血性PMVT:
C. Ⅰb类抗心律失常药物可有效终止缺血性PMVT
D.常见于心肌缺血的超急性期,发生前后可伴心肌缺血症状或心电图改变
4.下列哪一项不是引起TdP的病因:
A.大环内酯类抗生素
B.低钾血症
C.三度房室传导阻滞
D. Brugada综合征
5.TdP的治疗方法包括以下内容,除了:
A.停用延长QTc间期的药物
B.静脉用镁剂
C.血流动力学不稳定者须立即行同步直流电复律
D.胺碘酮可诱发电风暴,禁用于TdP
答题方法详见插页



























