
瓣周漏(PVL)是经导管主动脉瓣置换术(TAVR)的常见并发症。该文报道1例TAVR术后发生PVL的老年患者,再次行TAVR联合PVL介入封堵术,手术成功,术后超声心动图显示无人工瓣反流,轻度瓣周漏。“瓣中瓣”技术是TAVR人工瓣膜衰败的有效治疗手段,在有经验的中心可以选择介入封堵处理严重PVL。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
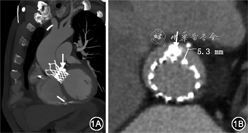
患者男性,71岁,主因“活动后呼吸急促3年,再发加重2周”于2019年12月19日入院。患者3年前出现活动后呼吸急促,休息数分钟可自行缓解,无胸痛、心悸、晕厥等症状,多次因夜间阵发性呼吸困难伴下肢水肿于当地医院住院治疗,诊断考虑“心脏瓣膜病,重度主动脉瓣狭窄”,给予药物保守治疗。2019年3月患者因上述症状加重于我院住院治疗,经胸超声心动图(TTE)结果显示:主动脉瓣二叶瓣畸形,重度主动脉瓣狭窄[主动脉瓣峰值流速5.7 m/s,平均跨瓣压差58 mmHg(1 mmHg=0.133 kPa)],轻中度二尖瓣反流,轻中度三尖瓣反流,舒张期左心室内径6.8 cm,左心室射血分数40%。实验室检查:N末端B型利钠肽原(NT-proBNP)10 972 ng/L(正常值范围:0~125 ng/L)。冠状动脉CT血管成像(CTA)检查排除冠心病。入院诊断:先天性主动脉瓣二瓣化畸形,重度主动脉瓣狭窄伴关闭不全,慢性心力衰竭,纽约心脏病协会(NYHA)心功能Ⅳ级。2019年3月6日行经导管主动脉瓣置换术(TAVR),术中置入Vitaflow Ⅱ TAV27瓣膜支架(上海微创医疗器械公司),术中经食道超声心动图(TEE)示:术前收缩期主动脉瓣口面积0.6 cm2,峰值流速4.9 m/s,平均压差53 mmHg;术后收缩期主动脉瓣口面积3.1 cm2,峰值流速1.7 m/s,平均跨瓣压差6 mmHg;术后人工瓣口轻中度反流,中度瓣周漏(paravalvular leak,PVL),反流束宽度0.4 cm。后因心力衰竭症状加重,多次住院治疗,2019年9月7日复查TTE示:人工瓣中度反流,中重度PVL(反流束宽度0.4 cm)。2019年12月19日患者因“急性失代偿性心力衰竭”再次入院。既往有慢性阻塞性肺病、痛风、下肢静脉曲张病史,2019年4月29日患者因“高度房室传导阻滞”行双腔永久起搏器置入。个人史、家族史无特殊。入院体格检查:体温36.8 ℃,脉搏65 次/min,血压152/65 mmHg;步入病房,颜面水肿潮红,颈静脉充盈,颈部未闻及血管杂音;双肺呼吸音清,双下肺少许湿性啰音;心率65次/min,律齐,主动脉瓣第一、二听诊区可闻及重度舒张期叹气样杂音,向胸骨左缘传导;水冲脉;腹部饱满,上腹部轻压痛,余腹部查体无阳性发现;双下肢水肿;右下肢静脉曲张。心电图:窦性心律,ST-T改变(V1~V5导联ST段压低并T波双向或倒置)。主动脉根部CTA示:主动脉瓣置换术后,金属瓣架膨胀良好,瓣周见严重钙化团块及瓣周隧道与左心室交通(图1)。

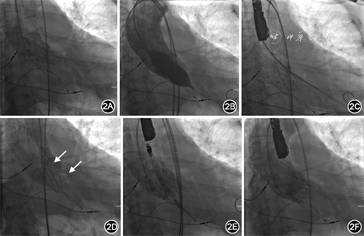
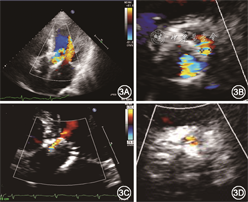
经心脏团队讨论后建议患者首选外科主动脉瓣置换术,术中探查主动脉根部,必要时考虑行带主动脉瓣人工血管升主动脉替换术(Bentall手术);次选方案可考虑再次行TAVR联合PVL介入封堵术。患者拒绝外科手术,要求介入治疗。2019年12月26日在全麻下行再次TAVR联合PVL介入封堵术。手术过程(图2):穿刺右侧股动脉置入7 Fr血管鞘,经鞘管送6 Fr猪尾导管至升主动脉窦底,主动脉造影提示重度人工瓣反流和PVL;将26 mm×4 cm NUMED球囊送至人工瓣膜假体内,快速起搏(180次/min),扩张球囊并行升主动脉造影,结果显示人工瓣无反流,瓣周反流显著,术前TTE显示人工瓣口重度反流信号,重度PVL;直头导丝(UniGlideTM,Cook Medical)经由JR 4造影导管穿过PVL隧道至左心室,交换0.036 mm×260 cm普通导丝至左心室,拟经普通导丝送5 Fr PDA/VSD输送鞘(北京华医圣杰科技有限公司)至左心室未能成功,交换超硬导丝(Amplatz Super StiffTM,Boston Scientific)至左心室,经超硬钢丝成功将输送鞘送至左心室;10~12 mm Plug Ⅰ型封堵器(北京华医圣杰科技有限公司)与推送钢缆连接,在PVL隧道左心室侧部分释放封堵器后回撤输送鞘至PVL隧道内,有阻力后封堵器近端于隧道主动脉侧完全释放;选择Vitaflow Ⅱ TAV27瓣膜支架(上海微创医疗器械公司),沿左心室钢丝送至瓣膜假体内,快速起搏(140 次/min)后“0”位释放。术后造影及TEE评估结果显示,无人工瓣反流,轻度瓣周反流。出院前复查TTE:人工瓣功能正常,轻度PVL(反流束宽度0.2 cm),中度二尖瓣反流,轻度三尖瓣反流,舒张期左心室内径6.0 cm,左心室射血分数45%。术前与术后TTE对比见图3。


目前TAVR已成为存在外科手术禁忌或风险中、高危的症状性重度主动脉瓣狭窄患者的一线治疗方案[1, 2]。TAVR术后PVL的发生率较高(超过70%),但严重PVL(定义为中度及以上程度的瓣周反流)约占15%[3, 4]。多数PVL无明显临床症状,少数可引起严重临床事件,如心力衰竭和溶血。TAVR术后严重PVL是近期和远期死亡的独立危险因素。严重PVL患者TAVR术后1年死亡风险是中度以下PVL患者的2~4倍[5]。主动脉根部严重钙化、瓣膜的植入深度不准确以及瓣膜选择尺寸与瓣环不匹配是导致TAVR术后PVL发生的最常见原因[5]。二次外科修复或二次瓣膜置换是治疗瓣膜置换术后PVL的主要手段,但外科手术高危的PVL患者,如解剖条件适宜封堵,建议首选介入治疗[1]。目前对于TAVR术后PVL的介入治疗的证据有限。
TAVR术后PVL介入封堵常选择股动脉入路,PVL隧道内径较小时可以考虑经桡动脉入路[6]。当PVL较为复杂,股动脉入路难以成功时,可选择经心尖入路。器械选择取决于PVL的大小和形态。PVL专用封堵器械,如Amplatzer血管塞Ⅲ(AVP3)和PLD封堵器,与非专用封堵器械相比其结构更接近大多数PVL的解剖形态,理论上更有助于PVL的封闭。使用其他器械(包括AVP2、AVP4和Amplatzer导管封堵器等)介入封堵PVL均属于“超适应证”治疗[7]。应针对不同的PVL解剖形态,选择合适的封堵器械。
TAVR术后PVL患者行介入封堵治疗前可先尝试进行人工瓣膜后扩张,对球囊扩张式瓣膜进行球囊后扩张能减少72%的瓣周反流,自膨式瓣膜球囊后扩张同样有效[8, 9]。不理想的释放位置会导致瓣膜与自身瓣环不完全对合,瓣膜支架的裙边不能完全封闭,进而导致PVL。Ussia等[10]研究显示,“瓣中瓣”技术能有效纠正此类PVL,技术成功率100%,术后1年生存率95.5%,而外科手术组为86.3%。
针对不同的PVL形成原因,宜选择不同的处理方式。如果PVL与瓣膜释放深度无关,或并非瓣膜选择尺寸与自身瓣环不匹配所造成,或钙化负荷重,预期后扩张效果不佳时,可以考虑介入封堵治疗。目前对于TAVR术后PVL的介入封堵治疗的证据有限,多限于个案报道,或小样本系列病例报道。Waterbury等[11]回顾性纳入TAVR术后PVL患者18例,术中44%的患者使用AVP2,56%的患者使用AVP4,技术成功率78%,4例介入封堵未成功的患者给予球囊后扩张(2例)和“瓣中瓣”技术治疗(2例)同样有效;72%严重PVL患者术后瓣周反流减少至中度以下,1例患者术后出现填塞和急性肾损伤,介入术后30 d全因死亡率为11%。Feldman等[12]纳入TAVR术后PVL患者6例,探讨经4 Fr诊断性造影导管使用小型号AVP4介入封堵PVL的可行性,6例患者术中均成功释放封堵器,其中1例置入2枚AVP2,5例患者术后瓣周反流由中度以上程度PVL减少至中度以下,并且临床心力衰竭症状改善,1例PVL严重程度无减少,患者术后1个月死亡。在爱尔兰和英国的注册研究中,纳入PVL介入治疗患者308例,其中TAVR术后PVL患者占5%,研究中未将TAVR病例与非TAVR病例分开讨论,但指出主动脉瓣PVL介入封堵成功率为93.1%[13],术中使用了PVL专用封堵器(AVP3和PLD)以及其他多种“超适应证”治疗的封堵器械。直接比较介入和外科治疗TAVR术后PVL的数据有限,首个此类研究仅纳入20例患者(介入组10例,外科组10例),研究结果显示,介入技术成功率显著低于外科(60%比100%,P=0.04),介入失败的原因均是输送鞘不能通过PVL隧道,CT分析介入失败病例主要原因是PVL所在瓣叶重度钙化[14]。
本例患者首次置入自膨式瓣膜的深度合适,术后瓣膜支架展开充分,PVL的主要原因考虑与瓣叶重度团块状钙化有关,术前CTA以及TTE评估显示PVL隧道形态呈圆柱形,具备介入封堵解剖适应证,且非复杂PVL;人工瓣口反流原因不明确,首次TAVR术后即刻存在瓣口轻中度反流,此后逐步加重至重度,考虑瓣膜预装损伤可能性大,后期加重的原因不除外瓣叶血栓形成,但缺乏影像学证据。介入封堵术中使用26 mm球囊对首次植入的瓣膜行后扩张,在球囊扩张同时行升主动脉造影时,中心性反流消失但PVL无减轻,以及球囊撤出后升主动脉造影及TEE检查显示PVL仍无改善,提示球囊后扩张以及单纯“瓣中瓣”技术不能减轻瓣周反流程度。鉴于以上分析,介入策略调整为“瓣中瓣”技术解决瓣膜中心性反流,介入封堵处理PVL。考虑先行再次TAVR会给封堵治疗造成困难,建议TAVR手术前先尝试介入封堵PVL。文献回顾发现AVP2适合圆柱形PVL封堵,国产Plug封堵器的形态特征与之相似,故选择该类型封堵器。从以往介入封堵外科瓣膜置换术后PVL的经验中总结出,在释放器械之前,建议进行以下安全性检查:识别任何残余漏(轻度及以下反流);通过牵拉和/或推动输送线缆来测试封堵器械的稳定性;主动脉瓣PVL介入封堵时需要确认冠状动脉的通畅性。
PVL是TAVR常见并发症,具有较高的发病率和死亡率。介入封堵治疗可以作为外科手术的一种替代方式,二者的长期预后和死亡率相近。但仍需大规模的随机临床研究来明确介入封堵治疗PVL的安全性和有效性。
所有作者均声明不存在利益冲突



























