
超声心动图在瓣膜病介入治疗术前评估、术中监测及术后随访中都起着至关重要的作用。该文对经导管瓣膜介入治疗中超声心动图的应用及进展作一综述。

经全国继续医学教育委员会批准,本刊开设继续教育专栏,从2021 年第1 期开始共刊发10 篇继续教育文章,文后附5 道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继续教育学分0.5 分,全年最多可获5 分。
经导管瓣膜病介入治疗技术的发展为瓣膜病治疗提供了新选择,超声心动图在瓣膜病介入治疗术前评估、术中检测及术后随访中都起着至关重要的作用。本文对经导管瓣膜介入治疗中超声心动图的应用及进展作一综述。
TAVR是不能行外科开胸手术、有症状的重度主动脉瓣狭窄(aortic stenosis,AS)患者的替代治疗手段,目前指南已将其作为治疗这类患者的Ⅰ类推荐[1]。最近研究发现TAVR亦可应用于中危甚至低危重度AS患者[2, 3]。
1.TAVR术前的超声评估:超声是评估AS狭窄程度的首选方法,此外它还可提供主动脉瓣形态、主动脉根部相关径线、左心室大小和功能、左心室肥厚程度、是否合并肺动脉高压以及有无二、三尖瓣病变等相关信息,有助于AS患者的临床决策。
评估AS的第一步是观察主动脉瓣的形态及活动度。主动脉瓣短轴切面可显示瓣叶数目、钙化程度及分布,瓣叶开闭情况、开放是否受限,若提示AS可能,则需进一步评估狭窄程度。判断主动脉瓣叶数目十分重要,不同的解剖形态TAVR手术策略不同。三叶式和二叶式主动脉瓣较常见,而单叶及四叶式罕见。对于钙化较重的AS患者,经胸超声心动图(transthoracic echocardiography,TTE)不一定能很好区分主动脉瓣的数目及分型,主动脉窦部形态、主动脉根部及升主动脉的异常扩张可为二叶式的判断提供间接证据[4],亦可结合经食道超声心动图(TEE)或CT进行鉴别诊断。
狭窄程度的评估主要依赖血流动力学参数,包括:主动脉瓣跨瓣峰值流速(Vmax)、平均跨瓣压差(PGmean)和连续方程计算得出的主动脉瓣口面积(AVA)。重度AS定义为Vmax≥4 m/s,PGmean≥40 mmHg(1 mmHg=0.133 kPa),AVA<1.0 cm2[5]。超声测量上述血流动力学参数时建议在心尖五腔心、心尖长轴,升主动脉长轴、胸骨上窝、剑突下切面等多个切面进行测量,尽量保证超声声束和血流方向平行,以获得最大的测值[5]。尽管大部分重度AS患者表现为高流速、高跨瓣压差,但仍有1/3的患者表现为低流速、低跨瓣压差(Vmax<4 m/s,PGmean<40 mmHg,AVA<1.0 cm2)[6],后者根据左心室射血分数(LVEF)分为LVEF减低(LVEF<50%)和LVEF保留(LVEF≥50%)的低流速低压差重度AS。对于LVEF减低的低流速低压差重度AS患者,可给予小剂量多巴酚丁胺负荷试验鉴别真性或假性重度AS[5]。LVEF保留的低流速低压差重度AS的诊断首先需排除测量误差,Kamperidis等[7]将CT测量的左心室流出道面积代入计算AVA的连续方程中,发现其比常规应用TTE测量的AVA大,部分患者修正诊断为中度AS,因此这类患者的诊断需结合临床及影像多个指标综合评估[5]。
主动脉瓣环径的测量结果是TAVR人工瓣膜型号选择的依据,目前绝大多数中心主要依赖CT测量结果进行判断,但在某些特殊情况下,如急诊TAVR未行CT检查、CT图像质量不佳、对造影剂过敏或者肾功能不全的患者,则主要根据超声测值进行选择。既往研究发现主动脉瓣环呈椭圆形,因此3D超声测量比2D更准确。3D TEE与CT测量的主动脉瓣环面积和周长具有高度的一致性,可作为CT的替代检查[8]。常规3D TEE测量主动脉瓣环径的方法和CT类似,在获得主动脉根部三维容积后,使用三维分析软件获得主动脉根部矢状位、冠状位以及横断面,在矢状位及冠状位切面确定三个瓣叶附着最低点,此三点即构成主动脉瓣环横切面,在该平面进行主动脉瓣环最大径、最小径、周长及面积的测量(图1)。目前也有专门针对主动脉瓣环测量的三维半定量分析软件,可以自动计算主动脉瓣环相关径线,与CT测值间相关性较好[9, 10]。
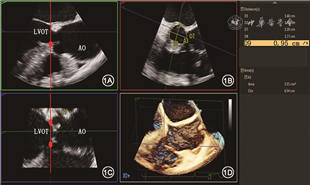

LVOT为左心室流出道,AO为主动脉
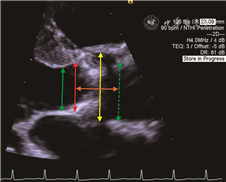
主动脉根部径线测量还包括左心室流出道(LVOT)内径、主动脉窦部内径和高度、窦管交界处内径、升主动脉内径以及冠状动脉开口距主动脉瓣环的距离(简称冠脉高度),这些测值均会影响TAVR人工瓣膜型号的选择和瓣膜置入的策略。主要径线的测量方法如图2。冠脉高度建议应用3D TEE测量更准确,确定瓣环水平后,调整主动脉根部矢状位和冠状位切线,分别通过右冠状动脉和左冠状动脉开口,分别在矢状位和冠状位测量右、左冠状动脉开口高度(图1)。

2.TAVR术中的超声评估:近年来随着TAVR技术的成熟,简化TAVR过程中超声最主要的作用是术中监测并发症及术后即刻评估疗效。对于熟悉超声的术者也可使用超声引导导丝置入、球囊预扩张以及人工瓣膜定位。根据不同的麻醉方式选择TEE或TTE进行术中评估,TEE对于人工瓣膜显示、瓣周反流评估方面更具有优势,而TTE在测量人工瓣膜血流速度及跨瓣压差上更有优势。随着局部麻醉在TAVR中的广泛应用,TTE成为了大多数中心的首选监测方法[11],在一些特殊情况下,例如TTE图像质量不佳无法判断反流程度及需行瓣周漏封堵、动态监测人工瓣膜置入情况及动态监测心脏结构及功能变化时,可考虑使用TEE进行术中监测。
TAVR术中出现血流动力学不稳定时,超声可快速判断有无下列并发症:(1)心包积液或心脏压塞:可出现在导丝置入、球囊预扩张或者人工瓣膜置入的任一过程;(2)急性大量主动脉瓣反流:主要在球囊预扩张后,尤其是术前无主动脉瓣反流的AS患者;(3)冠状动脉开口堵塞;(4)急性心功能不全;(5)急性二尖瓣大量反流:主要是由于导丝或鞘管影响二尖瓣装置导致瓣膜关闭不全;(6)主动脉夹层或血肿;(7)主动脉瓣环破裂等。
TAVR术后即刻评估内容包括人工瓣膜支架位置、瓣叶启闭情况、瓣周或瓣口反流程度、人工瓣膜前向血流速度、平均跨瓣压、人工瓣膜支架是否影响二尖瓣启闭。尽管造影也可以用于半定量评估主动脉反流程度,但其不能鉴别反流源于瓣口还是瓣周,若是瓣周反流,则可能是由于自体瓣膜钙化严重、人工瓣膜置入位置过高或过低或者人工瓣膜型号不匹配[12];若是瓣口反流,绝大多数由于超硬导丝影响人工瓣膜关闭而出现反流,拔出导丝即可。不同反流机制的后续处理策略不同,因此判断反流起源及原因非常重要,超声可以提供相应的信息。推荐多个切面结合多个超声参数进行综合评估瓣周反流,多束瓣周反流时评估相对较难,主要参考标准为在主动脉短轴切面反流束长度之和占人工支架周长的比例>30%为重度,10%~30%为中度,<10%为轻度[13]。
3.TAVR术后的超声随访:TAVR术后人工瓣膜功能和耐久性的评估主要依赖TTE,目前指南推荐在TAVR术后出院前或30 d内和术后6个月、1年及之后每年进行超声随访[14]。术后随访超声主要观察人工支架位置、瓣膜形态及活动度、瓣周及瓣口反流程度、是否有新出现的主动脉夹层,以及评估二、三尖瓣及心室功能等。一项多中心研究显示TAVR术后出现人工瓣膜狭窄(定义为随访时PGmean较术后基线增加≥10 mmHg)的比例为4.5%[15]。血流动力学的重度人工瓣膜衰败定义为PGmean≥40 mmHg和/或PGmean较术后基线增加≥20 mmHg,和/或新发的重度瓣口反流[16]。一项囊括了13个研究的荟萃分析显示TAVR术后重度人工瓣膜狭窄的年发生率为28/10 000[17]。TAVR术后发生感染性心内膜炎的比例约为1.1%,是患者术后1年内死亡的主要原因[18],超声尤其是TEE可评估有无赘生物、瓣周脓肿或假性动脉瘤的形成。
MR的介入治疗包括经导管二尖瓣置换术(TMVI)和经导管二尖瓣修复术(transcatheter mitral valve repair,TMVR)。TMVR根据技术原理不同,分为经导管缘对缘修复术、经导管二尖瓣环成形术、经导管二尖瓣人工腱索植入等术式。其中经导管缘対缘修复术是目前最成熟的MR介入治疗方法。目前,世界范围内的经导管二尖瓣缘对缘修复系统主要包括Mitraclip系统(美国Abbott公司)、PASCAL系统(美国Edwards Lifesciences公司),以及我国的经股静脉Dragonfly系统和经心尖ValveClamp系统[19]。美国2020年版瓣膜管理指南推荐经导管缘対缘修复术用于外科手术高危、解剖合适、预期寿命超过1年的原发性重度MR患者,以及经最佳药物治疗后仍有持续症状、LVEF在20%至50%之间、左心室收缩末期内径≤70 mm、肺动脉收缩压≤70 mmHg、解剖合适的继发性重度MR患者(Ⅱa类推荐)[20]。TMVI可考虑用于不适合行TMVR的患者,但当前其循证医学证据仍较欠缺。自2012年第一例人体TMVI实施以来,研发的新器械日渐增多,目前应用较多的是Tendyne瓣膜(美国Abbott公司)和Intrepid瓣膜(美国Medtronic公司)[21]。国内在研的TMVI器械主要有Mi-thos Valve和MitralFix系统。不同术式的选择主要依赖术前超声对二尖瓣反流病因、病变部位、解剖结构以及心脏功能等的精确评估。
术前超声评估对于MR患者治疗策略的选择具有重要价值。超声可对MR的病因、Carpentier分型、反流程度以及二尖瓣装置的解剖结构是否适合某一特定的手术方式进行评估。
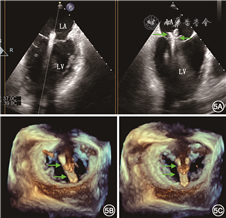
通常TTE检查即可对MR病因、Carpentier分型、反流程度以及左心室大小和功能等进行初步评估,对拟行经导管治疗的重度MR患者,术前推荐行TEE检查对二尖瓣结构进行更为精细的评估。3D TEE可同时观察到二尖瓣叶的所有区域,有助于病变区域的准确定位,有研究表明,在病变定位的精确性方面3D TEE优于TTE和2D TEE[22](图3)。此外,3D TEE血流图像能较准确地显示MR反流束的位置、宽度以及数目,有助于预测二尖瓣钳夹所需夹合器个数[23]。


LA为左心房,LV为左心室,LAA为左心耳,AO为主动脉,C1为前联合交界区,C2为后联合交界区,A2指二尖瓣前瓣A2区,P2指二尖瓣后瓣P2区
针对不同术式,术前超声评价的指标侧重点有一定差异,总的来说需要关注的要点包括:二尖瓣瓣叶形态、病变的范围和精确定位、反流束起源位置、瓣叶长度、二尖瓣瓣口面积(mitral valve area,MVA)、二尖瓣平均跨瓣压差等。术前MVA的测量推荐应用3D TEE多平面重建法,测值<4 cm2提示术后出现瓣膜狭窄的可能性较大。若进行经导管二尖瓣环成形术及TMVI,因需根据瓣环径来选择成形环或人工瓣膜型号,二尖瓣环径的准确测量尤其重要,尽管目前首选多排CT测量二尖瓣环径,但3D TEE能提供全心动周期二尖瓣环动态参数,有助于成形环或人工瓣膜型号的选择[24]。TMVI术后人工支架伸入到LVOT可能导致LVOT梗阻,术前超声评估有助于预测术后发生LVOT梗阻的可能性,预测因素包括二尖瓣前叶冗长、室间隔基底段肥厚,左心室心腔较小,以及主动脉-二尖瓣夹角<110°[25]。
因造影对二尖瓣成像效果较差,经导管二尖瓣介入治疗术中主要通过TEE进行引导、监测和术后即刻疗效评估。
1.经导管二尖瓣缘对缘修复术中超声的应用:术中采用超声引导主要包括以下几个步骤:(1)引导房间隔穿刺:穿刺部位一般选择在房间隔后上方,四腔心切面测量穿刺点距二尖瓣瓣环距离在4~4.5 cm处较为理想(图4)。(2)引导输送装置进入左心房:此过程中需不断微调探头角度始终清晰显示输送装置头端,避免损伤心房壁。结合应用3D TEE可实时显示输送装置头端在左心房内的空间位置关系。(3)引导夹合器到达二尖瓣病变位置上方并调整夹合器的方向使夹合器双臂连线与瓣叶闭合线垂直(图5)。(4)引导二尖瓣叶抓捕(图6)。(5)抓捕瓣叶后评估夹合器稳定性、残余反流程度、测量二尖瓣口,若结果满意则可完全释放,若残余反流较多且无明显狭窄,可放入第2枚甚至第3枚夹合器。(6)引导器械完全撤回后,再次评估夹合器稳定性、MR程度、二尖瓣口PGmean以及房水平分流情况,3D TEE可清晰显示二尖瓣双孔化(图7)。


LA为左心房,RA为右心房,SVC为上腔静脉,LV为左心室,RV为右心室

LA为左心房,LV为左心室


LA为左心房,LV为左心室,A2为二尖瓣前瓣A2区,P2为二尖瓣后瓣P2区


AO为主动脉
2.TMVI术中超声的应用:目前大部分TMVI器械是经心尖路径。超声引导心尖定位后,导丝从心尖逆行进入左心室,通过二尖瓣进入左心房,TMVI人工瓣膜沿着输送导丝到达二尖瓣位置后释放瓣膜,此路径短,操作相对容易。经股静脉TMVI需超声引导穿刺房间隔,顺行进入二尖瓣后再释放人工瓣膜。人工瓣膜置入过程可通过TEE结合X线透视共同完成[26]。
经导管二尖瓣介入治疗术后主要采用TTE进行随访。经导管二尖瓣缘对缘修复术后评估重点包括:夹合器的位置及稳定性、二尖瓣结构、血流动力学状况(狭窄或反流情况)、左心室功能、有无医源性房间隔缺损。TMVR术后评估要点包括人工瓣膜位置、形态,瓣口及瓣周反流程度,人工瓣膜前向血流速度和压差,人工瓣膜有无血栓、赘生物等;还需关注有无LVOT梗阻,左心室功能改善情况等(图8)。经导管二尖瓣介入治疗后MR反流程度的超声评估与一般情况下的评估原则相似[27]。可结合肺静脉血流频谱判断左心房压力和反流程度。中度及以上瓣周反流需考虑行球囊后扩张或瓣周漏封堵治疗。若经股静脉路径,术后即刻应用3D TEE准确评估穿刺房间隔处残余的缺损大小,较大者可行房间隔缺损封堵[28]。


LA为左心房,LV为左心室
三尖瓣反流(tricuspid regurgitation,TR)在临床上较常见,原发性TR较少,功能性TR占80%[29]。中-重度TR患者预后不佳、治疗方法有限,新进开展的经导管三尖瓣介入治疗给这类患者带来了曙光,目前新技术主要包括减少腔静脉反流(于上下腔静脉置入瓣膜)、瓣环环缩(Cardioband、Trialign、TriCinch、Milliped技术)、增加瓣叶聚合(FORMA、Mitraclip技术)以及经导管三尖瓣置换术(我国自主研发的Lux-Valve)[30]。超声在经导管三尖瓣修复术和置换术中均起着重要的作用,术前需准确评估三尖瓣解剖结构、反流病因、右心功能等,以明确手术方式及最佳手术时机;术中通过超声引导指导瓣膜钳夹、瓣环环缩或人工瓣膜置入,术后即刻评估手术效果和残余反流情况。
1.经导管三尖瓣介入治疗术前评估:由于三尖瓣由3个不等大瓣叶构成,术前二维超声评估时应多切面多角度进行探查,三维超声在显示三尖瓣时更有优势。功能性TR患者三尖瓣环扩张常发生于前瓣和后瓣所附着的瓣环,而隔瓣所附着的瓣环变化不大,因而导致瓣环更平、更圆[31]。三尖瓣瓣环的面积在心动周期中变化可达(29.6±5.5)%[32],三维超声可准确测量全心动周期的瓣环径,有助于手术决策。术前结构评估还包括瓣下腱索、乳头肌、右心房、右心室、上下腔静脉以及冠状静脉窦。功能评估包括右心室功能、肺动脉压力和左心功能评估。术前超声评估若三尖瓣PGmean>2~3 mmHg,则行缘对缘修复术可能存在术后狭窄[33]。2017年美国超声心动图学会(ASE)瓣膜反流超声指南[28]推荐多个指标综合评估TR程度,重度TR的判断标准包括反流颈宽度(VC)≥7 mm;有效反流口面积(EROA)≥0.4 cm2;反流容积≥45 ml。其他提示重度TR的特异指标还包括:三尖瓣环扩张;尼奎斯极限在30~40 cm/s,应用血流汇聚法(PISA)测得的血流汇聚区半径>0.9 cm;肝静脉收缩期严重逆向血流;右心室扩大但功能正常。Hahn和Zamorano[34]提出一种新的TR分级方法,分为5级,轻度和中度的判断标准变化不大,主要是将重度TR分为了“severe”(VC 7~13 mm,EROA 40~59 mm2)、“massive”(VC 14~20 mm,EROA 60~79 mm2)和“torrential”(VC≥21 mm,EROA≥80 mm2)。
2.经导管三尖瓣介入治疗术中超声监测和引导(图9):由于三尖瓣瓣叶较纤细,食管中段切面三尖瓣位于远场,以及可能存在左心系统人工瓣膜伪影的干扰,TEE评估三尖瓣较二尖瓣难度大。术中监测时可将探头放置于食管远端进行扫查,对于缘对缘修复技术或瓣膜置换术可应用深胃底三尖瓣短轴切面进行评估和引导。3D TEE能同时显示三尖瓣的3个瓣叶,采用外科视角方便与术者沟通交流,在术中引导起着重要的作用。实时双平面超声能同时多角度显示三尖瓣叶及瓣环,便于追踪找寻输送鞘及引导不同器械完成手术,在术中应用更为广泛。对于TEE图像极差的患者,心腔内超声(intracardiac echocardiography,ICE),尤其是3D ICE显示三尖瓣更有优势,可作为经导管三尖瓣介入治疗术中引导和监测的备选方法。但ICE价格较高,且术中成像可能受输送器的影响,限制了其应用[33]。不同术式术后即刻评估内容略有差异,但总的来说,评估要点包括瓣膜反流程度(瓣口或瓣周)、PGmean,人工瓣膜启闭情况等。


LA为左心房,LV为左心室,RA为右心房,RV为右心室
3.经导管三尖瓣介入治疗术后超声随访:经导管三尖瓣介入治疗仍处于早期阶段,随访研究相对较少。术后超声随访要点包括瓣膜反流(瓣口或瓣周)程度,三尖瓣PGmean较术后即刻有无增加、人工瓣膜或相关器械有无移位,瓣环是否缩小,右心大小、下腔静脉内径、心室功能等。最近一项纳入了7个研究共454例接受经导管三尖瓣介入治疗患者的荟萃分析显示,术后中位随访时间为265 d,死亡率为9%,TR程度明显降低,三尖瓣瓣环明显缩小,但左心室和右心室功能无明显改善[35]。
经皮肺动脉瓣置入术(percutaneous pulmoanry valve implantation,PPVI)主要应用于右心室流出道重建术后并发右心室流出道功能障碍(狭窄或反流)的患者,其中最常见的是法洛四联症外科矫治术后的患者。目前国际上常用的PPVI器械主要分为球囊扩张型瓣膜(Melody和Sapien)和自膨胀支架瓣膜(Venus-P和PT-Valve)两大类。
1.PPVI术前的超声评估:PPVI的手术指征目前尚无统一标准。在评估患者手术时机时,需要考虑患者的症状、基础病变类型,运动耐量、TR严重程度、右心室舒张末期容积指数、右心室射血分数、QRS宽度及心律失常等情况。同时还需要评估患者的右心室流出道解剖是否适宜PPVI。尽管CT和心脏MRI等影像学技术在清晰显示右心室流出道解剖结构、评估右心室容积和功能方面更具优势,TTE仍然是PPVI患者术前评估最常用的影像学工具。术前超声评估患者的右心室的大小,形态及功能,TR情况,右心室流出道、肺动脉及其分支起始部的内径和长度,左心形态及功能有助于评估患者的手术时机,并为瓣膜型号的选择提供参考[36]。
2.PPVI术中的超声评估:TEE和ICE均可用于PPVI术中评估。由于肺动脉瓣位于TEE远场,TEE评估肺动脉瓣难度较大。在常规采用食管中段右心室流入-流出道切面和主动脉短轴切面,以及食管上段主动脉弓短轴切面的基础上联合采用经胃底右心室流入-流出道切面,以及深胃底右心室流入-流出道切面和右心室流出道切面,有助于更好地观察右心室流出道、肺动脉及肺动脉瓣[37]。术中使用ICE则能更加清晰地显示右心室及右心室流出道的解剖结构,观察人工生物瓣置入的位置,评估瓣膜的功能。有研究表明,ICE与TTE测得的肺动脉瓣峰值跨瓣压差相关性良好,且两者在对肺动脉瓣反流程度的评价方面无明显差异[38]。
3.PPVI术后的超声随访:PPVI术后随访超声的作用主要是观察人工生物瓣的功能、评估心室及其他瓣膜的功能。观察内容包括人工生物瓣支架固定情况,人工生物瓣跨瓣压差,是否存在人工生物瓣反流以及反流的位置和程度;评估左心室收缩功能,根据三尖瓣瓣环平面收缩位移及三尖瓣瓣环收缩期峰值速度评价右心室收缩功能;同时还需对其他瓣膜的形态及功能进行评价。
随着经导管瓣膜病介入治疗的发展,超声在心脏瓣膜病的诊断和治疗中扮演着越来越重要的角色。TTE因其便捷、无创的特点,目前仍然是瓣膜病患者术前初步评估和术后随访的一线影像学工具;TEE不受声窗影响,图像更清晰,是术前精准评估和术中实时监测和引导的主要工具;3D TEE具有高质量、高帧频率全心动周期成像的特点,可更全面、更直观地观察心内结构,是术前精准评估、术中引导的最具潜力的工具;ICE从心腔内观察,不受气体干扰,定位精准,对于观察三尖瓣、肺动脉瓣等右心瓣膜更具优势。总之,不同的超声技术各具特点,合理地选择适当的超声成像模式有助于精准评估瓣膜病变、便捷手术操作和提高手术安全性。
所有作者均声明不存在利益冲突
1.经导管主动脉瓣置入术(TAVR)术后即刻评估瓣周反流程度,根据其主要参考标准在主动脉短轴切面反流束长度之和占人工支架周长的比例,以下正确的是( )
A.>40%为重度
B.10%~30%为中度
C.<20%为轻度
D.15%~30%为中度
2.Del Trigo等研究将TAVR术后出现人工瓣膜狭窄定义为随访时平均跨瓣压差较术后基线增加≥( )mmHg
A.10 mmHg
B.20 mmHg
C.30 mmHg
D.40 mmHg
3.经股静脉二尖瓣缘対缘修复术术中房间隔穿刺部位一般选择在房间隔的( )
A.前上方
B.后上方
C.前下方
D.后下方
4.二尖瓣反流患者术前超声测量二尖瓣瓣口面积推荐采用哪种方法进行测量( )
A.2D经胸超声心动图(TTE)胸骨旁二尖瓣短轴切面测量
B.3D经食道超声心动图(TTE)多平面重建法测量
C.3D TEE外科视角直接测量
D.3D TEE多平面重建法测量
5.根据Hahn等提出的新三尖瓣反流(TR)分级方法,若反流颈宽度=17 mm,则TR判断为( )
A.moderate
B.severe
C.massive
D.torrential



























