
本文报道肺淀粉样物质沉积症影像表现1例。患者,男,61岁,胸部CT表现为右肺下叶后基底段团块样占位影,大小约30 mm×40 mm,边界清楚,边缘不规则,密度均匀,CT值约43 HU,增强扫描未见明显强化。病理诊断:考虑肺淀粉样物质沉积症。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者 男,61岁,因全身多关节疼痛20余年,双膝关节疼痛2个月于2018年12月24日就诊,以"痛风、糖尿病"为诊断入院。体检:双指关节可见多处痛风石,余未见明显异常。实验室检查:餐后3 h血糖14 mmol/L,嗜酸细胞0.2%,红细胞3.84×1012/L,血红蛋白98 g/L,血小板433×109/L,红细胞沉降率120 mm/H,C-反应蛋白>200 mg/L。
影像检查:胸部CT示右肺下叶后基底段见团块样占位(图1),大小约30 mm×40 mm,边界清楚,边缘不规则,密度均匀,CT值约43 HU(图2),增强后CT值约46 HU(图3),动脉期、门脉期、平衡期CT值分别为46、47、48 HU。
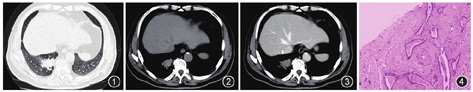

细胞学检查:刷检及灌洗液涂片均未见异常细胞。结核基因GeneXpert检测未检出。新型隐球菌荚膜抗原测定阴性。痰细菌培养及鉴定正常菌群生长;真菌培养7 d未见真菌生长。免疫组织化学染色:腺上皮细胞角蛋白7(CK7)、胃酶样天冬氨酸蛋白酶A(Napsin A)、甲状腺转录因子1(TTF1)、CK5/6、P63、P40均呈阳性,细胞膜增殖抗体Ki-67部分阳性,突触素(Syn)、CD56、嗜铬素(CgA)均呈阴性。于2019年1月7日行CT定位下右肺下叶肿物穿刺,病理表现:显微镜下见间质纤维黏液样组织增生伴红染絮状物沉积,其内见不规则腺管(图4),病理诊断:考虑肺淀粉样物质沉积症。
淀粉样变性是因一种不能溶解的纤维状蛋白在机体组织器官的细胞外沉积,染色后显微镜下表现为淀粉样无定型基质而得名。淀粉样物质沉着于器官或组织的细胞外区,会导致器官或组织功能障碍[1]。肺淀粉样变性的基本病变是淀粉样物质沉积在肺气管及支气管黏膜或弥漫在肺泡间隔、血管壁或在肺内形成孤立结节,典型组织学表现为致密无定形、云絮状嗜酸性物质聚集在黏膜上间质,呈片状分布,局限在肺的淀粉样变少见[2,3,4]。经支气管镜或肺穿刺活检可以确诊。本例病灶局限在右肺下叶后基底段。
由于肺淀粉样物质沉积症是淀粉样蛋白在肺内的结节样积蓄,所以病灶内无血管供应,没有坏死区域,CT平扫密度均匀,增强扫描未见强化,这是该病例反映出的影像病理特征。本例病灶CT平扫显示右下肺占位,密度均匀,无典型胸膜凹陷、分叶征象,未见充气支气管征,增强后病灶无明显强化。近年来研究发现淀粉样变性损伤与局部细胞毒素,局部受体的相互作用和自由基损伤以及细胞凋亡机制有关[5,6],本例患者老年男性,并发痛风、糖尿病病史,可能与免疫力较低有关。
所有作者均声明不存在利益冲突



























