
实性肾细胞癌中最常见的亚型包括透明细胞癌、乳头状细胞癌及嫌色细胞癌,本文总结了3种常见肾细胞癌亚型的影像学特征,并同主要的良恶性肿瘤及类肿瘤性病变进行鉴别诊断,包括肾脏集合管癌、淋巴瘤、转移瘤、嗜酸细胞腺瘤、血管平滑肌脂肪瘤以及肾梗死等,旨在使影像科和泌尿科医师更好地认识实性肾细胞癌的影像学特点,从而理解及掌握其鉴别诊断。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾脏实性肿块中以肾细胞癌最为常见,其中最常见的亚型包括透明细胞癌、乳头状细胞癌和嫌色细胞癌。影像学检查的目的是将肾细胞癌与其他良恶性病变区分开来,并提供肿瘤的分期诊断等信息,为临床医师提供更多的术前诊断及制定治疗方案的依据。在肾脏病灶的术前定位、定性及分期诊断中,CT及MRI等检查手段是必不可少的[1]。
CT对成熟脂肪及钙化、囊性成分等的检测比较敏感,因此对于肿瘤的定性及分期诊断有较高的价值。CT上如果肾脏肿瘤中有肉眼可见的成熟脂肪成分,则是血管平滑肌脂肪瘤(angiomyolipoma,AML)的可靠征象。但要注意在极少数情况下,肾细胞癌也可能含有脂肪,尤其当钙化和脂肪同时存在时,应考虑肾癌的可能。MRI在肾脏肿瘤性病变诊断中具有很高的价值,尤其是结合扩散加权成像(diffusion weighted imaging,DWI)、同反相位成像等序列,对于肾脏肿瘤性病变的诊断及鉴别诊断具有重要意义。T1WI上的高信号通常见于含出血性或富蛋白成分以及含有成熟脂肪的肿瘤。T2WI上的低信号见于含血性成分、钙化或富含纤维成分的肿瘤。MRI可通过同反相位序列中反相位的信号减低而识别细胞内的脂质或脂肪变性,约80%的肾透明细胞癌中有细胞内脂质或脂肪变性,因此反相位信号减低对透明细胞癌的诊断有很高的特异性。同时MRI对囊性病变及出血性病变的诊断也优于CT,并对肿瘤周边富含纤维组织的假包膜显示率较高,还能更好地显示病变的强化[2]。
2016版WHO肾脏肿瘤的病理分类中,肾细胞肿瘤中最常见的是肾细胞癌,其中肾透明细胞癌占比例最高,其次是肾乳头状细胞癌及嫌色细胞癌。
1.肾透明细胞癌:是最常见的肾细胞癌亚型,占所有肾细胞癌的70%~80%。肾透明细胞癌起源于肾皮质,是富血管肿瘤,密度或信号常因肿瘤内存在坏死、出血、囊性成分或钙化而不均匀,极少数情况下,肾透明细胞癌也可含有细胞外脂肪。肾透明细胞癌患者的5年生存率为50%~60%,较乳头状或嫌色细胞癌差[3, 4, 5, 6]。约5%的肾透明细胞癌呈浸润性生长,具有更高的侵袭性和富血管性,可以在肾实质内浸润生长而保留肾脏轮廓。
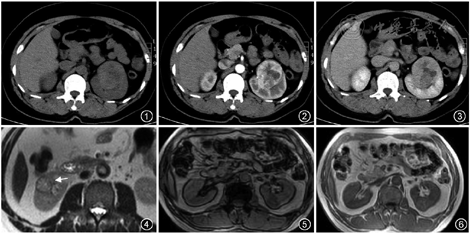
肾透明细胞癌的CT平扫可为等、稍高或稍低密度(图1)。在MRI上,透明细胞癌通常在T1WI上呈等、低信号,在T2WI上呈高信号,DWI上呈较明显的扩散受限改变[3]。透明细胞癌增强的典型特征是肾皮质期的明显不均匀强化[4](图2),有“速升速降”的增强特点。增强皮质期多与肾皮质的高强化相似,故较小病变于肾皮质期可能因为肾皮质本身的高强化而显示不明显,反而于肾实质期因肾实质本身的均匀高强化使得病变显示更清晰(图3)。部分肿瘤可有假包膜,主要为周围的纤维性包膜以及被挤压的肾实质,在T2WI上呈低信号环(图4)。约80%的透明细胞癌有细胞内脂质或脂肪变性,从而导致反相位图像的信号强度较同相位图像信号减低[4](图5,6)。


2.肾乳头状细胞癌:占肾细胞癌的10%~15%,其5年生存率为80%~90%[3, 4, 5, 6]。较大的乳头状细胞癌可因坏死、出血或钙化而显示密度或信号不均匀,部分可见假包膜。
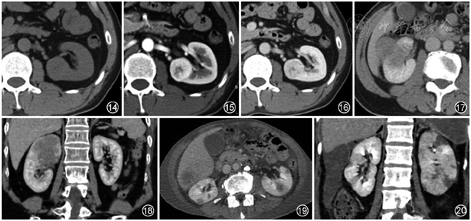
肾乳头状细胞癌CT平扫呈等及稍高密度,MRI T1WI上呈等、低信号,如含血性成分则在T2WI上呈低信号(图7)。与透明细胞癌不同,乳头状细胞癌的强化程度低,以轻度不均匀强化常见,增强图像CT值仅增加10~20 HU[3, 5, 6](图8,9)。肾乳头状细胞癌多表现为皮质期强化较低,强化程度随时间延迟可有略增高趋势,呈“缓慢升高”型。
3.肾嫌色细胞癌:占肾细胞癌的4%~8%。肿瘤呈实性,中心多位于肾髓质,呈膨胀性生长,边界清楚,可稍有分叶状。肾嫌色细胞癌的增强常较透明细胞癌均匀且强度低,但较乳头状细胞癌强化程度高。肾嫌色细胞癌的预后与乳头状肾细胞癌相似,5年生存率为80%~90%[3, 4, 5, 6]。
肾嫌色细胞癌于MRI平扫T1WI上呈等或稍低信号,T2WI呈稍低信号,近30%肿瘤中心可见星芒状或轮辐状改变(图10)。嫌色细胞癌属少血供肿瘤,皮质期多为轻中度强化,实质期肿瘤强化形式多样,多数较皮质期强化明显,且强化相对均匀(图11,12),肿瘤较小时,其密度均匀,很少出现坏死、出血和囊性变,超过38%肿瘤可出现钙化,钙化呈片状,境界可清楚或模糊(图11)。肾脏肿瘤若大于7 cm,出现均匀一致的轻度强化且伴钙化,则强烈提示为肾嫌色细胞癌[7, 8, 9]。

1.AML:AML是肾脏最常见的实性良性肿瘤,属血管周上皮样细胞肿瘤(perivascular epithelioid tumor,PEComa)家族,女性多见。80%散发,20%可伴结节性硬化或淋巴管肌瘤病[10]。其内由不同比例的血管组织、平滑肌和脂肪组成。如果肾脏实性肿块在CT或MRI上含有成熟脂肪,则基本可以作出AML的诊断。AML内钙化或坏死罕见。
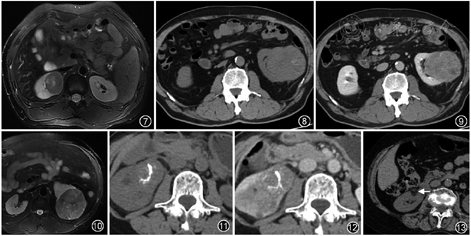
AML最典型的影像特征是其内的脂肪成分。因病变内含平滑肌成分,可于T2WI上呈现低信号。AML为良性肿瘤,生长缓慢,可出现“劈裂征”或“杯口征”改变(图13),即在皮质内生长的肿瘤缓慢向肾外膨胀生长,最终突破皮质并将相邻的皮质掀起或挤压所致。增强扫描AML强化不均匀,肿瘤内血管成分多明显强化,平滑肌成分也显示增强,而脂肪成分几乎不增强。约5%的AML在影像上没有明显的脂肪成分,即为少脂肪型或乏脂型AML,与肾细胞癌鉴别困难。
2.嗜酸细胞腺瘤:嗜酸细胞腺瘤是肾脏第二常见的良性实性肿块,占实性肾肿瘤的3%~7%[11],老年男性多见。肿块内的钙化罕见。CT平扫病灶密度相对较高(图14),增强的峰值出现在肾皮质期。中心星状瘢痕是肾脏嗜酸细胞腺瘤的特征性改变,是由病变中心的纤维结缔组织呈星状向病变周围放射性分布而形成,其在嗜酸细胞腺瘤中的发生率约33%,特别是大于2.5 cm的病灶[11],常呈渐进性强化(图15,16)。嗜酸细胞腺瘤的不同部分可在动态增强的不同时期出现不同程度的强化,如部分在皮质期呈高强化而在排泄期呈低强化,而部分则在皮质期呈低强化而在排泄期呈高强化,即节段性强化反转。
3.肾集合管癌:在肾肿瘤中少见,不足1%[4]。肿瘤常较大,以肾髓质为中心,具有较高侵袭性,属少血供肿瘤,T2WI呈低信号,以轻中度强化常见,但强化程度较乳头状肾细胞癌显著。肾集合管癌恶性征象明显,肿瘤形态多不规则,境界模糊不清,易累及肾盂,伴淋巴结和远处转移[4](图17)。
4.淋巴瘤:肾脏是淋巴瘤常见的结外受累脏器,常见非霍奇金淋巴瘤。肾淋巴瘤通常表现为多发性低强化肿块(图18),但也可能表现为腹膜后肿瘤直接侵犯肾脏或肾周软组织肿块、腹膜后多发淋巴结肿大。
5.转移瘤:最常转移到肾脏的原发性恶性肿瘤是肺癌、乳腺癌、胃肠道肿瘤和黑色素瘤。肾转移瘤通常为多灶性和双侧性,呈浸润性生长[4](图19)。在少数情况下,肾转移瘤可能表现为孤立性病变,此时难以与肾细胞癌鉴别。转移瘤多数为轻度强化,强化程度远低于正常肾实质,但部分可为富血供,如黑色素瘤和部分乳腺癌的转移瘤。
6.肾梗死:肾梗死常由肾动脉栓塞引起,房颤、动脉硬化是肾动脉栓塞的高危因素。肾梗死常见的临床表现为急性腰痛和血尿。急性期CT表现为楔形低强化区(图20),晚期局部肾萎缩。当整个肾脏梗死时,肾脏增大,呈低密度。有时病变处近外缘肾皮质可以通过侧支循环而仍有强化,形成“皮质边缘征”。
综上所述,在诊断肾脏实性肿块时,首先要考虑发病率最高的肾细胞癌,其中最常见的肾透明细胞癌,可因含有细胞内脂质而于MRI反相位信号减低,病变常见坏死、出血、囊变而密度或信号混杂,增强扫描强化不均匀,肾皮质期明显强化,有“速升速降”的增强特点。肾乳头状细胞癌内易合并出血,增强扫描强化幅度在3种常见肾细胞癌中最低。肾嫌色细胞癌常呈较均匀密度肿块,坏死不常见,可见中心星状瘢痕,增强扫描肿块强化程度较透明细胞癌低。
中华医学会放射学分会腹部学组对本栏目给予大力支持
所有作者均声明不存在利益冲突
1. 关于肾细胞癌,以下说法正确的是()
A. 以透明细胞型肾细胞癌最为常见
B. 成人最常见类型是肾乳头状细胞癌
C. 肾嫌色细胞癌是肾癌最常见的病理类型
D. 儿童最常见的肾癌类型是透明细胞癌
E. 肾乳头状细胞癌及嫌色细胞癌是肾脏最常见的两种类型
2. 下列肾脏肿瘤中,通常增强扫描强化程度最高的是()
A. 嗜酸细胞腺瘤
B. 肾集合管癌
C. 肾淋巴瘤
D. 肾嫌色细胞癌
E. 肾透明细胞癌
3. 在下列肾脏实性肿瘤中,通常情况下增强扫描时强化幅度最低的是()
A. 嗜酸细胞腺瘤
B. 肾乳头状细胞癌
C. 肾血管平滑肌脂肪瘤
D. 肾嫌色细胞癌
E. 肾透明细胞癌
4. 肾脏肿瘤若大于7 cm,均匀一致的轻度强化且伴钙化,则强烈提示为()
A. 嗜酸细胞腺瘤
B. 肾乳头状细胞癌
C. 肾血管平滑肌脂肪瘤
D. 肾嫌色细胞癌
E. 肾透明细胞癌
5. 若一实性肾脏肿瘤,可见中心星状瘢痕征,同时增强扫描还可见节段性强化反转表现,则高度提示为( )
A. 嗜酸细胞腺瘤
B. 肾乳头状细胞癌
C. 肾血管平滑肌脂肪瘤
D. 肾嫌色细胞癌
E. 肾透明细胞癌



























