
探讨胸部CT定量指标在新型冠状病毒肺炎(COVID-19)临床分型及肺损伤严重程度评价中的价值。
回顾性分析华中科技大学同济医学院附属同济医院2020年1月1日至2020年4月1日COVID-19确诊的438例患者的临床及CT影像资料。临床分型为普通型146例、重型247例、危重型45例。使用人工智能(AI)深度学习定量分析所有患者胸部CT指标,包括全肺体积、全肺感染体积、磨玻璃密度体积(GGO体积,CT值<-300 HU)和实性密度体积(SO体积,CT值≥-300 HU)以及SO体积/GGO体积。采用Kruskal-Wallis检验对各临床分型之间定量参数的差异性进行统计学分析,采用多元有序logistic回归分析定量参数与临床分型之间的相关性。
438例COVID-19确诊患者中,重型及危重型患者的年龄较大(P<0.05),且危重型患者以男性为主(P<0.05)。各临床分型患者的临床表现均主要以发热为主,其次为咳嗽、乏力、胸闷、呼吸困难、消化道症状等。3种临床分型肺部病变的CT表现均以GGO为主;全肺感染体积、GGO体积、SO体积以及各自在全肺体积的比例均从普通型、重型到危重型患者逐渐增大(P<0.01);SO体积/GGO体积随临床分型严重程度增加逐渐增大[普通型为0.12(0.03,0.34),重型为0.29(0.11, 0.59),危重型为0.61(0.39,0.97),P<0.05]。多元有序logistic回归分析显示全肺感染体积(OR=1.009)、SO体积/GGO体积(OR=1.866)、GGO体积(OR=1.008)和SO体积(OR=1.016)对临床分型的严重程度产生显著的正向影响关系(P<0.01)。
基于AI胸部CT定量指标(SO体积、GGO体积、SO体积/GGO体积)与COVID-19肺炎临床严重程度密切相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
新型冠状病毒肺炎(COVID-19)是由新型冠状病毒引起的传染性较强的肺部感染性疾病,临床分为轻型、普通型、重型及危重型4种临床类型,其中轻型及普通型预后较好,重型及危重型预后较差[1, 2, 3]。因此,尽早识别COVID-19临床分型,在临床治疗及预后判断中起着至关重要的作用。胸部CT是辅助核酸检查诊断COVID-19的重要工具[4],其在早期筛查中具有灵敏度高、漏诊率低的优势[5]。COVID-19病灶在CT上主要表现为磨玻璃密度(ground glass opacification,GGO)及实性密度(solid opacification,SO),其中GGO最常见,发生率高达98%[6, 7]。CT值=-300 HU常被作为定量鉴别GGO和SO的阈值[8]。目前,随着人工智能(artificial intelligence,AI)软件在COVID-19诊断中的开发和应用,通过AI手段评价COVID-19得到广泛开展[9]。除使用AI辅助诊断系统识别COVID-19特征病灶以实现诊断并进行病灶肺段定位之外,计算病灶体积以及采用CT值对病灶类型进行定量划分在COVID-19病情评估以及病情发展判定上也具有重要意义[10, 11, 12]。目前关于肺部感染体积以及GGO病灶和SO病灶在COVID-19各临床分型中的定量评价和比较的研究鲜见。本研究旨在使用深度学习工具分割肺部病灶范围,从而定量计算全肺感染病灶体积,并根据CT阈值将病变分为GGO病灶(CT值<-300 HU)和SO病灶(CT值≥-300 HU),探讨不同临床分型患者的CT影像特征以及肺部病灶对临床肺损伤严重程度的影响。
回顾性分析2020年1月1日至4月1日华中科技大学同济医学院附属同济医院确诊的COVID-19患者的临床资料和首次CT影像资料。纳入标准:(1)咽拭子核酸检测(逆转录取合酶链反应)阳性,且排除其他已知病毒性肺炎及支原体、衣原体肺炎;(2)符合中华人民共和国国家卫生健康委员会《新型冠状病毒感染的肺炎诊疗方案》(试行第七版)[1]诊断标准中的普通型、重型和危重型患者。排除标准:(1)首次胸部CT图像有明显伪影;(2)深度学习自动分割效果评分<3分。最终纳入438例COVID-19患者,其中男230例,年龄24~91(62±13)岁;女208例,年龄24~89(62±12)岁;普通型146例、重型247例、危重型45例。记录所有患者初次就诊的临床表现和既往病史。本研究经华中科技大学同济医学院附属同济医院医学伦理委员会批准(批准号:TJ-C20201001)。
采用中国联影uCT 780、美国GE Optima 660、德国Siemens Somatom Definition AS 128 CT扫描仪。患者采用仰卧位,在吸气屏气时扫描。扫描范围从肺尖到肺底。扫描参数:管电压80~120 kV,管电流50~350 mAs,螺距0.99~1.22 mm,矩阵512×512,层厚10 mm,视野350 mm×350 mm。采用多平面重组(multiplanar reconstruction,MPR)技术,重组层厚0.625~1.250 mm,肺窗:窗宽1 200 HU,窗位-600 HU;纵隔窗:窗宽350 HU,窗位40 HU。
采用AI软件[北京推想肺炎特别版,(InferRead CT Pneumonia)v1.0.0.0]进行CT图像深度学习分析,以获得全肺肺炎病灶体积、GGO病灶体积(CT值<-300 HU)和SO病灶体积(CT值≥-300 HU)及其占全肺比例。该算法包括两个模块:(1)肺部炎性病灶分割模块:基于深度学习框架来学习胸部CT图像中提取的不同特征和ROI(肺和高密度影)之间复杂的关系。采用成熟的算法卷积神经网络结构在COVID-19肺部CT的标注数据集上进行训练[10];(2)定量分析模块:基于肺和病变的分割结果,使用定量分析模块测量全肺感染的定量数据。Lu等[11]研究阐明推想肺炎特别版软件的研究队列、训练集、测试集及外部验证集的建立过程,并从临床角度证明了该版本AI软件系统自动分割的准确性。
由两名具有丰富工作经验的放射科医师在双盲的情况下对分割结果进行独立评分。使用Likert 5分制评分标准[11]:0分,至少1个层面内出现大面积的假阳性或假阴性轮廓,或至少3个层面内出现中等大小面积的假阳性或假阴性轮廓;1分,在未达到0分标准基础上,至少有1个层面内出现中等大小的假阳性或假阴性轮廓;2分,存在假阳性和假阴性轮廓,但未达到1分的标准;3分,所有ROI层面无明显假阳性或假阴性轮廓;4分,所有ROI层面内无假阳性或假阴性轮廓,但分割效果未达到5分水平;5分,所有层面的自动分割结果与实际病灶的分割非常吻合。评分≥3分被认为足够满足定量分析要求。最终两名医师评分均≥3的病例纳入本项研究。
采用SPSS 22.0统计分析软件。计数资料采用例数表示,3组间比较采用χ²检验或Fisher确切概率法, 当差异有统计学意义,进一步采用χ²检验或Fisher确切概率法进行两两比较,并采用Bonferroni法进行校正。使用Kolmogorov-Smirnov检验对计量资料进行正态性检验,非正态分布采用M(Q1,Q3)表示,3组间比较采用Kruskal-Wallis检验,两两比较采用Mann-Whitney U检验。对单因素分析中有统计学意义的变量以及专业上认为对结局有影响的变量纳入多元有序logistic回归模型中探讨结局的独立影响因素。P<0.05为差异有统计学意义。
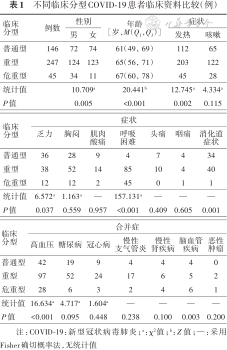
患者中重型及危重型年龄较大(P<0.05),且危重型患者以男性为主(P<0.05)。各临床分型患者的临床表现均以发热为主,其次为咳嗽、乏力、胸闷、呼吸困难、消化道症状等。发热作为COVID-19患者快速诊疗的主要症状,在本研究中表现为从普通型到危重型的比例逐渐增大(P=0.002)。同时,呼吸困难明显随着临床分型的加重而更为普遍(P<0.001);此外,危重型患者往往合并慢性基础疾病,在本研究中以高血压最为常见(62.2%,28/45)(表1)。
不同临床分型COVID-19患者临床资料比较(例)
不同临床分型COVID-19患者临床资料比较(例)
| 临床 分型 | 例数 | 性别 | 年龄 [岁,M(Q1,Q3)] | 症状 | ||
|---|---|---|---|---|---|---|
| 男 | 女 | 发热 | 咳嗽 | |||
| 普通型 | 146 | 72 | 74 | 61(49, 69) | 112 | 65 |
| 重型 | 247 | 124 | 123 | 65(56, 71) | 203 | 122 |
| 危重型 | 45 | 34 | 11 | 67(60, 78) | 45 | 28 |
| 统计值 | 10.709a | 20.441b | 12.745a | 4.334a | ||
| P值 | 0.005 | <0.001 | 0.002 | 0.115 | ||
临床 分型 | 症状 | ||||||
|---|---|---|---|---|---|---|---|
| 乏力 | 胸闷 | 肌肉 酸痛 | 呼吸 困难 | 头痛 | 咽痛 | 消化道 症状 | |
| 普通型 | 36 | 28 | 9 | 4 | 7 | 4 | 34 |
| 重型 | 38 | 52 | 14 | 85 | 10 | 4 | 40 |
| 危重型 | 12 | 12 | 2 | 45 | 0 | 1 | 1 |
| 统计值 | 6.572a | 1.163a | — | 157.131a | — | — | — |
| P值 | 0.037 | 0.559 | 0.957 | <0.001 | 0.409 | 0.605 | 0.001 |
临床 分型 | 合并症 | ||||||
|---|---|---|---|---|---|---|---|
| 高血压 | 糖尿病 | 冠心病 | 慢性 支气管炎 | 慢性 肾疾病 | 脑血管 疾病 | 恶性 肿瘤 | |
| 普通型 | 42 | 19 | 9 | 4 | 4 | 4 | 0 |
| 重型 | 97 | 52 | 24 | 17 | 6 | 5 | 2 |
| 危重型 | 28 | 6 | 3 | 2 | 4 | 6 | 1 |
| 统计值 | 16.634a | 4.717a | 1.604a | — | — | — | — |
| P值 | <0.001 | 0.095 | 0.448 | 0.238 | 0.100 | 0.003 | 0.200 |
注:COVID-19:新型冠状病毒肺炎;a:χ²值;b:Z值;—:采用Fisher确切概率法,无统计值
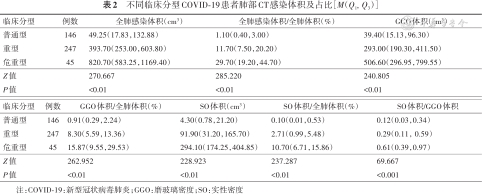
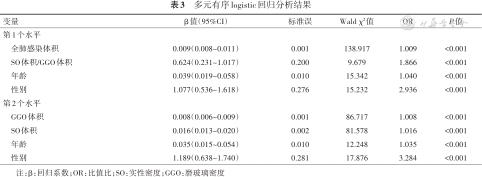
推想肺炎特别版软件分析工作界面如图1所示。全肺感染体积、GGO体积以及SO体积均从普通型、重型到危重型患者逐渐增大(P<0.05);全肺感染体积/全肺体积以及GGO体积/全肺体积和SO体积/全肺体积同样均随临床分型的级别增高逐渐增大(P<0.05);3个临床分型的肺部病变均以GGO为主,但是GGO体积占全肺感染病灶的比例从普通型、重型到危重型逐渐减小(P<0.05);SO体积/GGO体积随临床分型严重程度增加逐渐增大(P<0.05)(表2)。有序多元logistic回归分析中,对共同自变量(年龄、性别)进行了两个水平的分析,第1个水平自变量为年龄、性别、全肺感染体积、SO体积/GGO体积,因变量为普通型、重型和危重型;第2个水平自变量为年龄、性别、GGO体积、SO体积,因变量为普通型、重型和危重型。第1个水平中全肺感染体积、SO体积/GGO体积均对临床分型的严重程度产生显著的正向影响关系(P<0.01);第2个水平中,GGO体积和SO体积对临床分型产生显著的正向影响关系(P<0.001)(表3)。

不同临床分型COVID-19患者肺部CT感染体积及占比[M(Q1, Q3)]
不同临床分型COVID-19患者肺部CT感染体积及占比[M(Q1, Q3)]
| 临床分型 | 例数 | 全肺感染体积(cm³) | 全肺感染体积/全肺体积(%) | GGO体积(cm³) |
|---|---|---|---|---|
| 普通型 | 146 | 49.25(17.83,132.88) | 1.10(0.40,3.00) | 39.40(15.13,96.30) |
| 重型 | 247 | 393.70(253.00,603.80) | 11.70(7.50,20.20) | 293.00(190.30,411.50) |
| 危重型 | 45 | 820.70(583.25,1169.40) | 29.70(19.20,44.70) | 506.60(296.95,799.55) |
| Z值 | 270.667 | 285.220 | 240.805 | |
| P值 | <0.01 | <0.01 | <0.01 |
| 临床分型 | 例数 | GGO体积/全肺体积(%) | SO体积(cm³) | SO体积/全肺体积(%) | SO体积/GGO体积 |
|---|---|---|---|---|---|
| 普通型 | 146 | 0.91(0.29,2.24) | 4.30(0.78,21.20) | 0.10(0.01,0.53) | 0.12(0.03,0.34) |
| 重型 | 247 | 8.30(5.59,13.36) | 91.90(31.20,165.70) | 2.71(0.99,5.48) | 0.29(0.11, 0.59) |
| 危重型 | 45 | 15.87(9.55,29.53) | 294.10(174.25,404.85) | 10.70(6.71,15.86) | 0.61(0.39,0.97) |
| Z值 | 262.952 | 228.923 | 237.287 | 69.667 | |
| P值 | <0.01 | <0.01 | <0.01 | <0.001 |
注:COVID-19:新型冠状病毒肺炎;GGO:磨玻璃密度;SO:实性密度
多元有序logistic回归分析结果
多元有序logistic回归分析结果
| 变量 | β值(95%CI) | 标准误 | Wald χ2值 | OR | P值 |
|---|---|---|---|---|---|
| 第1个水平 | |||||
全肺感染体积 | 0.009(0.008~0.011) | 0.001 | 138.917 | 1.009 | <0.001 |
SO体积/GGO体积 | 0.624(0.231~1.017) | 0.200 | 9.679 | 1.866 | <0.001 |
年龄 | 0.039(0.019~0.058) | 0.010 | 15.342 | 1.040 | <0.001 |
性别 | 1.077(0.536~1.618) | 0.276 | 15.232 | 2.936 | <0.001 |
| 第2个水平 | |||||
GGO体积 | 0.008(0.006~0.009) | 0.001 | 86.717 | 1.008 | <0.001 |
SO体积 | 0.016(0.013~0.020) | 0.002 | 81.578 | 1.016 | <0.001 |
年龄 | 0.035(0.015~0.054) | 0.010 | 12.248 | 1.035 | <0.001 |
性别 | 1.189(0.638~1.740) | 0.281 | 17.876 | 3.284 | <0.001 |
注:β:回归系数;OR:比值比;SO:实性密度;GGO:磨玻璃密度
相关研究表明,COVID-19肺炎的临床严重程度与CT显示的肺受累情况相关[13]。本研究借助COVID-19深度学习软件定量分析可以发现,随着临床分型的提高,COVID-19患者肺部病灶范围呈现递增趋势,表现为全肺感染体积及其占全肺体积的比例逐渐增加,这也与先前黄璐等[14]的结论一致;AI软件基于CT值阈值将全肺感染体积划分为GGO体积及SO体积,两部分体积及各自占全肺体积的比例均随临床分型的级别增高逐渐增大,对临床分型的严重程度产生显著的正向影响关系,表明GGO体积和SO体积越大患者的临床分型越严重。这也与COVID-19的病情动态发展的特征相似[15]。与此同时,临床观察中SO体积常被认为与病情严重程度密切相关,并被作为评价COVID-19患者病情严重程度的重要指标[12, 16, 17]。因此,笔者提出两者的体积比——SO体积/GGO体积这一参数,并证明了SO体积/GGO体积随临床分型加重而增大。同时,SO体积/GGO体积对临床的严重程度产生显著的正向影响关系,这提示尽管随着临床分型的加重,GGO体积和SO体积均在增加,但两者对临床分型产生的影响程度不同,SO部分相对于GGO部分对肺功能的损伤程度更大。这也在COVID-19肺炎的病理机制中得到证实,即COVID-19患者肺部病理改变主要为肺泡损伤和炎性渗出,GGO病变考虑是感染导致肺泡肿胀、肺泡腔少量渗出、肺泡间隔炎性反应以及透明膜形成导致的肺内密度稍高[7]。随着肺泡腔及间隔内炎性渗出增加,肺泡腔逐渐被细胞纤维黏液样渗出物、炎症细胞、水肿、出血取代,使肺组织密度大于肺内血管密度,表现为实性改变,边界相对清晰[7, 18]。因此,本研究中GGO部分相对于SO部分对肺功能的损伤程度轻,是各临床分型的主要影像学表现,病理上为SO病灶早期,提示为部分肺功能受损。
本研究存在以下不足:(1)目前已有纵向研究证明了AI在COVID-19患者病情发展及预后评价中的价值[13],本研究中仅从横向角度分析比较不同临床分型患者的CT定量特征,还有待开展进一步的研究评价SO体积/GGO体积等在预后评价中的价值。(2)本研究未对病变的肺叶分布等其他因素对病情的影响进行探讨,而仅探讨了肺部病变范围对病情的影响。(3)COVID-19胸部CT的AI定量指标还缺乏病理学证实。
综上所述,COVID-19肺炎CT表现是随着临床分型的加重表现为病变整体范围的扩大以及炎性渗出负担加重。基于AI胸部CT定量指标(SO、GGO、SO体积/GGO体积)可以对COVID-19不同临床分型患者肺损伤程度进行客观评价。其中,GGO为COVID-19的主要影像学成分,但其肺损伤程度较SO部分肺组织轻;SO体积/GGO体积可作为COVID-19肺炎临床分级的指标,与病情严重程度相关。
所有作者均声明不存在利益冲突



























