
腮腺肿瘤性病变的病理类型复杂多样,术前对腮腺良性与恶性肿瘤的准确判断对手术方式的选择及预后具有重要意义。本文中探讨腮腺肿瘤性病变的影像学诊断思路及功能MRI的诊断价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,每年从第1期至第10期共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
涎腺肿瘤是颌面头颈部的常见肿瘤,占头颈部肿瘤的3%~5%[1],近80%的涎腺肿瘤发生于腮腺。腮腺肿瘤的病理类型复杂,以良性肿瘤多见,良、恶性肿瘤比例约为7∶1,多形性腺瘤和腺淋巴瘤是最常见的腮腺良性肿瘤,黏液表皮样癌和腺样囊性癌为最常见恶性肿瘤[2]。手术切除是腮腺肿瘤最有效的治疗方法,不同的肿瘤组织学类型,其手术方式不同。多形性腺瘤存在恶性转化及术后复发的风险,通常采用根治性手术切除[3]。腺淋巴瘤多采取肿瘤摘除术或保守性观察[4]。而腮腺恶性肿瘤则需要扩大切除术。因此,术前对涎腺肿瘤性质的准确评估,对临床治疗方案的选择有重要的指导意义。
CT是腮腺肿瘤的基本检查技术,能够显示肿瘤的位置、形态、大小、边界、是否钙化等形态学特征,但仅凭CT检查进行定性诊断较为困难,根据本团队的临床经验,CT对腮腺肿瘤的诊断准确度仅为50%~60%。MRI的软组织分辨力高,能够更清晰显示腮腺肿瘤的内部信号、增强表现等特征,是腮腺肿瘤定性诊断的重要检查方法。腮腺良性肿瘤多位于腮腺浅叶,形态呈圆形或类圆形,边界清晰光整。恶性肿瘤多位于腮腺深叶,或跨深、浅叶分布,形态不规则,边界不清,浸润邻近结构。本团队既往研究表明,腮腺良性肿瘤与恶性肿瘤的形态和包膜有显著差异,但常规MRI对腮腺肿瘤诊断的灵敏度、特异度及准确度仅为72.3%、90.1%、86.5%[5]。
目前,DWI、动态对比增强(dynamic contrast-enhanced,DCE)-MRI、MRS等功能MRI技术已广泛应用于腮腺肿瘤的术前检查,对肿瘤的早期诊断和治疗方案的选择有重要的指导意义。DWI能敏感地反映水分子的扩散受限情况,还可以通过测量ADC值对水分子扩散受限进行定量分析[6]。DCE-MRI能反映肿瘤的微血管密度及血流灌注情况。时间信号强度曲线(time intensity curve,TIC)类型可直观地反映肿瘤的动态强化特征和血供特点。根据达峰时间(the time to peak,Tpeak)和廓清率(washout ratio,WR)不同,TIC分为4种类型:A型(持续型),Tpeak>120 s,病灶渐进性强化;B型(廓清型),Tpeak≤120 s,WR≥30%,病灶快速强化、快速廓清;C型(平台型),Tpeak≤120s,WR<30%,病灶快速强化、缓慢廓清;D型(平坦型),提示病灶无强化[7, 8]。MRS能够进行化合物定量分析,胆碱(glycerophosphocholine,Cho)峰主要位于3.20 ppm处,标志着细胞膜的代谢,Cho峰升高表明肿瘤细胞增殖活跃。研究表明,常规MRI联合2项功能MRI,诊断腮腺良、恶性肿瘤的准确度可提高至91.2%[5]。Zhu等[9]的研究发现,常规MRI联合3项功能MRI,对腮腺结外边缘区B细胞黏膜相关淋巴组织(mucosa-associated lymphoid tissue,MALT)淋巴瘤诊断准确度可接近100%。本文中,探讨腮腺肿瘤性病变的影像学诊断思路及功能MRI的诊断价值。
1.多形性腺瘤:在涎腺肿瘤中最常见,约占所有涎腺肿瘤的60%。发病年龄较为广泛,平均年龄为46岁,女性略多见。多形性腺瘤生长缓慢,主要表现为无痛性、孤立性软组织肿块,以腮腺浅叶多见,也可位于深叶。肿瘤多呈圆形或类圆形,分叶状,边界清晰,T2WI可见肿块周围弧形线样低信号包膜。较小的病变,CT一般呈密度均匀的软组织肿块;较大的病变,CT呈密度不均的软组织肿块,其内可见低密度液化坏死和囊变区,有时病灶内可见钙化。MRI上,T1WI多呈低或等信号,T2WI多为不均匀高信号(图1),其内部黏液样组织部分呈更高信号。DWI多呈扩散受限表现,ADC值为(1.43±0.26)×10-3 mm2/s(b值为0、1 000 s/mm2,图2)[5]。Merino等[10]提出ADC值>1.4×10-3 mm2/s高度提示多形性腺瘤。由于多形性腺瘤的肿瘤微血管密度低,且含软骨样间质,TIC多呈A型(持续型,图3,4)。Lam等[11]研究表明>90%的A型TIC肿瘤是多形性腺瘤。MRS上3.20 ppm处一般无明显升高的Cho峰。
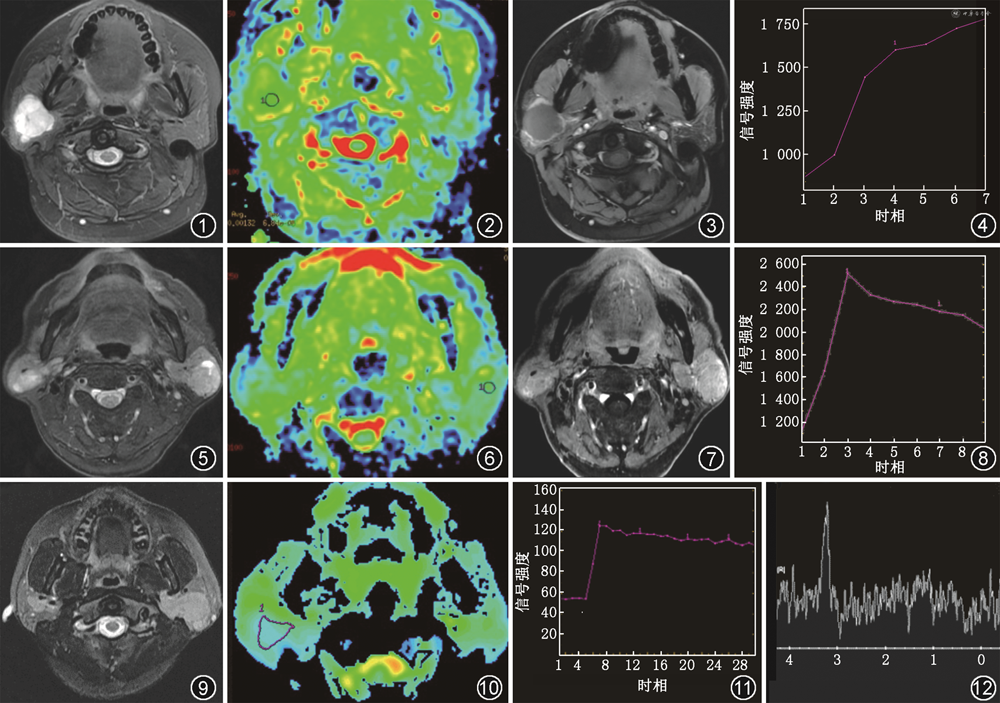

2.腺淋巴瘤:多见于中老年男性,平均年龄为62岁。腺淋巴瘤与吸烟关系密切,吸烟者腺淋巴瘤的发病率是非吸烟者的8倍。临床多表现为无痛且有活动性的软组织肿块,位于腮腺浅叶下极,常为多中心性。肿块呈圆形或类圆形,直径2~4 cm,边界清晰,多见完整包膜。CT表现为均匀等密度结节,也可表现为低密度囊变伴壁结节。MRI上,T1WI呈等或低信号,T2WI稍高信号,可见更高信号囊变区(图5)。由于含高浓度黏液的囊样结构和淋巴样组织,DWI显示扩散受限,ADC值偏低,低于腮腺恶性肿瘤,ADC值为(0.86±0.13)×10-3 mm2/s(b值为0、1 000 s/mm2,图6)[5]。典型的腺淋巴瘤微血管密度高较高,TIC通常为B型(廓清型,图7,8)[12]。MRS一般无明显升高的Cho峰。
1.黏液表皮样癌和腺样囊性癌:是最常见的涎腺恶性肿瘤。可发生于任何年龄,但以30~50岁居多,女性多见。临床多表现为固定不活动的无痛性肿块。由于腺样囊性癌有嗜神经生长特性,早期易侵犯神经引起面部麻木和面瘫等症状。
黏液表皮样癌多呈类圆形肿块,低度恶性者多表现为边缘清晰,高度恶性者多边缘模糊。腺样囊性癌多呈不规则,边界模糊,无包膜。CT上密度变化多样,可呈密度均匀或密度不均的软组织肿块,可见液化、坏死,下颌骨骨质破坏。MRI上,TIWI多呈等信号,T2WI呈不均匀高信号。腺样囊性癌易侵犯神经,引起神经孔道,如圆孔及卵圆孔的扩大。由于恶性肿瘤细胞密度高,DWI上呈扩散受限,ADC值较低。腮腺恶性肿瘤的ADC值为(0.91±0.20)×10-3 mm2/s[5]。TIC通常呈C型(平台型)[13]。由于恶性肿瘤细胞增殖活跃,MRS上可见明显升高的Cho峰。余强等[14]分析了42例口腔颌面部软组织恶性肿瘤,其中37例出现Cho峰升高。
2.多形性腺瘤恶变:包括3种类型,分别为癌在多形性腺瘤、转移性多形性腺瘤和癌肉瘤,其中癌在多形性腺瘤最常见,多见于50~70岁的中老年人,临床多表现为长期存在的无痛性肿块(常在3年以上),偶可见局部疼痛、面瘫等症状。肿瘤形态多不规则或呈分叶状,边界多不清。CT肿块呈软组织密度,可见高密度钙化或骨化。T1WI呈等或低信号,T2WI呈不均匀高信号。DWI是鉴别多形性腺瘤是否恶变的重要检查手段,恶变部分细胞密度较大,ADC值偏低。低ADC值是癌在多形性腺瘤的重要征象,平均ADC值为0.93×10-3 mm2/s[15]。TIC呈A型(持续型)或C型(平台型)。
3.淋巴瘤:MALT淋巴瘤是最常见的唾液腺淋巴瘤。MALT淋巴瘤与干燥综合征有密切的关系,干燥综合征患者患淋巴瘤的概率显著增加,是正常人的5~20倍。腮腺淋巴瘤在CT及MRI上多表现为弥漫结节型,沿腮腺轮廓呈塑形生长,T1WI呈等信号,T2WI呈等或稍高信号(图9)。由于淋巴瘤细胞密集,核质比较高,DWI常表现为扩散明显受限,ADC值较低(图10)。文献表明,ADC值<0.669×10-3 mm2/s高度提示MALT淋巴瘤,其诊断的准确度为88.4%[9]。TIC常呈C型(平台型,图11)[13]。MRS可见Cho峰(图12)。Zhu等[9]研究发现Cho峰阳性诊断MALT淋巴瘤的灵敏度、特异度和准确度分别为80.0%、76.0%和77.7%。
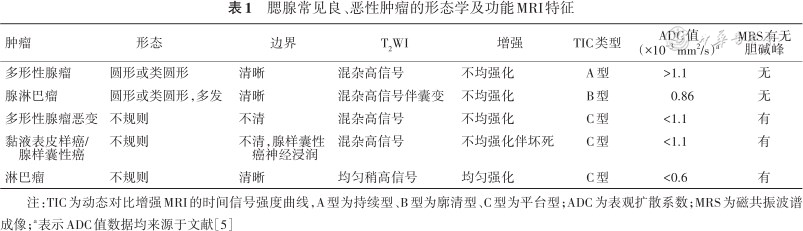
对腮腺肿瘤的诊断,CT仅起到定位及初步定性作用,常规MRI的诊断作用不容忽视,能够提供重要的形态学特征。表1中列举了腮腺常见良、恶性肿瘤的形态学及功能MRI特征。需要强调的是,常规MRI和功能MRI的结合,可以显著提高腮腺肿瘤的诊断准确性,对预测疾病的发展、制定治疗计划和评估预后等方面有重要价值。
腮腺常见良、恶性肿瘤的形态学及功能MRI特征
腮腺常见良、恶性肿瘤的形态学及功能MRI特征
| 肿瘤 | 形态 | 边界 | T2WI | 增强 | TIC类型 | ADC值 (×10-3 mm2/s)a | MRS有无胆碱峰 |
|---|---|---|---|---|---|---|---|
| 多形性腺瘤 | 圆形或类圆形 | 清晰 | 混杂高信号 | 不均强化 | A型 | >1.1 | 无 |
| 腺淋巴瘤 | 圆形或类圆形,多发 | 清晰 | 混杂高信号伴囊变 | 不均强化 | B型 | 0.86 | 无 |
| 多形性腺瘤恶变 | 不规则 | 不清 | 混杂高信号 | 不均强化 | C型 | <1.1 | 有 |
| 黏液表皮样癌/腺样囊性癌 | 不规则 | 不清,腺样囊性癌神经浸润 | 混杂高信号 | 不均强化伴坏死 | C型 | <1.1 | 有 |
| 淋巴瘤 | 不规则 | 清晰 | 均匀稍高信号 | 均匀强化 | C型 | <0.6 | 有 |
注:TIC为动态对比增强MRI的时间信号强度曲线,A型为持续型、B型为廓清型、C型为平台型;ADC为表观扩散系数;MRS为磁共振波谱成像;a表示ADC值数据均来源于文献[5]
中华医学会放射学分会头颈学组对本栏目给予大力支持
所有作者声明无利益冲突
1.以下关于腮腺多形性腺瘤的说法错误的是()
A.多形性腺瘤生长缓慢,主要表现为无痛性、孤立性软组织肿块
B.多呈圆形或类圆形,分叶状,边界清晰
C.DWI多扩散不受限
D.TIC多呈A型(持续型)
2.以下关于腺淋巴瘤的说法错误的是()
A.多见于中老年男性,与吸烟关系密切
B.多位于腮腺浅叶下极,常为多中心性
C.DWI显示扩散受限,ADC值偏低,低于腮腺恶性肿瘤
D.TIC通常为C型(平台型)
3.以下关于多形性腺瘤恶变的说法错误的是()
A.临床多表现为长期存在的无痛性肿块(常在3年以上)
B.多表现为形态不规则或呈分叶状,边界多不清
C.平扫CT肿块可见高密度钙化或骨化
D.ADC值一般偏高
4.以下关于腮腺肿瘤TIC曲线说法错误的是()
A.多形性腺瘤TIC曲线通常为A型(持续型)
B.腺淋巴瘤TIC曲线通常为B型(廓清型)
C.黏液样表皮样癌TIC曲线通常为C型(平台型)
D.淋巴瘤TIC曲线通常为B型(廓清型)
5.以下关于腮腺淋巴瘤的说法错误的是()
A.MALT淋巴瘤是最常见的唾液腺淋巴瘤
B.MALT淋巴瘤与干燥综合征无相关性
C.多为弥漫结节型,沿腮腺轮廓呈塑形生长
D.DWI常扩散明显受限,ADC值较低



























