
CT是主动脉夹层的首选影像学检查方法,对该疾病的诊断和治疗具有重要的价值。本文介绍了主动脉夹层的定义、分类、流行病学和临床表现,并结合最新研究结果,深入解析了重要CT征象在疾病的风险分层、治疗决策、不良预后等方面的临床价值,旨在提高影像医师对主动脉夹层CT征象的认识深度,更好地指导临床进行准确的风险评估和治疗决策。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,每年从第1期至第10期共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
主动脉夹层(aortic dissection,AD)是严重威胁生命的心血管急症之一,急性AD患者约1/2可在48 h内死亡。影像学检查是诊断AD的重要手段,尤其是主动脉CTA,已成为明确诊断的首选检查。近年来,AD的影像学研究越来越多,对相关CTA征象及其与临床意义的认识也逐步深入。笔者在介绍AD临床知识的同时,将全面深入解析其重要CTA征象,以及征象对AD的诊断、风险分层、治疗决策、不良预后等的临床意义。
主动脉管壁由内而外可分为内膜、中膜和外膜3层。AD被定义为因内膜破口,导致主动脉腔内血流破入中膜层,继而沿主动脉长轴方向扩展,并累及分支动脉[1]。管壁分成两层的同时管腔形成真腔和假腔两个腔。真假腔之间可以无交通,也可经再破口相交通。内膜片撕裂的方向多为顺行,也可逆行。
AD的分型目前临床最常用的是两种,分为DeBakey分型和Stanford分型。DeBakey分型依据破口的位置将AD分为Ⅰ、Ⅱ和Ⅲ型;Stanford分型依据升主动脉是否受累分为A型和B型,这一分型主要考虑撕裂的范围而非破口的位置,与手术方式相关,因此更多地被临床及指南采用。此外,还有一种比较少见的分型,即非A非B型主动脉夹层,1994年由von Segesser等[2]提出,用于描述原发破口位于升主动脉以远的夹层,特指内膜片撕裂仅限于主动脉弓,或撕裂由降主动脉逆行延伸至主动脉弓并在升主动脉之前停止。
此外,有研究显示,以2周时间将AD分为急性期和慢性期并不能准确描述主动脉对撕裂修复的病理反应。因此,现多将AD分为3个阶段:急性期(症状出现<2周)、亚急性期(症状出现2周~3个月)和慢性期(症状出现>3个月)[3]。
AD的流行病学最新数据较少。一项来自Howard等[4]的研究显示,AD的发病率约为6/100 000,并随年龄增长而增加,其中男性占65%,明显高于女性。与AD相关的最常见风险因素是高血压,占65%~75%,其他风险因素包括主动脉或主动脉瓣疾病史、主动脉疾病家族史、心脏手术史、吸烟等。IRAD注册研究中AD患者的平均年龄为63岁[5]。我国目前尚无权威的AD临床流行病学数据,但已有的研究显示我国急性AD的发病率逐年增加[6],人群相对年轻化,多见于40~50岁中年人,且因遗传疾病导致的AD较少见(<5%),这是我国与西方国家的明显不同之处。
急性AD最常见的症状是胸痛,以突然发作的胸部和/或背部撕裂样疼痛最为典型,其次是背痛和腹痛。A型AD的疼痛通常位于胸前,并可辐射到颈、背或腹部;而B型AD的疼痛更常发生在后胸部和腹部。由心脏压塞或主动脉破裂引起的低血压所致的晕厥,也是AD的重要初始症状,且与院内死亡风险增加相关[7]。此外,因低血压、脑灌注不足等引起的神经系统症状也不少见,约1/2是短暂性的。值得注意的是,神经系统症状会掩盖潜在的夹层症状而造成漏诊[8]。
急性AD极易出现危及生命的并发症,主要包括主动脉破裂、主动脉瓣关闭不全、心包积血和填塞,以及终末器官的灌注不良综合征(malperfusion syndrome,MPS)。急性主动脉破裂和严重主动脉瓣关闭不全是AD死亡的最常见原因,后者常伴有心力衰竭和心源性休克。此外,约20%的A型急性AD患者可出现心脏压塞,可使死亡率增加一倍。MPS定义为主动脉分支撕裂受累或假腔扩张压迫致血管狭窄或闭塞,导致供血的终末器官如心脏、脑、内脏和外周动脉等缺血或梗死引起相应的症状[9]。
影像学检查对快速、准确诊断AD的类型、程度和并发症等至关重要。CTA、MRI、经胸超声心动图和经食管超声心动图均可用于AD的检查与诊断。CTA以其扫描速度快、诊断准确已成为首选检查;经胸超声心动图检查方便快捷,但受限于肋间隙狭窄、肥胖、肺气肿等的影响,准确度不高;经食管超声心动图虽然准确度更高,但属于半侵入式检查,更多用于不稳定患者,及术中监测和术后重症监护;MRI也是诊断AD的主要技术,诊断灵敏度和特异度均很高。但MRI扫描时间过长,通常不适用于紧急情况下的AD检查,仅限于非紧急情况、碘对比剂过敏或术后需多次随访的患者。
基于急性AD病理改变的多样性和复杂性,以及从急诊接诊开始的高标准临床需求,常规的CTA诊断报告提供的信息已经不能与时俱进地适应当今临床对AD的诊断、治疗及随访等各个方面的进展与需求。因此,有必要更加规范、全面地解读AD的CTA征象,并深入理解征象对AD的诊断、风险分层、治疗决策、不良预后等的临床价值和意义[7,10, 11],更好地指导临床高效诊断和精准决策。
1.内膜片及其撕裂表现——与AD诊断及不良预后相关:在CTA图像的主动脉腔内发现线样低密度结构(内膜片)即可确定AD的诊断。内膜片可能包含钙化斑块。急性期的内膜片薄且在管腔内随血流高度摆动,常因搏动伪影显示较为模糊(图1),有时可引起动态阻塞;随着时间的推移,至亚急性期时内膜片逐步增厚,活动度降低(图2);慢性期的内膜片则厚且固定,重构增加(图3)。内膜片撕裂的程度越严重,横断面图像显示的周长就越长,且周长的增加与不良预后相关。内膜片撕裂严重时甚至可以与中膜完全撕脱分离并堆聚产生套叠,引起远端梗阻或血栓形成[12]。
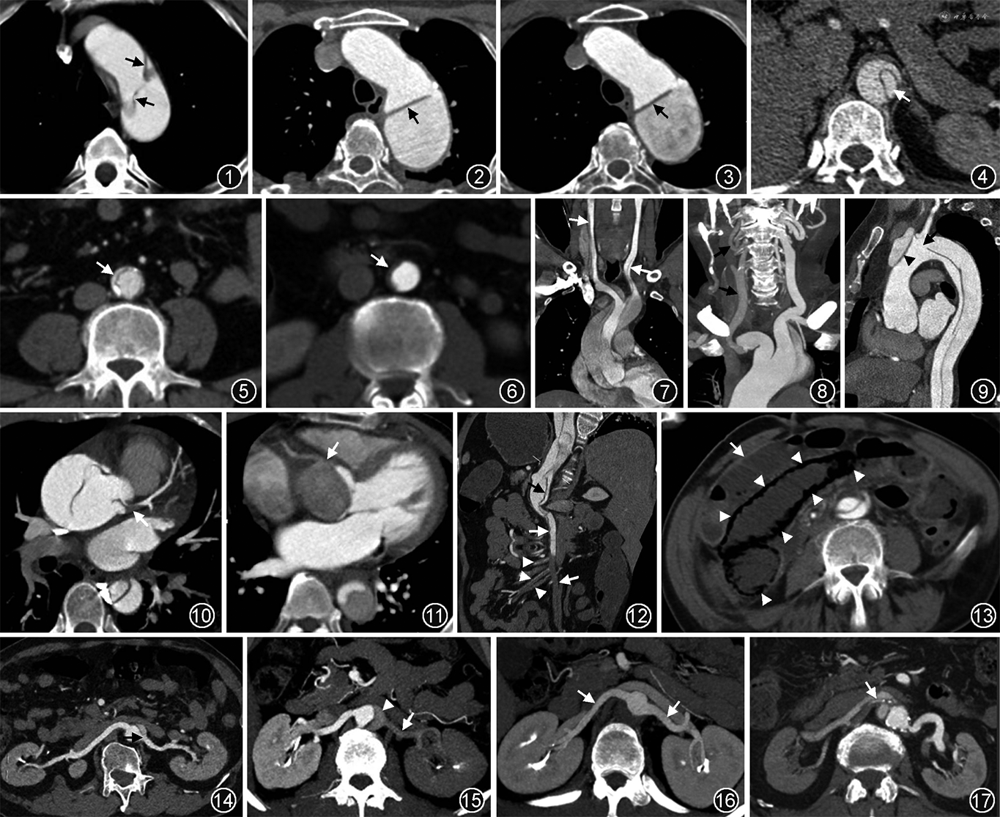

2.原发破口位置及大小——与预后相关:在观察并评估内膜片的同时很容易找到其连续中断处,即内膜片破口的位置。明确原发破口的位置对于AD的分型和外科及介入手术都非常重要。大多数原发破口位于近窦-管连接处1~2 cm的升主动脉根部和左锁骨下动脉开口以远的主动脉。原发破口的大小应尽可能准确测量,破口与主动脉大弯侧和小弯侧的关系也应描述,这对治疗及预后有重要意义:原发破口大于10 mm通常预后较差,而破口位于小弯侧时内膜片有逆行撕裂的趋势,即使不是A型夹层也会向A型夹层转变[13]。除了原发破口,常常还可见远端再破口或主动脉分支开口处的自然撕裂。
3.真假腔大小及复杂性——与不良结局相关:真假腔的大小和直径均不相同,需要测量描述。假腔的最大直径可以通过在假腔最大处沿管腔外侧壁向内膜片垂直连线测量获得。真腔几乎总是小于假腔,因为假腔压力高会扩张压迫真腔,可致真腔从轻微受压到完全塌陷甚至闭塞(图4~6)。假腔通常较大,密度低于真腔,内常可见血栓形成。研究显示,在病变进展的过程中,真腔狭窄程度的增加、假腔的扩大及假腔内血栓形成等征象均与不良结局密切相关[14]。此外,A型AD修复术后约75%的患者仍有假腔灌注,其中约一半的患者会出现假腔增大,需在随访中监测。
4.假腔内血栓及其位置——与不良结局相关:假腔内有无血栓,以及血栓在假腔内的位置应被仔细观察及记录,因为它与假腔的逐步扩张、破裂以及增加的全因死亡率相关,且这些不良结局风险无论在急性、亚急性还是慢性期都会出现[15]。假腔远端没有再破口时,因不与真腔交通流动,假腔内极易形成血栓;假腔远端有再破口时,假腔血流与真腔交通,则假腔内不易形成血栓。
5.受累主动脉大小与重构——与风险评估及预后相关:受累主动脉的大小(管径)也是必须测量并记录的。一般来说,管径越大越容易导致不良事件,但管径越小并非就是安全的。主动脉的大小可能与潜在的病因有关,可能是先天性也可能是后天的。受累主动脉管径和假腔管径是观察的基本要素,有助于对A型AD的整体情况和潜在风险进行综合评估,也与B型AD的预后相关[16]。有一些征象可以预测主动脉增大的趋势,如原发破口较大、假腔直径超过主动脉总直径的2/3、假腔内血栓形成或涡流等。随着时间的推移,受累主动脉已失去完整性并发生重构,管壁因失去弹性等因素而活动力下降,但假腔和主动脉管腔的扩大仍在进展,最终需要手术修复以避免破裂。
需要注意的是,测量主动脉直径时需结合横断面及三维重建图像进行正交精准测量。应在主动脉最扩张处沿主动脉长轴的垂直横断面测量主动脉最大宽径,这样测量的值才是准确的,而在扫描获得的原始横断面图像上测量的主动脉直径常常会假性增大。
6.受累主动脉节段——与并发症风险相关:夹层撕裂累及的主动脉节段应逐一描述,包括主动脉根部、窦-管连接处、升主动脉、主动脉弓、降主动脉、腹主动脉和髂股动脉。升主动脉受累,尤其是根窦部受累的描述尤其重要,因为这意味着被定义为A型AD,是高度不稳定和需要紧急手术的类型,且致命性并发症的发生风险更高[17],即使扫描时并不存在提示并发症的特异性征象。
7.夹层范围和终止部位及分支受累——与病变程度及并发症相关:应准确描述夹层撕裂的终止部位,这决定了病变的范围和程度。夹层撕裂终止于主动脉分支可引起血管的直接闭塞、血栓形成或动态闭塞和供血器官的灌注不良。最常见的撕裂终止部位是髂股动脉,可致髂股动脉闭塞或重度狭窄,并引起下肢缺血的症状,也会影响治疗干预的途径。
8.并发症的描述——与病情风险及治疗决策相关:AD出现并发症意味着病情的风险程度和复杂性增加,常需紧急外科手术或胸主动脉腔内修复术(TEVAR)。也就是说,并发症将直接决定病情的紧急程度、干预的方式和所需的治疗策略。因此,AD并发症的描述具有重要的诊断意义和临床价值,需系统地识别并描述,必要时还应及时通知临床医师。除了主动脉破裂,MPS是急性AD最常见和最有害的并发症之一。急性AD的死亡率平均高达20%,而急性A型AD出现MPS时死亡率可增加至1倍以上[18]。
(1)脑灌注不良(cerebral malperfusion,CM):与B型AD相比,A型AD更容易出现CM。众多的研究结果均显示,CM可能与夹层累及弓上的颈动脉分支密切相关,因此,对于可疑AD且伴有神经症状的患者,建议行头-颈-主动脉联合CTA成像,可为外科提供额外的脑动脉及颈动脉的解剖信息[19]。受累颈动脉及数量、侧别、撕裂的范围及程度、真腔狭窄及闭塞等CTA信息应详细描述,因为这与外科手术中动脉插管的位置选择、扩大颈动脉重建的选择等治疗决策息息相关;而颅内Willis环的先天高变异也是影响A型AD术中脑保护策略的关键。Willis完整或安全变异时,可选择单侧脑保护;Willis环不安全变异时,则可选择双侧脑保护以防止术后脑卒中的发生。我们前期的研究还显示,颈总动脉夹层(图7)、一侧颈总及颈内动脉密度减低(图8)和主动脉弓部破口这3个CTA征象是急性A型AD术后短暂性神经损伤的独立风险预测因子;而升主动脉逆行夹层、主动脉弓部破口则是术后永久性神经损伤的独立危险因素(图9)[20]。此外,也有个案报道将颅脑CT灌注用于AD合并CM患者的评估,可提供更精准的脑灌注不良的功能信息[21]。
(2)冠状动脉灌注不良:主动脉根窦部夹层累及冠状动脉时可引起冠状动脉灌注不良,是急性AD最严重的并发症之一,可导致不可逆的心肌损伤,必须在术中经冠状动脉旁路移植术进行血运重建。冠状动脉灌注不良根据受累的机制分为3种类型[22]:A型,冠状动脉近端开口处撕裂(图10);B型,冠状动脉起自假腔(图11);C型,内膜片环形撕脱,并塌陷套叠,极罕见。值得注意的是,主动脉瓣狭窄是术后出现冠状动脉灌注不良的独立危险因素,CT描述时也需提示。
(3)肠系膜灌注不良:腹主动脉夹层撕裂累及肠系膜上动脉时可致肠系膜、系膜血管及供血的肠管灌注不良(图12,13)。主要症状是腹痛,危及生命的风险是肠坏死和感染性休克。肠系膜上动脉夹层根据影像学特征可分成4型[23]:Ⅰ型,近端和远端均见破口,真假腔相通;Ⅱ型,仅见近端1处破口;Ⅲ型,假腔完全血栓化且伴有溃疡样突起;Ⅳ型,假腔完全血栓化但无溃疡样突起。肠系膜上动脉夹层的真腔狭窄程度可能与灌注不良相关。急性A型或B型AD合并肠系膜灌注不良的发生率分别为14%、7%左右,均与院内死亡密切相关。A型AD合并肠系膜灌注不良的院内死亡率高达60%~75%,预后极差。肠道的缺血或坏死可通过CTA图像中肠壁的强化程度减低或没有强化来明确,但肠坏死极少见。
(4)肾灌注不良:夹层撕裂至腹主动脉时,极易累及肾动脉,致肾灌注不良,CTA表现为肾实质灌注减低或梗死,慢性期可呈现肾萎缩。肾动脉受累根据特点,可分为4型(图14~17)[24]:A型,肾动脉开口附近有内膜片大破口,肾动脉起自真腔或假腔辨别困难;B型,肾动脉完全起自假腔;C型,肾动脉完全起自真腔;D型,肾动脉夹层,管腔内可见撕裂的内膜片。研究显示,肾动脉由假腔供血或真腔狭窄程度大于50%与肾萎缩相关[25]。术前CTA显示一侧或双侧肾皮质灌注减低则是急性AD术后急性肾损伤和死亡的独立危险因素[24]。
(5)髂股动脉灌注不良:夹层撕裂至腹主动脉或终止于髂股动脉时,均可导致髂股动脉灌注不良及下肢缺血。患者可有下肢疼痛、股动脉搏动消失等症状和体征。致髂股动脉灌注不良的原因主要有两种,一是腹主动脉夹层的真腔塌陷致下肢动脉供血不足,此时需尽早恢复腹主动脉真腔血流;二是夹层撕裂累及髂股动脉直接引起闭塞、血栓形成或动态闭塞致灌注不良,此时需急诊介入恢复下肢动脉血供。CTA需描述腹主动脉下段真腔受压狭窄情况,以及髂股动脉夹层撕裂的终止点、真腔狭窄闭塞的情况和假腔有无血栓等信息。
综上所述,AD是常见心血管急症,CTA在这一疾病的临床应用广泛深入。但CTA征象对治疗决策等的重要价值,尤其是外科及介入手术的术式优选、风险预测等,影像医师了解偏少。笔者详细解读了与AD的诊断、治疗决策、风险评估、不良结局等各个方面相关的CTA征象及其临床价值,旨在提高大家对AD的CTA征象的认识,全面描述重要的影像学信息,为临床提供有指导价值的CT诊断报告。
所有作者声明无利益冲突
1. 主动脉夹层亚急性期分期的依据是()
A. 症状出现2周~2个月
B. 症状出现2周~3个月
C. 症状出现3周~2个月
D. 症状出现3周~3个月
2. 我国主动脉夹层流行病学与西方国家明显的不同是()
A. 中国主动脉夹层的最常见风险因素是高血压,而西方国家则是主动脉疾病史
B. 西方国家主动脉夹层的发病率极高,并随年龄增长而增加
C. 中国主动脉夹层的发病率高于西方国家,但发病年龄低,多见于40~50岁的中年人,且因主动脉先天性遗传疾病而致的主动脉夹层相对少
D. 西方国家主动脉夹层的患者以男性多见,约占65%,而中国主动脉夹层患者以女性多见
3. 急性主动脉夹层的并发症主要有()
A. 主动脉破裂、主动脉瓣关闭不全、心脏压塞、终末器官灌注不良综合征
B. 主动脉瓣关闭不全、脑梗死、心包积血、肠系膜缺血
C. 心包积血和填塞、终末器官灌注不良综合征、肾梗死
D. 主动脉瓣关闭不全、心包积血和填塞、脑梗死、终末器官灌注不良综合征
4. 下列关于主动脉夹层CTA征象的描述,正确的是()
A. 夹层累及超过3个主动脉节段,则病情的紧急性和发生并发症的潜在风险明显增加
B. 原发破口大于10 mm预后较差;破口位于主动脉小弯侧时内膜片易逆行撕裂
C. 假腔内血栓的形成预示着夹层趋向稳定,假腔扩张和主动脉破裂的风险明显减小
D. 内膜片完全撕脱后可在管腔内随血流高度摆动,引起动态阻塞
5. 下列关于主动脉夹层合并脑灌注不良CTA相关征象的描述,错误的是()
A. CTA显示的颈总动脉夹层、一侧颈动脉密度减低和主动脉弓部破口是急性A型AD术后短暂性神经损伤的独立风险预测因子
B. CTA显示颅内Willis环的先天高变异可能会影响A型主动脉夹层术中脑保护策略的选择
C. CTA显示的升主动脉逆行夹层、主动脉弓部破口可能是急性A型主动脉夹层术后永久性神经损伤的独立危险因素
D. CTA显示的主动脉弓部受累并有破口是主动脉夹层合并脑灌注不良最常见的原因



























