
脑室扩张是产前筛查中最常见的胎儿中枢神经系统异常,由于其神经发育结果的不确定性,胎儿脑室扩张的产前诊断咨询充满挑战性。该文从脑室胚胎发育及病理生理入手,介绍胎儿脑室扩张的产前诊断及预后评估,以期对指导产前诊断咨询及妊娠管理提供帮助。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,每年从第1期至第10期共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
侧脑室扩张是产前筛查中最常见的中枢神经系统异常,发生率约为1%,也是由产前超声转诊胎儿MRI最常见的指征,占胎儿脑部MRI指征的40%[1, 2]。胎儿侧脑室扩张指产前影像学发现胎儿侧脑室内径≥10 mm,其原因多样,可能由中脑导水管狭窄、后颅窝畸形等梗阻性因素和/或胼胝体发育不全、出血及感染等非梗阻性因素引起,也可能是孤立性脑室扩张。侧脑室内径≥15 mm为重度脑室扩张,产前超声诊断为“脑积水”。脑室扩张的病因以及扩张程度决定了其神经发育预后。因此,产前筛查发现胎儿脑室扩张后,除进行全面细致的针对性影像学检查(超声、MRI)以排除是否合并其他颅内外结构异常外,还需进行遗传学、病原学等产前诊断方法寻找病因,帮助胎儿医学多学科团队为准父母提供更全面的产前诊断咨询。
1.脑室胚胎发育特点:脑室系统由胚胎期孕4~5周神经管中央的管腔演变而来,其中左右侧脑室和第三脑室来源于前脑泡腔,中脑导水管和第四脑室则分别起源于中脑泡和菱脑泡。侧脑室位于双侧大脑半球内,通过室间孔与第三脑室相通,在孕13~14周时可见,随着脑实质发育成熟,其形态随之改变,侧脑室三角区宽度在妊娠中晚期保持恒定,正常<10 mm。脉络丛是由侧脑室底部和第三、第四脑室顶部的软膜与室管膜直接相贴,突入脑室而形成的皱襞状结构的毛细血管网,覆盖室管膜上皮,是产生脑脊液的主要结构。脑室中充满脑脊液,有营养和保护脑的作用。
2.脑室扩张病理生理特点:正常情况下,胎儿双侧脑室可不对称,枕角较额角更为丰满,到晚孕期,这种差异则不明显。单侧脑室扩张占50%~60%,双侧扩张占40%~50%[3]。脑室扩张分为孤立性与非孤立性。孤立性脑室扩张指胎儿除了脑室扩张的直接表现外没有合并颅脑畸形或其他异常;非孤立性侧脑室扩张是指胎儿合并有多系统或多部位异常,也可能是相关多系统异常的首要和/或唯一表型,潜在合并胎儿染色体异常等遗传学异常,因此预后较孤立性差,更应引起警惕和关注。但是,部分产前表现为“孤立性”脑室扩张的病例出生后也发现还存在其他异常,尤其是脑室扩张超过15 mm时。研究显示,55%的胎儿脑室宽度随访中保持稳定,30%的病例表现为缩小,15%的病例表现为进行性扩张[4]。
胎儿侧脑室扩张程度越大,中枢神经系统疾病合并率越高。轻中度侧脑室扩张胎儿发现其他颅内外异常的概率为10%~76%,多数小于50%,重度侧脑室扩张合并大脑异常的概率则是轻中度侧脑室扩张的10倍。
根据发生机制不同,脑室扩张可分为梗阻性和非梗阻性。胎儿梗阻性脑室扩张常见的是先天性中脑导水管狭窄、后颅窝畸形、Chiari畸形Ⅱ型、脑实质占位等;非梗阻性可能是由胼胝体缺如、神经元移行异常、前脑无裂等先天性脑发育畸形以及出血、感染等引起的。引起胎儿脑室扩张的机制常多种混合,互有重叠,当脑室扩张程度严重并存在明显梗阻时,称为脑积水。
产前超声主要观测平面为轴位经侧脑室平面三角区脉络丛血管球水平,测量侧脑室体部、枕角和颞角汇合部的垂直内径,因其大小和结构在妊娠15~40周基本稳定,也通常是脑室扩张时首先扩张的区域。超声测量可能会受到近场伪影、胎位、颅骨骨化等技术限制,而胎儿MRI则不受干扰,测量结果与超声一致性很高。T2WI可以在胎儿脑部横断面和冠状面测量三角区垂直内径(图1,2),还可以测量侧脑室前角、体部、颞角或枕角等任何部位的内径;如果合并颅内结构异常,MRI能提供比超声更多的信息。研究显示MRI冠状面和超声轴位在侧脑室三角区测量的一致性均高于90%[5]。一项前瞻性多中心研究显示胎儿MRI提高了诊断脑异常的准确性,增加了对脑异常胎儿进行管理的信心[6]。
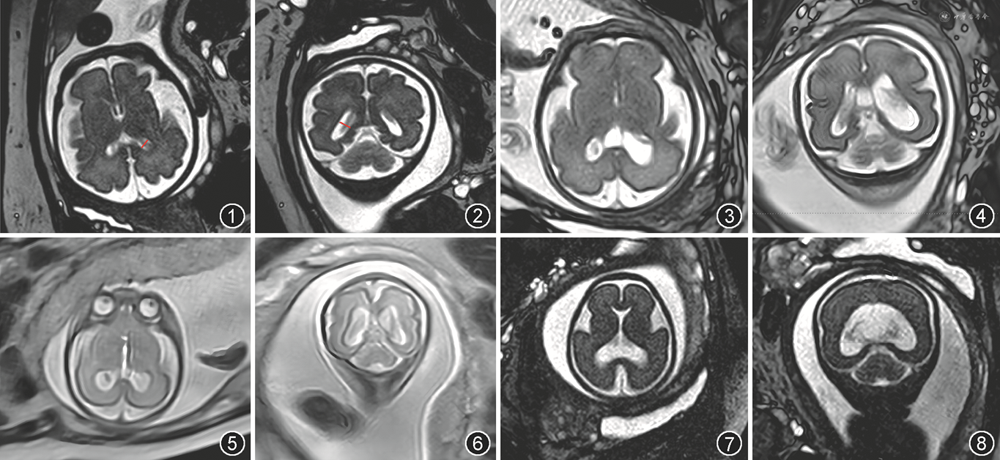

1.定性诊断:正常情况下脉络丛可基本填满侧脑室三角区,占50%~100%,与邻近侧脑室壁距离1~2 mm。脑室扩张时,脉络丛血管球在三角区所占比例明显下降,即“脉络丛变薄”,并向所属侧室壁垂落,称“脉络丛悬吊征”(图3,4)。定性诊断较为主观,轻度侧脑室扩张征象可能不明显。
2.定量诊断:研究发现正常侧脑室平均内径为5.4~7.6 mm,10 mm相当于平均值的2.5~4.0倍标准差,产前影像检查发现侧脑室内径<10 mm被认为是正常的[3]。如果侧脑室三角区,或前角、体部、颞角、枕角等任何部位内径≥10 mm,即可诊断侧脑室扩张。
3.侧脑室扩张程度分类:《胎儿MRI中国专家共识》建议侧脑室扩张分为3级,轻度扩张(10 mm≤侧脑室宽度<12 mm)、中度扩张(12 mm≤侧脑室宽度<15 mm)和重度扩张(侧脑室宽度≥15 mm)。脑积水诊断仅适用于可直接观察到或推断出梗阻的胎儿[7]。
Griffiths等[5]提出的3级分类在临床上应用较广泛,分为轻度扩张(10~12 mm)、中度扩张(13~15 mm)、重度扩张(>15 mm)。但是对于脑室宽度在12~13 mm之间的扩张没有归类。也有研究者将10~15 mm的孤立性脑室扩张归为轻度扩张;将脑室宽度>15 mm,但邻近皮质厚度>3 mm者归为中度扩张;将邻近脑皮质明显变薄,厚度<2 mm者称为重度扩张[8]。
产前超声或MRI能诊断侧脑室扩张,还能发现部分引起侧脑室扩张的病因,如脑出血、胼胝体缺如、前脑无裂畸形、中脑导水管狭窄等(图5, 6, 7, 8)。判断是孤立性或非孤立性脑室扩张,对于出生后新生儿总体预后评估有重要价值。神经系统中应评估脑室系统的形态、内容物及室周区域,确认有无异常信号、囊肿以及局灶性病变,详细评估透明隔、胼胝体、后颅窝、中脑导水管、脑实质、脑沟回及侧裂池等结构是否符合孕周等,是否存在感染、脑室出血、卒中等异常情况,尤其是晚孕期。最后,应评估胎儿体部及四肢等部位有无明确异常。
妊娠晚期胎儿脑室进行性扩张、伴胎儿其他异常是不良结局的重要预测因素之一,产前影像随访有助于评估胎儿脑室扩张的转归。
研究发现孤立性轻度侧脑室扩张患者染色体异常总检出率为2.7%,中重度扩张患者染色体异常总检出率分别为14.2%和17.4%;当合并有其他异常时,染色体异常风险进一步升高。4%~13%的唐氏综合征胎儿和0.1%~0.4%的整倍体胎儿中可见轻度脑室扩张[9, 10]。常见的染色体异常有21三体、18三体、13三体、X单倍体和三倍体,也存在嵌合、缺失和重复等。致病性DNA拷贝数变异(copy number variants,CNVs)是导致一系列神经发育障碍和先天畸形的已知原因,是孤立性侧脑室扩张胎儿神经发育不良的一个重要因素[9]。因此,无论侧脑室扩张程度如何,都建议进行胎儿遗传学检查,包括侵入性的绒毛膜取样或羊水穿刺术以及无创产前筛查,临床上仍以羊水穿刺为金标准。常规检查项目包括染色体核型检查以及染色体微阵列分析(chromosomal microarray analysis,CMA)。而全外显子组测序可将染色体核型和CMA均为阴性的结构异常胎儿诊断率提高8.5%~10.0%。目前已经发现了100多个与胎儿侧脑室扩张相关的基因[11]。
胎儿侧脑室扩张中感染发病率约1.4%,大约5%的轻中度脑室扩张是由先天性感染所致,其中最常见的是巨细胞病毒、弓形虫和寨卡病毒感染,其他病毒感染如风疹、单纯疱疹病毒、腮腺炎肠道病毒71、副流感病毒3型也可导致侧脑室扩张,但较为罕见[3]。
胎儿可疑宫内感染的评估除回顾孕妇病史确定潜在感染源外,还建议行羊水聚合酶链反应(polymerase chain reaction,PCR)或母体血清学抗体检测巨细胞病毒感染和弓形虫病。羊水PCR检测最为可靠,21孕周以后或母亲原发感染6~7周以后进行羊水巨细胞病毒PCR检测灵敏度最高,特异度在97%~100%之间,阳性预测值接近100%。羊水弓形虫病PCR检测的灵敏度为64%,阴性预测值为87%,阳性预测值接近100%[12, 13]。对于拒绝羊膜穿刺术的患者,也可行母体血清学检查。
胎儿侧脑室扩张的程度、是否合并其他异常及侧脑室扩张的进展是胎儿出生后神经发育异常的主要影响因素。在进行产前诊断咨询和预后评估时,应考虑以下因素:(1)脑室扩张的程度;(2)是否存在可能影响预后的其他结构异常;(3)遗传学和病原学检查结果;(4)脑室扩张随访中的演变。若胎儿脑室进行性扩张,或脑室扩张严重,胎儿预后越差;非孤立性侧脑室扩张比孤立性侧脑室扩张胎儿预后差[10]。
妊娠结局方面,侧脑室扩张胎儿围生期死亡率不同国家差异较大,为38%~59.7%。孤立性轻度侧脑室扩张胎儿存活率为93%~98%,中度侧脑室扩张为80%~97%,重度侧脑室扩张胎儿由于常合并其他异常及终止妊娠率高,总存活率为71%~88%,总剖宫产率增加,约为65%[14, 15, 16]。
1.孤立性轻度侧脑室扩张:轻度侧脑室扩张在男性胎儿中更常见,占65%~75%,但没有数据表明预后与胎儿性别有关,总体上,神经发育不良的风险极低。较中重度脑室扩张者,轻度扩张胎儿神经系统预后更好,90%以上出生后神经发育正常,尤其是单侧孤立性侧脑室扩张者。非整倍体筛查或诊断性基因检测结果正常的孤立性轻度侧脑室扩张很可能就是一种正常表现[17, 18]。部分研究发现孤立性轻度侧脑室扩张胎儿在中孕期出现脑室扩张侧大脑半球的皮质延迟发育,但相对延迟发育的脑沟经历了“追赶性生长”的过程,在出生后18个月内的婴幼儿神经发育差异无统计学意义[19]。因此,这种轻度的不对称皮质成熟可能是一种生理现象。另据报道7%~10%的孤立性轻度脑室扩张的胎儿在出生后的检查中被发现有其他结构异常,提示轻度侧脑室扩张胎儿亦有神经系统发育不良的潜在风险,应重视出生后的儿童保健和定期随访。
2.孤立性中度侧脑室扩张:美国母胎医学会建议在全面评估并排除其他风险因素后,对于侧脑室内径为13~15 mm的孤立性中度脑室扩张,应告知准父母胎儿出生后预后可能是良好的,但是可能有较高的神经发育异常风险(1B级)。相比轻度脑室扩张,孤立性中度脑室扩张的新生儿正常神经发育结果可能性为75%~93%,神经发育障碍的风险为7%~25%[16]。
3.孤立性重度侧脑室扩张:多数研究显示孤立性重度侧脑室扩张(≥15 mm)胎儿在出生后发生中枢神经系统发育迟缓的风险明显高于其他胎儿,正常预后率为42%,另外18%为轻中度残疾,40%为重度残疾。当合并其他颅内或颅外畸形时,其患病率/病死率从6%上升至56%。也有少数研究结果表明,孤立性重度侧脑室扩张新生儿表现出正常的神经发育和运动功能[20, 21]。
4.伴有其他异常的脑室扩张:预后取决于具体病因。单纯性胼胝体缺如、脑出血Ⅲ级和特发性脑室扩张的病例预后较为良好。胼胝体缺如,无论是完全性还是部分性,只要不合并其他结构异常,其神经发育结果可能正常,65%~88%患者智商在正常范围内,若合并其他神经系统或遗传异常时,可能存在中重度智力缺陷。与脑出血相关的脑室扩张胎儿神经发育不良的概率为50%,围生期死亡率相对偏高,终止妊娠率高。2/3合并颅内囊肿患者的产后神经病学检查正常,表明由良性囊性病变继发的重度脑室扩张与更差的预后无关[21, 22]。脑出血Ⅳ级和遗传原因与严重的异常结局相关。核型正常但检出致病性CNVs的孤立性侧脑室扩张胎儿出生后依然存在神经发育迟缓的风险。
发现有胎儿脑室扩张时,应建议完善相关产前检查,包括影像学、遗传学及病原学检查,排除潜在的先天性疾病。由于胎儿大脑的动态发育特点,在妊娠期发现胎儿侧脑室扩张者,应建议3~4周后随访检查,以监测扩张程度的动态变化以及其他中枢神经系统畸形的发生和发展。
不建议选择性早产,因为没有证据表明可以改善胎儿轻中度侧脑室扩张孕产妇妊娠结局或新生儿预后。绝大多数脑室扩张胎儿的头围正常,大头畸形罕见,因此大多数指南建议分娩时间和方式基于标准的产科指征,包括决定是否剖宫产。
脑室扩张胎儿出生后应密切随访神经发育等情况,尤其是重度侧脑室扩张、出现宫内进展或出生后侧脑室扩张持续存在者,以便早期识别学习和行为障碍。早期干预可以改善婴幼儿的预后,出现发育迟缓时,应及时转诊进行特殊教育评估。
宫内手术如侧脑室-羊膜腔引流术、胎儿脑室镜下第三脑室底造瘘术、经皮颅内穿刺抽液术等适用于进行性发展的孤立性重度侧脑室扩张胎儿,可对侧脑室进行减压,避免不可逆的脑损伤,但其对神经发育结果的长期预后作用仍然存在争议。
综上所述,胎儿脑室扩张是产前筛查中常见的中枢神经系统异常,发现脑室扩张时,建议进行彻底的评估,包括超声和MRI详细的解剖评估,侵入性或无创性遗传学筛查以及病原学检查。常规随访对监测侧脑室扩张及其他合并畸形的进展是必要的。90%以上的孤立性轻度侧脑室扩张预后良好,神经发育异常风险极低,重度侧脑室扩张和合并其他颅内外异常者预后可能较差,其管理和治疗需要基于相应的适应证。
佘佳燕, 陈宇婕, 宁刚. 胎儿侧脑室扩张的产前诊断及预后评估[J]. 中华放射学杂志, 2023, 57(5): 576-580. DOI: 10.3760/cma.j.cn112149-20230303-00156.
中华医学会放射学分会儿科学组对本栏目给予大力支持
所有作者声明无利益冲突
1. 侧脑室起源于哪个脑泡腔()
A. 前脑泡
B. 中脑泡
C. 菱脑泡
D. 前脑泡和中脑泡
2. 若测得侧脑室三角区宽为9.9 mm,应诊断为()
A. 正常
B. 轻度扩张
C. 中度扩张
D. 重度扩张
3. 关于胎儿侧脑室扩张影像诊断,说法不正确的是()
A. 可以选择在横断面或冠状面测量
B. 定性诊断较为主观,易受经验影响
C. 超声诊断侧脑室扩张后,胎儿MRI价值不大
D. 影像学检查能直接发现部分侧脑室扩张的病因
4. 下列关于胎儿侧脑室扩张预后的说法,正确的是()
A. 重度侧脑室扩张胎儿存活率与轻中度扩张相差不大
B. 孤立性轻度侧脑室扩张胎儿神经发育不良风险极低,无须出生后随访
C. 50%以上的孤立性重度侧脑室扩张胎儿预后正常
D. 合并其他异常的侧脑室扩张胎儿也可能预后良好
5. 关于胎儿侧脑室扩张,以下说法不正确的是()
A. 侧脑室扩张是产前筛查中最常见的中枢神经系统异常
B. 部分侧脑室扩张即使联合产前影像学、遗传学及病原学检查也无法确定其病因
C. 侧脑室扩张胎儿的预后取决于多种因素
D. 中重度侧脑室扩张胎儿常规建议剖宫产



























