
本研究探讨平均血小板体积(mean platelet volume,MPV)和大血小板比率(platelet-large contrast ratio,P-LCR)及中性粒细胞/淋巴细胞比值(neutrophil-lymphocyte ratio,NLR)在不同病情危重程度的新型冠状病毒肺炎(COVID-19)的表达水平及临床应用价值。采用回顾性分析方法,选取天津市第三中心医院和天津市津南医院2020年1至5月收治的69例COVID-19确诊患者作为研究对象,根据病情危重程度分为轻型组(15例)、普通型组(46 例)、危重型组(8 例),另选取同期70例已排除新型冠状病毒肺炎感染的患者作为对照组,分析各组白细胞总数(white blood cell count,WBC)、中性粒细胞绝对数(absolute neutrophil count,NE#)、淋巴细胞绝对数(absolute lymphocyte count,LY#)、中性粒细胞/淋巴细胞比值(neutrophil-lymphocyte ratio,NLR)、红细胞计数(red blood cell count,RBC)、血红蛋白(hemoglobin,Hb)、血小板总数(platelet count,PLT)、平均血小板体积(mean platelet volume,MPV)、血小板体积分布宽度(platelet volume distribution width,PDW)、大血小板比率(platelet-large contrast ratio,P-LCR)各指标变化水平,并采用二元Logistic回归分析各项指标对危重型COVID-19的预测价值,利用受试者工作特征(ROC)曲线进一步分析MPV、P-LCR、NLR单独及联合对 COVID-19的鉴别诊断价值。危重型患者WBC[11.98(8.21,13.43)×109/L]和NE#[7.31(5.18,9.68)×109/L]明显高于对照组[9.85 (7.71,11.21)×109/L;5.55(4.21,6.12)×109/L],差异均有统计学意义(Z=-5.63, P<0.01;Z=-9.19,P<0.01),危重型患者LY#[1.41(1.07,2.17)×109/L]明显低于对照组[2.84(1.83,3.57)×109/L],差异有统计学意义(Z=-9.34, P<0.01)。NLR随病情加重而升高,危重型组[4.54(2.34, 6.54)]明显高于对照组[1.77(1.34, 2.24) ],差异有统计学意义(Z=17.61, P<0.01);COVID-19患者PLT、PDW、MPV、P-LCR随病情加重而下降,各组间差异均有统计学意义(Z=9.47,P<0.01;Z=11.41,P<0.01;Z =16.76,P<0.01;Z=13.97,P<0.01)。二元Logistic回归分析显示MPV、P-LCR、NLR对危重型COVID-19具有预测价值,MPV、P-LCR与COVID-19患者的危重型呈负相关性(OR=1.004, P=0.034;OR=1.097, P=0.046),NLR与COVID-19患者的危重型呈正相关性(OR=1.052, P=0.016)。预后良好组治疗后MPV[11.2(8.5,12.6)fl]和P-LCR[14.7(12.4, 17.5)% ]明显高于治疗前[9.9(7.1,11.2)fl; 12.2(10.2, 16.4)% ],差异均有统计学意义(Z=-6.47,P<0.01;Z=-5.36,P<0.01), NLR[1.76(1.15, 2.49) ]明显低于治疗前水平[2.48(1.79, 4.12) ],差异有统计学意义(Z=-8.13,P<0.01);预后不良组治疗后MPV[6.9(5.3, 8.9) fl]和P-LCR[9.7(7.2, 11.9)%]明显低于治疗前[8.8(6.4, 10.2)fl]和[11.1(9.4, 14.4) %],差异均有统计学意义(Z=-9.46,P<0.01;Z=-6.81,P<0.01),NLR[6.79(4.22, 8.14) ]明显高于治疗前[4.84(2.34, 6.54) ],差异有统计学意义(Z=-3.24,P<0.01);预后不良组治疗前与治疗后MPV、P-LCR、NLR与预后良好组比较,差异均有统计学意义(Z分别为9.84、14.21、8.54、13.24、10.71、22.87,P均<0.01)。MPV、P-LCR、NLR三项指标联合对于COVID-19诊断的ROC曲线下面积是0.931,敏感度91.5%,特异度94.1%,阳性预测值88.9%,阴性预测值87.4%,优于每项指标单独的检测结果。因此,外周血细胞参数变化可能与COVID-19病情变化相关,MPV、P-LCR联合NLR检测可能对COVID-19的鉴别诊断及预后评估具有辅助价值。

新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)的病原体——新型冠状病毒(2019 novel coronavirus, 2019-nCoV)是一种单链RNA病毒,属于乙型冠状病毒属。COVID-19多以发热、咳嗽、乏力为首发症状,并且传染性强,潜伏期长[1]。血细胞检测是一项快速简便的诊断方法,为COVID-19诊疗提供重要辅助参考,有研究显示COVID-19患者发病早期白细胞总数(white blood cell count,WBC)和淋巴细胞绝对数(absolute lymphocyte count,LYM#)正常或减少[2]。血小板是机体对抗病原体的第一道防线,在感染免疫中发挥重要作用[3],曾有研究发现COVID-19患者发病的初期血小板总数(platelet count,PLT)也会出现下降趋势[4, 5]。本研究分析COVID-19患者血细胞的检测结果,以探讨血小板体积分布宽度(platelet volume distribution width,PDW)、平均血小板体积(mean platelet volume,MPV)、大血小板比率(platelet-large contrast ratio,P-LCR)及中性粒细胞/淋巴细胞比值(neutrophil-lymphocyte ratio,NLR)在不同病情严重程度COVID-19患者的表达水平以及对预后评估的辅助价值。
1.对象:采用回顾性研究方法,选择2020年1至5月在天津市第三中心医院和天津市津南医院就诊的69例COVID-19确诊患者作为研究对象,所有患者诊断符合国家卫生健康委员会制定的《新型冠状病毒肺炎诊疗方案(试行第八版)》[6]新型冠状病毒感染的诊断标准及分型标准。依据病情危重程度与临床状况将69例COVID-19患者分为3组:轻型组(15例)、普通型组(46 例)、危重型组(8 例)。70例对照组患者纳入标准依据《新型冠状病毒肺炎诊疗方案(试行第八版)》[6]:连续两次新型冠状病毒核酸检测阴性(釆样时间至少间隔1 d)且发病7 d后新型冠状病毒特异性抗体IgM和IgG仍为阴性。对照组70例患者做进一步病原菌检测结果为11例肺炎支原体感染、39例甲型流感病毒感染、20例乙型流感病毒感染。各组COVID-19患者与对照组患者均排除血液系统疾病及服用影响血小板数量和功能的药物。69例患者中63例患者经治疗后达到《新型冠状病毒肺炎诊疗方案(试行第八版)》[6]的出院标准,在本研究中纳入预后良好组;6例患者出现呼吸窘迫、低氧血症、脓毒症休克及凝血功能紊乱,转入重症监护室进行治疗,在本研究中纳入预后不良组。本研究通过天津市第三中心医院医学伦理委员会批准(IRB2020-013-01),所有受试者或监护人均签署知情同意书。COVID-19患者与对照组患者的临床特征比较见表1。

各组COVID-19患者与对照组临床特征比较
各组COVID-19患者与对照组临床特征比较
| 项目 | 对照组(n=70) | 轻型组(n=15) | 普通型组(n=46) | 危重症组(n=8) |
|---|---|---|---|---|
| 年龄[岁,中位数(四分位数)] | 51(31,75) | 48(29,59) | 59(49,63) | 73(68,79)a |
| 性别 | ||||
男性[例(%)] | 36(52) | 7(47) | 24(52) | 5(63)a |
女性[例(%)] | 34(48) | 8(53) | 22(48) | 3(37)b |
| 基础疾病[例(%)] | ||||
冠状动脉粥样硬化性心脏病 | 5(7.1) | 1(6.7) | 6(12.5) | 4(66.7)b |
高血压 | 6(8.5) | 1(6.7) | 5(10.4) | 2(33.3)b |
缺血性脑卒中 | 1(1.0) | 1(6.7)a | 1(2.1) | 3(50.0)b |
糖尿病 | 5(7.1) | 1(6.7) | 4(8.3) | 4(66.7)b |
| 武汉旅居史[例(%)] | 0(0) | 1(6.7)b | 4(8.3)b | 1(16.7)b |
| 确诊患者接触史[例(%)] | 0(0) | 12(80.0)b | 35(72.9)b | 6(100.0)b |
注:a与对照组比较, P<0.05;b与对照组比较,P<0.01
2.设备与方法:(1)试剂与仪器:Sysmex XN-1000全自动细胞分析仪购自日本希森美康医用电子有限公司;使用配套试剂、校准品和质控品均由日本希森美康医用电子有限公司提供。乙二胺四乙酸二钾(disodium versenate,EDTA-K2)抗凝真空采血管由美国碧迪公司提供。(2)方法:抽取待检者2 ml EDTA-K2抗凝静脉血,由具有相应资质检验人员在采血后2 h完成检测,检测项目包括:白细胞总数(WBC)、中性粒细胞绝对数(NE#)、淋巴细胞绝对数(LY#)、中性粒细胞/淋巴细胞比值(NLR)、红细胞计数(RBC)、血红蛋白(Hb)、血小板总数(PLT)、平均血小板体积(MPV)、血小板体积分布宽度(PDW)、大血小板比率(P-LCR)。
3.统计学方法:采用SPSS 22.0软件进行统计分析,非正态分布资料采用非参数检验以中位数(四分位数)[M(P25,P75)]表示,组间两两比较采用Kruskal-Wallis秩和检验,组内治疗前与治疗后比较采用Mann-Whitney U检验;血细胞分析各项参数与病情危重程度的相关性分析采用二元Logistic回归分析;采用受试者工作特征(receiver operator characteristic, ROC)曲线评价各相关因素对COVID-19鉴别诊断的辅助评估价值,ROC曲线下面积(area nuder the curve, AUC)越接近1则提示准确性越高,0.5~0.7时提示准确性较低,AUC 0.7~0.9是提示具有一定程度的准确性,AUC>0.9时提示准确性较高。双侧检验,检验水准α=0.05。
1.轻型组、普通型组、危重症组与对照组血细胞分析结果比较:普通型组WBC、NE#、LY#低于对照组,差异均有统计学意义(Z=-8.46, P<0.01;Z=-7.43, P<0.01;Z=-9.52, P<0.01), 危重型组WBC、NE#明显高于对照组,差异均有统计学意义(Z=-5.63, P<0.01;Z=-9.19,P<0.01),LY#明显低于对照组,差异有统计学意义(Z=-9.34, P<0.01);NLR随病情加重而升高,各组间差异有统计学意义(Z=17.61, P<0.01);COVID-19患者PLT、PDW、MPV、P-LCR随病情加重而明显下降,各组间差异均有统计学意义(Z=9.47,P<0.01;Z=11.41,P<0.01;Z=16.76,P<0.01;Z=13.97,P<0.01),见表2。

COVID-19轻型组、普通型组和危重症组与对照组患者血细胞分析检测结果比较[中位数(四分位数)]
COVID-19轻型组、普通型组和危重症组与对照组患者血细胞分析检测结果比较[中位数(四分位数)]
| 项目 | 对照组(n=70) | 轻型组(n=15) | 普通型组(n=46) | 危重型组(n=8) | Z值 | P值 |
|---|---|---|---|---|---|---|
| WBC (×109/L) | 9.85(7.71, 11.21) | 8.44(6.98,10.81) | 6.85(5.18, 8.81)a | 11.98(8.21, 13.43)abc | 4.27 | <0.01 |
| NE# (×109/L) | 5.55(4.21, 6.12) | 4.77(3.45,5, 61) | 4.16(3.05, 5.41)a | 7.31(5.18, 9.68)abc | 8.61 | <0.01 |
| LY# (×109/L) | 2.84(1.83, 3.57) | 2.24(1.88, 3.19) | 2.01(1.58, 2.81)a | 1.41(1.07, 2.17)abc | 11.15 | <0.01 |
| NLR | 1.77(1.34, 2.24) | 2.25(1.49,3.14) | 2.58(1.79, 4.12) | 4.54(2.34, 6.54) | 17.61 | <0.01 |
| RBC (×1012/L) | 4.33(3.36, 5.75) | 4.57(3.43, 6.14) | 4.45(3.86, 5.99) | 4.29(3.45, 5.22) | 4.81 | >0.05 |
| Hb (g/L) | 143(123, 168) | 141(122, 165) | 138(121, 154) | 135(105, 144) | 3.14 | >0.05 |
| PLT (×109/L) | 228(172, 241) | 203(124, 223) | 169(114, 201)a | 126(102, 148)abc | 9.47 | <0.01 |
| PDW(%) | 10.9(9.6, 13.4) | 10.1(9.7, 11.3) | 9.5(8.7, 11.3)a | 9.0(8.8, 10.4)abc | 11.41 | <0.01 |
| MPV(fl) | 10.8(8.7, 12.8) | 9.1(7.1, 11.2) | 8.4(6.4, 10.2)a | 7.8(6.9, 9.2)abc | 16.76 | <0.01 |
| P-LCR(%) | 15.6(12.5, 16.8) | 13.1(10.2, 16.4) | 11.5(9.4, 15.4)a | 9.5(7.1, 12.4)abc | 13.97 | <0.01 |
注:a示与对照组比较,P<0.01;b示与轻型组比较,P<0.01;c示与危重症组比较,P<0.01;WBC:白细胞总数;NE#:中性粒细胞绝对数; LY#:淋巴细胞绝对数;NLR:中性粒细胞/淋巴细胞比值;RBC:红细胞计数;Hb:血红蛋白; PLT:血小板总数;PDW:血小板体积分布宽度;MPV:平均血小板体积;P-LCR:大血小板比率
2.COVID-19患者血细胞分析参数的二元Logistic回归分析:以危重型设定为1,普通型和重型设定为0,作为因变量,各项检测指标作为自变量,进行二元Logistic回归分析。分析结果显示,MPV、P-LCR、NLR是预测COVID-19病情严重程度的危险因素;MPV、P-LCR与COVID-19患者得危重型呈负相关性,MPV、P-LCR每减少1个单位,患者得危重型的风险比轻型和普通型提高1.004和1.097倍;NLR与COVID-19患者得危重型呈正相关性,NLR每增加1个单位,COVID-19患者得危重型的风险比轻型和普通型提高1.052倍,详见表3。

COVID-19患者血细胞分析各项参数Logistic回归分析结果
COVID-19患者血细胞分析各项参数Logistic回归分析结果
| 指标 | 系数 | 标准误 | Wald检验 | 显著性 | 优势比 | 95%CI值 |
|---|---|---|---|---|---|---|
| WBC(×109/L) | -2.666 | 1.612 | 2.736 | 0.098 | 0.071 | 0.023~0.147 |
| NE#(×109/L) | -8.35 | 7.652 | 1.191 | 0.275 | 0.123 | 0.053~0.312 |
| LY#(×109/L) | 5.454 | 2.786 | 3.087 | 0.069 | 1.021 | 0.517~2.149 |
| NLR | 3.328 | 8.995 | 3.658 | 0.016 | 1.052 | 0.613~2.312 |
| RBC(×1012/L) | -2.967 | 2.737 | 1.175 | 0.278 | 0.751 | 0.319~1.216 |
| HGB(g/L) | 0.107 | 0.074 | 2.079 | 0.149 | 1.113 | 0.647~2.339 |
| PLT(×109/L) | -0.001 | 0.017 | 0.007 | 0.935 | 0.999 | 0.417~2.159 |
| PDW | -0.229 | 0.441 | 0.271 | 0.603 | 0.795 | 0.327~1.859 |
| MPV(fl) | -5.651 | 1.941 | 8.479 | 0.034 | 1.004 | 0.477~2.419 |
| P-LCR(%) | -1.627 | 0.635 | 6.564 | 0.046 | 1.097 | 0.557~2.559 |
注:WBC:白细胞总数;NE#:中性粒细胞绝对数; LY#:淋巴细胞绝对数;NLR:中性粒细胞/淋巴细胞比值;RBC:红细胞计数;Hb:血红蛋白; PLT:血小板总数;PDW:血小板体积分布宽度;MPV:平均血小板体积;P-LCR:大血小板比率
3.各组COVID-19患者治疗前与治疗后MPV、P-LCR、NLR比较:预后良好组治疗后MPV、P-LCR高于治疗前,差异具有统计学意义(Z=-6.47,P<0.01;Z=-5.36,P<0.01), NLR明显低于治疗前,差异具有统计学意义(Z=-8.13,P<0.01);预后不良组治疗后MPV、P-LCR明显低于治疗前,差异具有统计学意义(Z=-9.46,P<0.01;Z=-6.81,P<0.01),NLR明显高于治疗前,差异具有统计学意义(Z=-3.24,P<0.01);预后不良组治疗前与治疗后MPV、P-LCR、NLR与预后良好组比较,差异均有统计学意义(P<0.01), 详见表4。
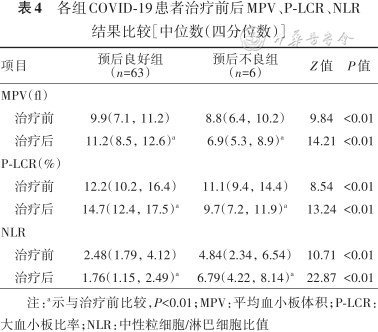
各组COVID-19患者治疗前后MPV、P-LCR、NLR结果比较[中位数(四分位数)]
各组COVID-19患者治疗前后MPV、P-LCR、NLR结果比较[中位数(四分位数)]
| 项目 | 预后良好组 (n=63) | 预后不良组 (n=6) | Z值 | P值 |
|---|---|---|---|---|
| MPV(fl) | ||||
治疗前 | 9.9(7.1, 11.2) | 8.8(6.4, 10.2) | 9.84 | <0.01 |
治疗后 | 11.2(8.5, 12.6)a | 6.9(5.3, 8.9)a | 14.21 | <0.01 |
| P-LCR(%) | ||||
治疗前 | 12.2(10.2, 16.4) | 11.1(9.4, 14.4) | 8.54 | <0.01 |
治疗后 | 14.7(12.4, 17.5)a | 9.7(7.2, 11.9)a | 13.24 | <0.01 |
| NLR | ||||
治疗前 | 2.48(1.79, 4.12) | 4.84(2.34, 6.54) | 10.71 | <0.01 |
治疗后 | 1.76(1.15, 2.49)a | 6.79(4.22, 8.14)a | 22.87 | <0.01 |
注:a示与治疗前比较,P<0.01;MPV:平均血小板体积;P-LCR:大血小板比率;NLR:中性粒细胞/淋巴细胞比值
4.ROC曲线分析MPV、P-LCR和NLR对COVID-19的诊断价值:将COVID-19确诊患者与对照组患者MPV、P-LCR和NLR进行ROC曲线分析,结果显示NLR截断点为2.81时,曲线下面积是0.801,敏感度为83.3%,特异度为79.3%,阳性预测值80.2%,阴性预测值76.1%,MPV截断点为8.25 fl时,曲线下面积是0.798,敏感度为77.5%,特异度为82.1%,阳性预测值75.1%,阴性预测值72.6%,P-LCR在截断点为12.24%时,曲线下面积是0.721, 敏感度为74.9%,特异度为81.4%,阳性预测值74.2%,阴性预测值78.7%;三项指标联合检测对COVID-19诊断的ROC曲线下面积是0.931,敏感度为91.5%,特异度为94.1%,阳性预测值为88.9%,阴性预测值为87.4%,漏诊率为8.5%,误诊率为5.9%,均优于单项指标的检测结果(见表5和图1)。
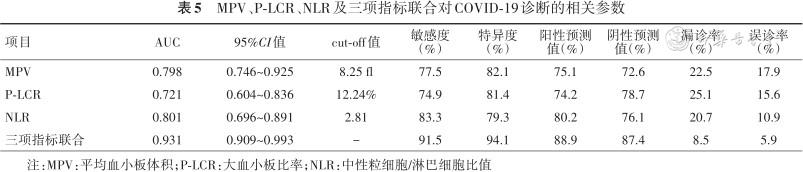
MPV、P-LCR、NLR及三项指标联合对COVID-19诊断的相关参数
MPV、P-LCR、NLR及三项指标联合对COVID-19诊断的相关参数
| 项目 | AUC | 95%CI值 | cut-off值 | 敏感度(%) | 特异度(%) | 阳性预测值(%) | 阴性预测值(%) | 漏诊率(%) | 误诊率(%) |
|---|---|---|---|---|---|---|---|---|---|
| MPV | 0.798 | 0.746~0.925 | 8.25 fl | 77.5 | 82.1 | 75.1 | 72.6 | 22.5 | 17.9 |
| P-LCR | 0.721 | 0.604~0.836 | 12.24% | 74.9 | 81.4 | 74.2 | 78.7 | 25.1 | 15.6 |
| NLR | 0.801 | 0.696~0.891 | 2.81 | 83.3 | 79.3 | 80.2 | 76.1 | 20.7 | 10.9 |
| 三项指标联合 | 0.931 | 0.909~0.993 | - | 91.5 | 94.1 | 88.9 | 87.4 | 8.5 | 5.9 |
注:MPV:平均血小板体积;P-LCR:大血小板比率;NLR:中性粒细胞/淋巴细胞比值


注:MPV示平均血小板体积;P-LCR示大血小板比率;NLR示中性粒细胞/淋巴细胞比值
COVID-19是由新发现的冠状病毒所引起的具高度传染性的疾病[7, 8]。COVID-19主要致病机制是由于病毒进入机体后导致机体细胞免疫功能急剧下降,甚至威胁患者生命[9, 10]。COVID-19与普通病毒性肺炎具有相似的临床症状及影像学特征,核酸检测阳性是确诊病例诊断的“金标准”。血细胞检查作为快速简捷的检测方法为COVID-19的诊疗提供重要辅助依据,诊疗指南提出患者发病早期外周血白细胞总数正常或减少,淋巴细胞计数减少。本研究采用回顾性分析方法对69例COVID-19患者进行研究,进一步探讨血细胞检查各项参数在COVID-19不同病情危重程度中的表达水平及对疾病的预后评估价值。69例COVID-19患者依病情严重程度分为轻型组、普通型和危重型组。将同期在发热门诊就诊,并且在隔离病房观察后排除2019-nCoV感染的患者作为对照组,对照组经病原体检测84%为流感病毒感染。研究结果显示,普通型组外周血WBC、NEU#低于对照组,LYM#依据轻型组、普通型、危重症组的次序呈下降趋势,COVID-19患者发病初期的白细胞计数不高, 与普通病毒性肺炎特点相符, LYM#下降则与普通病毒感染不同。分析COVID-19患者LYM#降低的原因可能与2019-nCoV会抑制淋巴细胞生成或对淋巴细胞的直接或间接杀灭有关,使患者免疫功能受损[11, 12]。由于COVID-19患者LYM#降低导致患者NLR明显高于对照组,本研究危重症组NLR明显高于对照组,与文献报道一致[13]。
本研究各组COVID-19患者的RBC、HGB与对照组比较差异无统计学意义,虽然没有统计学意义,但是伴随病情的不良演变有下降趋势。有研究表明[14],部分COVID-19患者RBC、HGB下降,伴随病情好转上升。分析原因可能炎性反应抑制骨髓红细胞系统的造血功能,引起RBC、HGB下降,但RBC具有较强的代偿增生能力并且寿命较长,所以,在本研究初期COVID-19患者的外周血RBC下降不是很明显。
PLT来源于骨髓中的巨核细胞, 具有黏附、聚集和趋化作用, 可吞噬外来物质并释放炎症介质,是人体重要的免疫细胞,通过与多种免疫细胞协同而发挥免疫调节功能[15]。本研究结果显示各组COVID-19患者PLT计数低于对照组。有研究表明,肺组织是造血干/祖细胞贮存和产生血小板的器官,肺炎患者微血管内皮受损,并且处于低氧环境,导致PLT被激活,进而导致PLT消耗量显著增多,与文献报道一致[16, 17]。PLT参数包括MPV、PDW 、P-LCR。MPV是反映血小板大小的参数,大血小板多为新生的血小板,活性物质含量比较高,其代谢和功能更强,因此,MPV能反映外周血中血小板的功能状态,PDW是血小板体积分布的变异系数,代表血小板体积大小不均的程度。P-LCR 为大血小板所占的比率。当PLT减少时,如果骨髓代偿性功能正常,MPV、PDW、P-LCR会出现增高趋势,如果MPV、PDW、P-LCR也出现下降趋势,提示骨髓代偿能力受损[18, 19]。
本研究对不同病情严重程度的COVID-19患者的血细胞分析参数进行多因素Logistic 回归分析,发现MPV、P-LCR和NLR与COVID-19病情严重程度具有相关性,进一步研究发现COVID-19患者预后良好组治疗后MPV、P-LCR检测水平高于治疗前,预后不良组治疗后MPV、P-LCR检测水平低于治疗前。由此可见血小板参数的变化与COVID-19患者不同病情严重程度以及病情转归具有相关性。据报道部分严重急性呼吸综合征(severe acute respiration syndrome, SARS)的患者PLT和MPV减低[20, 21], 研究者认为引起SARS的冠状病毒(SARA-CoV)会破坏患者骨髓造血功能。由于2019-nCoV与SARS-CoV同属于冠状病毒,并且两者具有极高相似度的基因组序列[22],因此,推测2019-nCoV引起PLT参数变化可能是由于2019-nCoV破坏患者骨髓的造血功能所致。通过ROC曲线进一步分析MPV、P-LCR及NLR对COVID-19的辅助诊断价值,结果显示NLR截断点为2.81时,曲线下面积是0.801,敏感度和阳性预测值(83.3%,80.2%)高于MPV和P-LCR的敏感度和阳性预测值(77.5%,75.1%;74.9%,74.2%);MPV在截断点为8.25 fl时,曲线下面积是0.798,特异度为82.1%高于P-LCR和NLR(81.4%,79.3%);P-LCR在截断点为12.24%时,曲线下面积是0.721, 阴性预测值为78.7%,高于MPV和NLR(72.6%,76.1%);三项联合检测的ROC曲线下面积为0.931,敏感度为91.5%,特异度为94.1%,阳性预测值为88.9%,阴性预测值为87.4%,漏诊率为8.5%,误诊率为5.9%,诊断效能最佳。因此,MPV、P-LCR联合NLR可能成为新的评估指标来协助临床进行鉴别诊断。
综上所述,本研究显示MPV、P-LCR及NLR表达水平对COVID-19鉴别诊断及预后评估具有一定的辅助意义。由于本研究收集的危重型COVID-19的病例数较少,数据间的比对存在一定的局限性[23, 24, 25, 26]。
所有作者均声明不存在利益冲突



























