
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,55岁。在当地医院体检时胸部X线检查示:前纵隔主动脉弓前方见一5.8 cm×5.8 cm的肿块,病灶边缘清晰,密度均匀,影像学印象:前纵隔肿瘤(图1)。患者无咳嗽咳痰,无胸闷气短,无胸部疼痛,无饮水呛咳及声音嘶哑,无四肢无力。于2013年9月2日来我院就诊。实验室检查,血常规:白细胞5.4×109/L,淋巴细胞0.274,中性粒细胞0.508,血小板161×109/L;血清葡萄糖6.28 mmol/L,血钾4.30 mmol/L,血钙2.28 mmol/L。胸部CT示:胸腺区见一实性肿块,边界清,大小约5 cm×4 cm,考虑胸腺瘤可能,纵隔未见肿大的淋巴结,未见胸水(图2)。完善术前检查,于2013年9月9日行胸腔镜下胸腺瘤切除术,术中见肿瘤位于前上纵隔胸腺区,质硬,包膜尚完整,完整切除肿瘤。
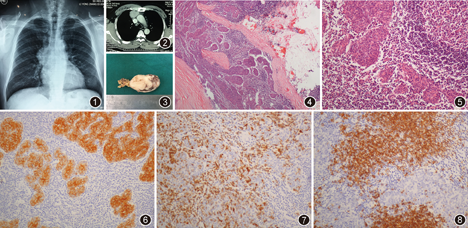

病理检查:大体检查:结节性肿物一枚,体积6.0 cm×6.0 cm×5.5 cm,表面光滑,似有包膜,切面呈实性,灰白灰红,质地中等(图3)。镜下观察:低倍镜下肿瘤境界清楚,纤维组织分割略呈多结节样,周围有纤维性包膜,局灶向周围脂肪组织内膨胀性生长;高倍镜下上皮样肿瘤细胞呈结节状分布,结节呈多发性散在或局部融合,瘤细胞呈短梭形或卵圆形,细胞形态温和,胞质粉染,细胞核卵圆形,核仁不明显,未见明显异型性及核分裂象(图4,图5)。间质内可见丰富的淋巴细胞,部分区域可见初级滤泡或有生发中心的次级滤泡。免疫组织化学染色显示:上皮成分细胞角蛋白(CK)、CK19(图6)、CK5/6、CAM5.2、CD1α(图7)阳性;淋巴细胞CD20(图8)、CD3、CD99、CD5、末端脱氧核苷酸转移酶(TdT)、CD10、CD23阳性,CD57阴性,Ki-67阳性指数约为30%(以淋巴细胞表达为主)。
病理诊断:伴有淋巴样间质的微结节型胸腺瘤。
随访:术后随访32个月,无复发。
胸腺瘤是成人最常见的胸腺肿瘤,伴有淋巴样间质的微结节型胸腺瘤(MNT)是胸腺瘤的一种罕见亚型,在WHO 2004版胸腺肿瘤分类中开始单独列出,约占所有病例的1%[1]。最早由Suster和Moran[2]报道18例,截至目前检索到国外病例报道总数不到50例,国内仅检索到5例报道[3]。患者年龄41~80岁(中位年龄64.5岁),男性略占优势,男女之比为1.5∶1.0。一般为体检时偶然发现,多无症状,除Ströbel等[4]报道1例伴有重症肌无力外,其他均未发现重症肌无力及其他自身免疫性疾病。部分病例有高血压、糖尿病等慢性病史。Masaoka分期多为Ⅰ期或Ⅱ期。几乎所有病例均发生在前纵隔,文献报道的仅3例为异位的MNT[5]。
由于MNT发病率低,对其生物学行为仍存争议。大多数研究资料显示该病有良好的生物学行为及预后。本例界限清楚有包膜,肿瘤细胞形态温和,无明显异型性及核分裂象,随访32个月患者一般状况良好,无复发表现,也支持MNT是偏良性的肿瘤。但文献中也有恶性MNT的相关报道。Tateyama等[6]通过对11例MNT的形态学分型研究提出MNT包括良性到恶性的谱系过程,Weissferdt和Moran[7]报道的5例伴淋巴样间质的微结节型胸腺癌与MNT一样肿瘤细胞也呈特征性的微结节状分布,伴有大量的淋巴细胞间质。但是上皮细胞异型性明显、核分裂象易见,可见坏死。作者认为这5例为相应的恶性MNT。Suster和Moran[2]报道的18例MNT中1例可见形态温和的梭形细胞和分化差的肿瘤细胞的移行,提示MNT存在恶性变的可能。除Weissferdt和Moran[7]报道的1例死亡外,其余报道的恶性病例目前状况良好。由于资料有限,恶性MNT与MNT是两个独立的肿瘤还是一个连续的过程尚不明确,仍需更多病例资料积累及分子遗传学方面的研究加以论证。
MNT的病因学和发病机制仍不明确。一般认为起源于胸腺上皮的前驱形式。MNT多独立发生,偶尔可以合并其他典型的A型和AB型胸腺瘤。MNT大体上境界清楚,直径2~10 cm,切面多呈实性,一个显著特征是多伴有囊性变[2,3],Kim等[8]报道1例在多房胸腺囊肿基础上继发的MNT。本例未见囊性特征。组织学形态由特征性的多发散在或融合的上皮性结节及分隔结节的丰富淋巴细胞间质组成,淋巴细胞间质内常可见典型的淋巴滤泡形成。
免疫表型方面,肿瘤性上皮细胞表达CK5/6、CK19,部分表达CAM5.2和CD57(约占60%),通常不表达CD20;间质中的淋巴细胞主要为CD20阳性的B细胞,成熟的CD3、CD5阳性的T细胞可局灶超过B细胞,围绕上皮结节周围的峡带区可见未成熟的CD1α、CD99、TdT均阳性的胸腺T细胞。CD1α阳性的朗格汉斯细胞弥散分布在上皮性结节中,而Fascin阳性的树突状细胞主要分布在淋巴间质中。浆细胞也常见于间质中,多为多克隆性。Ströbel等[4]研究显示,MNT中淋巴间质中的B细胞部分呈单克隆(6/18),而其他类型的胸腺瘤均为多克隆。结果提示MNT的上皮细胞表达高水平的树突状细胞、T细胞和B细胞的趋化因子,异常趋化因子的表达促进单克隆B细胞的发生,继而发展为纵隔淋巴瘤。
鉴别诊断:(1)AB型胸腺瘤:由淋巴细胞较少的A型胸腺瘤和富于淋巴细胞的B型胸腺瘤样成分混合组成,与MNT不同,淋巴间质中有上皮细胞混杂分布,而MNT中上皮成分与淋巴组织分界较清。(2)伴淋巴样间质的微结节型胸腺癌:是胸腺癌的罕见变异型,Weissferdt和Moran [7]报道的5例与MNT一样肿瘤细胞也呈特征性的微结节状分布。但是胸腺癌多呈浸润性生长方式,细胞异型明显、核分裂象易见,可见坏死。上皮细胞CD117、CD5常阳性,间质缺乏不成熟的T细胞。这些均与MNT不同。(3)淋巴上皮样癌:淋巴上皮样癌的上皮细胞具有明显的异型性,癌细胞团间的淋巴细胞为成熟的T细胞,而不是幼稚的胸腺T细胞,免疫组织化学TdT有助于鉴别,此外,上皮细胞表达EB病毒,而MNT中EB病毒呈阴性。
目前MNT多采用手术切除,预后良好,文献报道的病例罕见复发或转移。Ishikawa等[9]通过对6例MNT中朗格汉斯细胞和树突状细胞在肿瘤性上皮及淋巴间质中的分布情况研究,认为肿瘤良好预后可能与朗格汉斯细胞的免疫应答有关。本例患者手术切除后未行任何治疗,目前一般状况良好。鉴于MNT与其他胸腺瘤生物学行为的差异,我们在日常诊断工作中应提高对此类肿瘤的认识,避免过度治疗。


























