
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,60岁。体检发现右肾肿瘤1个月,伴右侧腰腹部疼痛,于2016年7月入院。患者无低热、盗汗,无排尿费力及肉眼血尿,无尿急、尿痛及尿频。腹部CT检查示:右肾上极见等密度类圆形结节,强化程度低于肾实质,与肾脏界限欠清,考虑恶性肿瘤可能性大(图1)。临床诊断:右肾肿瘤。术中见右肾上极一肿物突出肾脏表面,直径约2 cm,切除肿物及部分肾组织送检。
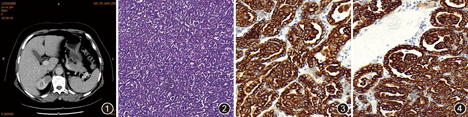

大体观察:部分肾组织,大小5 cm×3 cm×2 cm,距断端1 cm处见一直径约2 cm灰白肿物,质地略脆,边界清楚,似有包膜。镜下观察:瘤组织边界清楚,与周围肾组织有较厚的纤维性假包膜分隔,瘤组织主要呈密集的腺泡状及实性排列,大多数腺泡腔内可见增生的小簇状上皮样细胞团,呈肾小球样(图2)。瘤细胞小,胞质稀少、浅嗜酸,核小圆形,染色质均匀,偶见核仁,核分裂象少见。间质很少。免疫组织化学染色示:瘤细胞细胞角蛋白7(CK7,图3)、P504s(图4)、波形蛋白、上皮细胞膜抗原(EMA)均呈弥漫强阳性,而CD10、WT1、CD57、CDH17、BRAF V600E均为阴性。PCR检测BRAF(V600E)突变阴性。
(右肾)伴有大量肾小球样结构的乳头状肾细胞癌[Ⅰ型,直径2 cm,WHO/国际泌尿病理协会(ISUP)核分级Ⅱ级],周围手术切缘未见癌累及。
术后3个月,未见复发和转移。
乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)是起源于肾小管上皮细胞的恶性肿瘤,以形成多少不一的乳头状和管状结构为其组织学特征,约占肾细胞癌的3%~15%[1,2]。2016年WHO肾肿瘤组织学分类将PRCC分为三型,即Ⅰ型、Ⅱ型和嗜酸型[3]。此例瘤组织内可见大量肾小球样结构,而不见典型乳头状结构,病理诊断时很容易误诊为其他良恶性小细胞性肾肿瘤。
(1)后肾腺瘤[4]:瘤组织由紧密排列的小腺管或小腺泡组成,瘤细胞大小较一致,核圆深染,核仁不明显;约50%的肿瘤有乳头状结构,可见管内有钝的乳头突起,似肾小球样结构;免疫组织化学示肿瘤细胞WT1、S-100蛋白和CD57均阳性,而EMA、CK7及P504s均阴性,与PRCC有明显不同。另外,近年来有文献报道Cadherin17(CDH17)及BRAF(V600E)免疫组织化学阳性有助于后肾腺瘤的诊断。Yakirevich等[5]首次对CDH17在后肾腺瘤、上皮样为主型肾母细胞瘤及实性型乳头状肾细胞癌中进行研究,通过免疫组织化学进行分析:正常成人肾实质不表达CDH17,在胎儿肾脏发育后期其肾小球和远端肾单位链接部开始出现CDH17的表达。大多数后肾腺瘤(81%)CDH17呈膜阳性表达,而上皮样主型肾母细胞瘤和实性型乳头状肾细胞癌均不表达。目前研究已证实约90%的后肾腺瘤存在BRAF(V600E)突变,并且发现BRAF基因第15号外显子突变在肾细胞癌中极其罕见。Udager等[6]通过研究发现BRAF(V600E)免疫组织化学在后肾腺瘤中表达敏感性达88%,特异性高达100%。同时作者通过组织芯片技术评估了BRAF(V600E)免疫组织化学在不同肾细胞癌亚型中均无显著的表达。(2)黏液样小管状和梭形细胞癌(MTSCC):PRCC偶尔也可见梭形细胞成分,可与MTSCC混淆。但后者瘤组织常可见到大量小管状结构及特征性的黏液样基质,瘤细胞形态较温和,核分裂象稀少[7];免疫组织化学MTSCC与PRCC结果有较多重叠,均表达CK7、EMA、P504s和波形蛋白。Shen等[8]推测MTSCC可能为PRCC的一个形态学变异,但MTSCC缺乏PRCC中常见的细胞遗传学异常,两类肿瘤患者预后不同,提示MTSCC和PRCC是肾脏肿瘤中2种完全独立的亚型。(3)肾类癌:原发性肾类癌非常罕见,一般为边界清楚的实性肿瘤。瘤细胞比较一致,胞质略嗜酸性,核仁不明显,核染色质呈细颗粒状,瘤细胞呈小梁状、条索状、缎带状、假腺样结构排列,局灶形成典型的菊形团样结构,免疫表型:嗜铬粒素A、突触素和CD56等神经内分泌标记均为阳性,有助于与PRCC鉴别。(4)肾母细胞瘤(上皮样型):好发于儿童,瘤组织内除上皮成分外,广泛取材常可见到多少不一的未分化肾胚芽组织以及向平滑肌、横纹肌、神经等成分分化的间质,且上皮细胞核细长、排列紧密、异型明显,核分裂象易见。免疫表型:瘤细胞表达WT1、波形蛋白,也可有灶状神经元特异性烯醇化酶、CK、结蛋白等表达,但P504s阴性。


























