
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2017版WHO内分泌肿瘤分类根据肿瘤的病理、临床及基因学特点,对内分泌肿瘤的分类进行了全面的更新[1]。新版WHO中甲状腺肿瘤分类总体可分为上皮性肿瘤、非上皮性肿瘤和继发肿瘤三大类(表1),其中最重要的进展在于甲状腺滤泡上皮细胞起源的高分化肿瘤,乳头和滤泡、良性和恶性分类的更新[1],并新增加了一组甲状腺交界性肿瘤。嗜酸细胞肿瘤从滤泡性肿瘤中剔除,成为一组独立的病变。低分化癌诊断标准进一步明确。间变和鳞状细胞癌之间的相关性,其他如涎腺、胸腺和腮弓衍生物罕见肿瘤等也有描述。本文就甲状腺滤泡上皮细胞起源的肿瘤分类的重要变化做一简要介绍。

新版WHO甲状腺肿瘤分类
新版WHO甲状腺肿瘤分类
| 新版WHO甲状腺肿瘤分类 | ICD-O编码 | 新版WHO甲状腺肿瘤分类 | ICD-O编码 | |||
|---|---|---|---|---|---|---|
| 滤泡性腺瘤 | 8330/0 | 异位胸腺瘤 | 8580/3 | |||
| 透明变梁状肿瘤 | 8336/1a | 伴胸腺样分化的梭形细胞肿瘤 | 8588/3 | |||
| 其他包裹性滤泡性肿瘤 | 甲状腺内胸腺癌 | 8589/3 | ||||
| 恶性潜能未定的滤泡性肿瘤(FT-UMP) | 8335/1a | 副神经节瘤和间叶/平滑肌源性肿瘤 | ||||
| 恶性潜能未定的高分化肿瘤(WT-UMP) | 8348/1a | 副神经节瘤 | 8693/3 | |||
| 具有乳头样核特点的非浸润性包裹性滤泡性 | 8349/1a | 外周神经鞘瘤(PNSTs) | ||||
| 肿瘤(NIFTP) | 神经鞘瘤 | 9560/0 | ||||
| 甲状腺乳头状癌(PTC) | 恶性外周神经鞘瘤 | 9540/3 | ||||
| 甲状腺乳头状癌 | 8260/3 | 良性血管源性肿瘤 | ||||
| 滤泡型乳头状癌 | 8340/3 | 血管瘤 | 9120/0 | |||
| 包裹型乳头状癌 | 8343/3 | 海绵状血管瘤 | 9121/0 | |||
| 微小乳头状癌 | 8341/3 | 淋巴管瘤 | 9170/0 | |||
| 柱状细胞型 | 8344/3 | 血管肉瘤 | 9120/3 | |||
| 嗜酸细胞型 | 8342/3 | 平滑肌源性肿瘤 | ||||
| 甲状腺滤泡腺癌(FTC),NOS | 8330/3 | 平滑肌瘤 | 8890/0 | |||
| 滤泡腺癌,微小浸润型 | 8335/3 | 平滑肌肉瘤 | 8890/3 | |||
| 滤泡腺癌,包裹型血管浸润型 | 8339/3a | 孤立性纤维性肿瘤 | 8815/1 | |||
| 滤泡腺癌,广泛浸润型 | 8330/3 | 淋巴造血系统肿瘤 | ||||
| 嗜酸细胞肿瘤 | 朗格汉斯细胞组织细胞增生症 | 9751/3 | ||||
| 嗜酸细胞腺瘤 | 8290/0 | Rosai-Dorfman病 | ||||
| 嗜酸细胞癌 | 8290/3 | 滤泡树突状细胞肉瘤 | 9758/3 | |||
| 甲状腺低分化癌 | 8337/3 | 甲状腺原发性淋巴瘤 | ||||
| 甲状腺未分化癌 | 8020/3 | 生殖细胞肿瘤 | ||||
| 鳞状细胞癌 | 8070/3 | 良性畸胎瘤(0级或1级) | 9080/0 | |||
| 甲状腺髓样癌 | 8345/3 | 未成熟畸胎瘤(2级) | 9080/1 | |||
| 混合性髓样-滤泡性癌 | 8346/3 | 恶性畸胎瘤(3级) | 9080/3 | |||
| 黏液表皮样癌 | 8430/3 | 继发性肿瘤 | ||||
| 黏液表皮样癌伴嗜酸性粒细胞增多 | 8430/3 | |||||
| 黏液癌 | 8430/3 | |||||
注:ICD-O编码示形态学编码来源于国际疾病分类(ICD-O)(898A)。编码0代表良性肿瘤,1代表可疑、不确定或交界性肿瘤,2代表原位癌和上皮内肿瘤Ⅲ级,3代表恶性肿瘤。鉴于对疾病的最新理解,新版WHO进行了部分修订。a代表IARC/WHO协会新证实的形态学编码·讲座·
新版WHO引入了甲状腺交界性(intermediate,borderline)肿瘤的概念,使甲状腺肿瘤谱系得以完善[1,2]。原甲状腺透明变梁状肿瘤被重新归类为交界性肿瘤,此外还包括以下两组病变[2]。
恶性潜能未定(uncertain malignant potential,UMP)的甲状腺肿瘤,为伴有可疑包膜或脉管浸润的包裹性或境界清楚的甲状腺滤泡生长模式的肿瘤[3],不关注甲状腺乳头状癌(papillary thyroid carcinoma, PTC)细胞核特点。并根据是否具有PTC细胞核特点,将其进一步分为两类:(1)恶性潜能未定的滤泡性肿瘤(follicular tumor,uncertain malignant potential,FT-UMP),指缺乏PTC细胞核特点的UMP。(2)恶性潜能未定的高分化肿瘤(well differentiated tumor,uncertain malignant potential,WT-UMP),指具有明确或者不确定性PTC细胞核特点的UMP。除外了包膜脉管浸润的WT-UMP为具有乳头样核特征的非浸润性甲状腺滤泡性肿瘤(non-invasive follicular thyroid neoplasm with papillary-like nuclear features,NIFTP)。可疑包膜浸润为肿瘤细胞浸润包膜但未穿透(有或无蘑菇样;图1)。当包膜厚且不规则时更有意义,但必须除外细针穿刺假象。新版中将广基范围内肿瘤细胞顶起纤维结缔组织被膜(穹顶样)时,同样定义为可疑包膜浸润。当血管间隙内肿瘤细胞巢缺乏内皮细胞被覆和相关血栓、纤维结缔组织内肿瘤细胞巢与血管接触,考虑到底是早期血管浸润还是纯粹肿瘤细胞巢和血管时,为可疑脉管浸润(图2)。WT-UMP的免疫组织化学表达谱类似滤泡型PTC,提示两者可能有关[4]。而FT-UMP则往往被诊断为可疑滤泡性肿瘤。UMP预后很好,目前仅有2例FT-UMP发生远处转移的报道[4,5]。
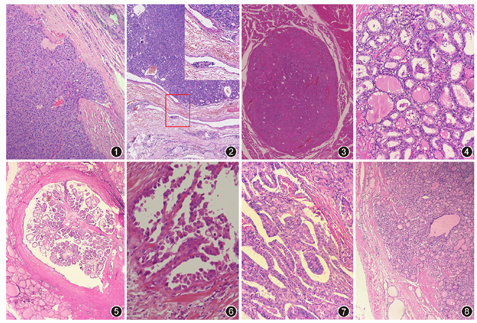

定义为具有PTC细胞核特点的非浸润性滤泡生长模式的甲状腺滤泡性肿瘤,具有极低度恶性潜能。在欧洲和北美国家,NIFTP约占所有甲状腺癌的10%~20%[6],而在亚洲发病率相对较低[4,7],男女比例约为1∶3~1∶4,发病年龄跨度较大,多数在40~60岁之间[8,9]。临床表现为无症状、可移动的包块,肿瘤较大的话可引起局部压迫症状,B超示界清的均匀低回声结节。大体上,NIFTP为具有完整包膜或界清的肿瘤,切面灰白质韧,出血囊性变等少见,通常直径2~4 cm。组织学上,诊断NIFTP必须满足以下4条:(1)包膜完整,或界限清楚;(2)缺乏浸润;(3)滤泡状生长模式;(4)PTC细胞核特点,细胞核评分主要依据以下3点:细胞核大小和形状;核膜不规则度;核染色质特点[10]。诊断NIFTP细胞核评分必须≥2分(图3,图4)[8,10]。除此之外,NIFTP必须除外>1%真性乳头、沙砾体、肿瘤性坏死、高核分裂象(≥3/10 HPF)及其他细胞特点(如>30%实性/梁状/岛状生长方式)等[10]。NIFTP常见的基因学改变是RAS突变、PPARG和THADH基因融合,偶见BRAF V601E突变,但一般无BRAF V600E突变。生物学行为上NIFTP类似于滤泡腺瘤,完整切除肿瘤后15年内复发和转移率低于1%[8],但若切缘阳性可致肿瘤复发[11]。
旧版WHO对PTC的定义为显示向滤泡细胞分化的证据,并具有明确PTC细胞核特点的恶性上皮性肿瘤。新版WHO在此概念的基础上,强调PTC通常为浸润性,诊断PTC需具备乳头、浸润或PTC细胞核特点。
新版WHO在旧版的基础上对PTC组织学类型进行了较大幅度的更新,新增了包裹型、鞋钉型。更新了微小乳头状癌、滤泡型、弥漫硬化型、高细胞型、柱状细胞型、嗜酸细胞型、透明细胞型、Warthin样型等,其中对滤泡型和高细胞型更新较大。原实性型改为实性/梁状型,原筛状型改为筛状/桑葚型;原PTC伴结节性筋膜炎样间质改为结节性筋膜炎样型。原PTC伴梭形细胞和巨细胞改为梭形细胞型。去掉了PTC伴鳞状细胞癌或黏液表皮样癌。(1)包裹型:新版WHO增加了包裹型,是指具有典型PTC细胞学特点,具有完整的纤维包膜、也可有局灶浸润的PTC(图5),约占所有PTC的10%[12],预后良好,可出现局部淋巴结转移,但血道转移罕见,5年生存率几近100%[13],需与滤泡腺瘤伴乳头状增生鉴别,后者无PTC细胞核特点。(2)鞋钉型(hobnail variant):新版WHO新增了鞋钉型PTC[5,14,15],定义为超过30%的肿瘤细胞具有鞋钉细胞特点。该型仅占所有PTC的不到2%,为侵袭型[16,17]。组织学上表现为复杂的乳头或微乳头结构(图6),嗜酸性胞质的细胞围绕在乳头周边,核位于顶端而非基底部,核质比不高,细胞黏附性消失,沙砾体不常见[18],坏死、核分裂象、脉管侵犯及腺外侵犯、复发和远处转移常见[16,19]。免疫组织化学显示不同程度的甲状腺球蛋白(Tg)、CK7、CK19、HBME1阳性,甲状腺转录因子(TTF)1阳性,超过25%的细胞核p53阳性,Ki-67阳性指数平均10%。BRAF V600E突变最常见,其次是TP53突变[20,21,22]。(3)甲状腺微小乳头状癌(papillary microcarcinoma):新版中尽管提到曾有提议将之命名为"微小乳头状肿瘤(papillary microtumour)"[23],但仍沿用微小乳头状癌的概念,特指直径<1 cm的PTC。总体预后良好,无病生存率为93%。尸体解剖中的发现率约5.6%~35.6%。但也有报道称微小乳头状癌可表现为恶性生物学行为,尤其伴有BRAF基因突变者。(4)滤泡型(follicular variant):新版WHO将滤泡型PTC主要分为两个亚型:浸润型(非包裹性)和浸润性包裹型,其中浸润型最常见,与经典型PTC特征多有类似。将非包裹型滤泡型PTC归类为浸润型滤泡型PTC的原因为:①其中某些肿瘤在甲状腺内存在多发病灶、具有经典型PTC特点;②其生物学行为与经典型PTC接近,以颈部淋巴结转移率高最为明显;③淋巴结转移经常有乳头结构;④肿瘤细胞角蛋白的表达与乳头状癌而非滤泡腺癌相似。浸润性包裹型PTC包膜和脉管浸润的判定标准参见甲状腺滤泡腺癌(follicular thyroid carcinoma,FTC)判定标准[10]。另外尚有2种罕见亚型,一是旧版WHO中巨滤泡型PTC不再是独立的一型,而归类为滤泡性甲状腺乳头状癌的罕见亚型之一。另一种为弥漫或多结节型,在该型中,整个甲状腺被肿瘤弥漫浸润,不形成明显肉眼可见的结节,该型侵袭性强,预后较经典型PTC略差。(5)高细胞型(tall cell variant):旧版WHO将超过50%的肿瘤细胞高度3倍于宽度的PTC定义为高细胞型,新版中主要有两点更新,一是将高细胞特点肿瘤细胞的比例降为30%;二是肿瘤细胞高度定为2到3倍于宽度,将高细胞亚型标准放宽(图7)。肿瘤好发于中老年(平均50~57岁),体积较大(直径常>5cm),易腺外播散(42%)、局部复发(58%)、远处转移(17%)和较高病死率(25%)[24]。组织学上癌细胞单行排列,核位于基底,胞质丰富,常呈嗜酸性。即使没有腺外侵犯[25]、高细胞的比例不足30%,预后仍较经典型PTC差,故应该在诊断中注明其比例。该型BRAF和TERT基因突变比率均较高。(6)梭形细胞型(spindle cell variant):用于PTC伴有5%~95%梭形细胞化生者。这些梭形细胞本质上为上皮,可以表达CK和TTF1。梭形细胞与出血和含铁血黄素无关、非甲状腺细针穿刺部位的反应性改变。该型与间变性癌的鉴别诊断包括细胞温和、缺乏核分裂象和坏死。
对FTC进行重新分组。原甲状腺滤泡性肿瘤中的嗜酸细胞肿瘤,因具有独特的基因谱、临床治疗反应等而作为独立的分类。
新版WHO中将FTC分为3组:微小浸润型、包裹性血管浸润型和弥漫浸润型。有关包膜浸润,新版中明确指出,肿瘤细胞/滤泡浸润至邻近正常甲状腺组织时,常可见到少许反应性纤维带(图8),以避免漏诊。FTC血管浸润的范围和预后相关,同时,新版中强调,FTC很少侵犯淋巴管,淋巴结转移同样罕见。因此包裹性滤泡型肿瘤诊断中如查见淋巴管侵犯,应重新考虑滤泡型PTC、而非FTC的诊断。该结论提示,原本诊断为FTC伴淋巴管侵犯和/或淋巴结转移的病例,应为浸润性包裹性滤泡型PTC。<4个血管浸润的预后要好于广泛浸润者。弥漫浸润型FTC弥漫浸润至整个甲状腺和甲状腺外软组织。并强调单纯血管浸润并非"弥漫浸润",但广泛血管浸润者预后差。新版WHO保留了旧版FTC的透明细胞型,新增了印戒细胞型、黏液型、肾小球样生长方式的FTC、梭形细胞型、类似腺样囊性癌的FTC、腺脂肪瘤、梭形细胞型;并将旧版嗜酸细胞型FTC归入到嗜酸细胞肿瘤中。其中TERT基因突变者预后差。FTC放射性碘治疗有效。
甲状腺滤泡腺瘤的定义无明显修订,约30%伴有RAS基因突变,以NRAS外显子61最为常见。PTEN错构肿瘤综合征患者和Carney综合征患者易患滤泡腺瘤。新版WHO保留了伴乳头状增生的腺瘤、伴怪异核的腺瘤、透明细胞腺瘤、印戒细胞腺瘤;原毒性(高功能)腺瘤改为高功能(毒性、热)腺瘤、原脂肪腺瘤新增腺脂肪瘤的同名词。新增了其他滤泡腺瘤,包括:富于脂质的滤泡腺瘤、因服用四环素导致的黑色腺瘤,以梭形细胞为主的腺瘤等。去除胚胎性腺瘤。去除嗜酸细胞腺瘤并归入嗜酸细胞肿瘤分类中。
嗜酸细胞肿瘤指滤泡上皮细胞起源的包裹性肿瘤,包括嗜酸细胞腺瘤和嗜酸细胞癌,两者均要求嗜酸细胞占75%以上。包膜和脉管浸润的判定标准与滤泡性肿瘤一致。嗜酸细胞肿瘤中可伴有钙化,通常位于滤泡腔内,非同心圆层状,更多见于嗜酸细胞腺瘤。
嗜酸细胞癌与FTC不同,除血道转移外,可转移至颈部淋巴结。有时颈部血道转移可呈多结节状。实性/梁状生长模式、滤泡结构少见、灶性小细胞,提示恶性可能。直径>4 cm的肿瘤,出现灶性肿瘤性坏死、核分裂象增加、灶性小细胞,被认为是低分化嗜酸细胞癌,此时肿瘤往往不表达Tg和TTF1。
嗜酸细胞肿瘤线粒体性DNA突变较FTC多见,其基因图谱不同于其他类型甲状腺癌,RAS基因突变和PAX8/PPARG基因重排发生率低。部分遗传综合征,如Cowden综合征患者嗜酸细胞肿瘤患病风险增加。嗜酸细胞癌对抗放射性碘治疗。
新版WHO低分化癌的诊断标准依据2007年都灵共识[26],包括:(1)滤泡上皮细胞起源的癌。(2)实性、梁状、岛屿状生长模式。(3)缺乏PTC细胞核特点。(4)具有以下3条中至少1条:扭曲核(即PTC细胞核去分化)、10个高倍镜视野≥3个核分裂象、肿瘤性坏死。该标准同样适合低分化嗜酸细胞癌的诊断。新版强调侵袭性PTC和FTC如具有典型分化特征(PTC细胞核特点、乳头或者滤泡),不应诊断为低分化癌。低分化癌的分子生物学改变包括RAS、BRAF、ALK、TP53、TERT等。5年生存率约60%~70%。放射性碘治疗反应差。
以上是新版WHO组织学分类中甲状腺肿瘤分类的主要变化,最重要的是提出了甲状腺交界性肿瘤的概念,并进一步明确了分化型甲状腺癌中的一些侵袭型和非侵袭型,对甲状腺肿瘤的基因图谱更为明确。肿瘤诊断标准的更新,对病理医师提出了更高的要求,我们应该及时了解新的分类及其临床意义,立足临床、并不断发现新问题、善于总结,以更好的服务于临床实践。


























