
肺原发性腺样囊性癌是一类与唾液腺相应名称肿瘤组织学形态一致的恶性上皮性肿瘤,主要发生于气管及主支气管。肿瘤组织主要有3种类型:筛状型、管状型和实体型。具有基底细胞样特征的实体型腺样囊性癌是其中一种罕见亚型,肿瘤细胞形成大小不一的实性结构,与经典型相比,实体型更具侵袭性,易发生转移,预后差。该文报道1例31岁男性患者发生于气管的实体型腺样囊性癌,分析其临床病理学特征、免疫表型特点及鉴别诊断,旨在提高对该病的认识,提高临床诊治水平。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,31岁。半个月前无明显诱因下出现咳嗽咳痰伴有乏力,5 d前出现咽喉部不适并咳出少量暗红色血液,遂就诊于上海市第一人民医院。胸部CT显示主动脉窗水平纵隔内多发淋巴结肿大,部分融合,气管及食管受压,双肺多结节影。PET-CT显示气管下段结节,气管下段及左主支气管壁多发浸润,纵隔多发淋巴结肿大,全身多发骨病灶,考虑气管癌伴多发转移可能。纤维支气管镜检查于总气管下段膜部、左侧壁及前壁见新生物,范围自隆突上方3 cm处开始一直延及左主支气管上端。
病理检查:纤维支气管镜活检组织,肿瘤组织表面被覆正常的支气管黏膜上皮,肿瘤主要由大小不一的实性细胞巢组成,细胞巢分布在黏膜下,呈浸润性生长。实性区域超过90%,表现为地图状、岛状或花环状,也可见局部呈筛状或小梁状结构。肿瘤间质呈纤维黏液样或玻璃样变。肿瘤细胞具有基底细胞样特征,细胞丰富且较一致,小至中等大小,周边细胞呈栅栏状排列。细胞胞质较少,核质比较大,核染色质均一,呈圆形或卵圆形,核仁不明显;细胞呈中至重度异型性,核分裂象并不多见。实性细胞巢中可见灶性的导管腺上皮分化,小腺腔形成,偶可见筛孔状或大小不一的腔隙(假性腺腔),腔隙内可见粉染的基底膜样物。肿瘤细胞巢中可观察到小灶性的坏死(图1,图2,图3,图4)。免疫表型:肿瘤细胞弥漫表达广谱细胞角蛋白(CKpan),CK7(图5)和CK5/6在导管腺上皮分化处呈阳性,CD117(图6)和CD99染色阳性,Ki-67阳性指数20%~30%,肌上皮标志物p63少量阳性,大部分肿瘤细胞不表达p63(图7)。其他免疫标志物p40、Calponin、甲状腺转录因子(TTF1)、Napsin A、白细胞共同抗原(LCA)、Fli-1、S-100蛋白、突触素、嗜铬粒素A(CgA)、CD56等均阴性。
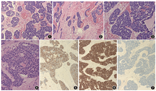

病理诊断:具有基底细胞特征的气管实体型腺样囊性癌。
治疗及随访:患者接受化疗,随访半年,一般情况良好,无肿瘤复发和转移。
腺样囊性癌好发于涎腺组织,占涎腺恶性肿瘤的10%[1],也可发生于乳腺、肺、支气管、消化道、皮肤、泪腺、外耳道、前列腺及女性生殖道等器官[2,3]。气管原发性恶性肿瘤较为少见,约占下呼吸道肿瘤的0.2%,其中以鳞状细胞癌最常见,约占气管肿瘤的60%~90%,腺样囊性癌位居第二,约占气管肿瘤的10%~20%[4]。气管腺样囊性癌是原发于气管、支气管的低度恶性肿瘤,最常见于主支气管下1/3段,可发生于任何年龄,通常较肺癌发病年轻,高发于40~50岁,男女之比1.0∶1.1。临床症状以咳嗽、嗝鸣、血痰及呼吸困难为主[5]。早期可不出现呼吸道阻塞症状,仅偶有胸闷、刺激性咳嗽、咳痰或痰中带血丝,症状不明显。对于原发性气管肿瘤,虽然纤维支气管镜检出率较低,但对早期隐匿性病变及术前获得病理结果有独到之处。支气管镜可以观察到肿瘤的形态、大小及管腔受侵情况,并可以活检,明确诊断,因此意义最大。本例患者为年轻男性,因不明原因出现咳嗽、咳痰伴咯血入院。纤维支气管镜显示在总气管下段膜部、左侧壁及前壁见新生物,范围自隆突上方3 cm开始一直延及左主支气管上端。该患者的临床特征及纤维支气管镜所见与文献报道非常符合。
原发于气管的腺样囊性癌是一类与涎腺相应肿瘤组织学一致的恶性上皮性肿瘤,肿瘤细胞显示导管和肌上皮的分化特征。经典型腺样囊性癌呈筛状、小管和腺样排列,周围有不定量的黏液性基质和丰富透明变性的基底膜样物质围绕,其中筛状型最常见。实体型腺样囊性癌少见,肿瘤由大小不一的实性结构组成,肿瘤细胞形态与筛状型和管状型相似,但细胞更丰富,且异型性更大,核分裂象更多见。实体型中易见到坏死。本例肿瘤组织缺乏微囊和管状结构,实性细胞巢区域超过90%,肿瘤细胞具有基底细胞样特征,表现为细胞较一致,胞质稀少,胞界不清,细胞核圆形或卵圆形,核染色质均匀,核仁不明显,部分癌巢周边细胞呈栅栏状排列,基底细胞样的肿瘤细胞显示中到重度异型性。实体巢中可见到灶状肿瘤性坏死。此外,实体型腺样囊性癌局部区域实性巢中总是可见到不明显到腺腔样或筛状结构,这是诊断具有基底细胞样特征的实体型腺样囊性癌很关键的诊断线索[6,7],局部筛状结构往往能提示其腺样囊性癌的本质。与经典型腺样囊性癌相比,实体型腺样囊性癌侵袭性强,易发生远处转移,预后更差[8]。
本例肿瘤细胞弥漫表达CKpan,CK7和CK5/6显示局部阳性,但肌上皮标志物仅呈局灶少量阳性,大部分肿瘤细胞不表达p63,其他肌上皮标志物如Calponin、S-100蛋白、平滑肌肌动蛋白(SMA)等也缺乏表达。有研究认为[7],腺样囊性癌中的基底样细胞可能是低分化或未分化的原始肿瘤细胞,具有分化成腺样、鳞状、肌上皮细胞等多向分化潜能。基底细胞样特征显著的实体型腺样囊性癌中,大片的基底样细胞中可散在分布不明显的腺样或筛状结构,提示这种组织学类型可能是未分化或分化程度较低的一种腺样囊性癌。因此,缺乏肌上皮标志物的表达并不能排除实体型腺样囊性癌的诊断。
CD117在92%的涎腺腺样囊性癌组织中有表达[9],同时也是涎腺腺样囊性癌与其他头颈部恶性肿瘤鉴别诊断的依据[1]。Crisi等[10]研究显示在常见的筛状型或管状型腺样囊性癌中,CD117主要表达在细胞巢的内层细胞,而具有基底细胞样特征的腺样囊性癌CD117在癌细胞巢全层均可观察到。本例肿瘤细胞CD117染色呈胞质、胞膜阳性,而且CD117在肿瘤细胞巢中全层弥漫表达,因此本例CD117的表达特点与文献报道结果相同。
2009年Persson等[11]证实腺样囊性癌中存在t(6;9)(q22;p23-24)易位,并导致MYB-NFIB融合基因出现,这是腺样囊性癌研究中的重大发现。MYB-NFIB基因融合在腺样囊性癌的发生率为49%~57%(均值54%),具有高度特异性[11,12],其检测可作为腺样囊性癌与其他肿瘤鉴别诊断比较可靠、准确的方法。本例MYB基因分离探针荧光原位杂交检测结果显示,>30%的肿瘤细胞内可见红绿分离信号,提示存在MYB基因的易位,进一步支持实体型腺样囊性癌的诊断(原位杂交为外院会诊结果,文中未显示)。
鉴别诊断:(1)低分化鳞癌:与实性型腺样囊性癌在形态学上有较多相似之处,但是往往在浸润灶附近可见到鳞状细胞原位癌成分,免疫表型CK5/6和p63弥漫强阳性,CD117阴性。(2)小细胞癌:肺小细胞癌由小到中等大小的细胞组成,排列成未分化的片状、条索状和巢状。细胞核质比例高,核浓染,核仁不明显或偶见嗜碱性核仁,病理性核分裂象常见,坏死、出血和挤压的人工假象是其突出的特点,一般无腺样囊性癌中典型的筛状结构。免疫组织化学绝大部分CK阳性,多为核周点状阳性,90%以上病例TTF1阳性,有不同程度bcl-2和CD117阳性,Ki-67阳性率通常>50%,神经内分泌标志物神经元特异性烯醇化酶、CD56、突触素、CgA阳性。(3)基底细胞样鳞状细胞癌:这是一种预后更差的高级别侵袭性肿瘤,肿瘤细胞排列紧密,呈团块状或巢团状,周边基底样细胞栅栏状排列,部分肿瘤巢中可出现腺样分化和灶状坏死。免疫组织化学基底细胞样鳞癌90%~100%的肿瘤细胞p63和CK5/6弥漫阳性,CD117往往阴性;而腺样囊性癌肿瘤细胞巢中肌上皮细胞p63阳性,腺上皮p63阴性而表达CK7,且CD117在腺样囊性癌中恒定阳性,显示二者在免疫表型上具有很大的不同。(4)Ewing肉瘤/外周原始神经外胚叶肿瘤(ES/PNET):肿瘤组织起源于幼稚的原始细胞,镜下肿瘤由一致的小至中等大小的圆形细胞组成,弥漫分布,或呈分叶状,或形成腺泡状结构,可出现真性或假性菊形团。免疫组织化学CD99、波形蛋白、Fli-1阳性,不同程度表达CD57、突触素、CgA、S-100蛋白等。90%~95%病例存在t(11;22)(q24;q12),产生EWS-Fli-1融合基因。(5)黏膜无色素性恶性黑色素瘤:肿瘤组织结构及瘤细胞形态变异大,可见上皮样细胞、梭形细胞、透明细胞、浆细胞样细胞等,胞质黑色素不明显,核大圆形、核质比高,有嗜酸性核仁和核内包涵体,瘤细胞可呈实体、腺泡状、外皮瘤样及肉瘤样排列,免疫组织化学瘤细胞表达S-100蛋白、HMB45、Melan A等黑色素标志物,CD117、CD99、CD56等也有不同程度的阳性。此外,气管腺样囊性癌还需与气管发生的其他肿瘤鉴别,特别是涎腺源性肿瘤如基底细胞腺癌、上皮-肌上皮癌、黏液表皮样癌等。
气管腺样囊性癌由于其生长特性,容易后期发生局部复发和远处转移,目前有效的治疗以手术切除及术后放疗为主。无禁忌证的情况下,手术可作为首选[13],手术切除患者5年和10年生存率分别为52%~91%和29%~76%[4,5]。对于不能手术者可选择放疗[4],可实现长期带瘤生存。多数研究表明其对化疗不敏感。目前有研究显示内镜下介入治疗可明显改善通气,提高生活质量,为姑息性治疗提供了新的治疗途径。总之,气管腺样囊性癌是罕见的原发于气管的低度恶性肿瘤,本例原发于气管的实体型腺样囊性癌较经典型更少见,更具侵袭性,预后更差。对支气管镜活检或手术病例出现分化较差、基底样细胞为主的实性结构时,要增加腺样囊性癌的考虑。
所有作者均声明不存在利益冲突



























