
去分化脂肪肉瘤是脂肪肉瘤的一种独特亚型,形态上表现为从具有脂源性的不典型脂肪瘤样瘤或高分化脂肪肉瘤,向高级别肉瘤移行。肿瘤中去分化组分的比例因不同病例而异,少数病例可出现异源性分化,包括骨或软骨肉瘤样、肌源性等,以及同源性脂母细胞分化,形态类似于多形性脂肪肉瘤。该文报道2例少见类型的去分化脂肪肉瘤,1例发生于大腿软组织伴有异源性肌源分化,另1例发生于肾脏伴有同源性脂母细胞分化。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
例1男,54岁。右腹股沟无痛性包块20余天,2011年12月30日入院。体检:右腹股沟区略肿胀,触及一大小约7 cm×4 cm×2 cm包块,质韧,表面光滑,不活动。B超示:右腹股沟区可见一6.4 cm×5.1 cm×3.3 cm的低回声区,边界清楚,形态尚规则。手术所见:包块位于右髂腰肌内,深达右髋关节上缘,剥离包块并切除部分髂腰肌。
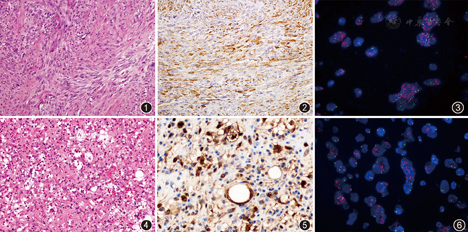
病理检查:大体观察:灰红不整组织一块,大小11.5 cm×10.0 cm×4.0 cm,切面可见一灰白、质韧肿物,体积6.0 cm×5.5 cm×4.0 cm,与周围界尚清。术中冷冻病理,梭形细胞恶性肿瘤。组织学检查:肿瘤主要由梭形细胞构成,呈纤维肉瘤形态,部分区域有多形性,但缺乏脂肪成分(图1)。免疫组织化学:肿瘤细胞呈平滑肌肌动蛋白(SMA,图2),calponin、cyclin D1、p53和波形蛋白阳性,而其他标志物如CD10、结蛋白、h-caldesmon、MDM2、CDK4、Myo D1、Myogenein及S-100蛋白等均阴性;H3K27me3弥漫核阳性,没有缺失;Ki-67阳性指数为30%。电镜观察:肿瘤细胞呈梭形,核圆形,核空而核膜薄,胞质含有较丰富的粗面内质网,细小的肌丝分布,有时可见脂肪空泡,细胞周围由胶原纤维包绕。FISH检测:检测到MDM2基因扩增(图3)。

病理诊断:去分化脂肪肉瘤伴有异源性肌纤维母细胞分化。
随访:术后随访38个月,转移至肺,死亡。
例2男,35岁。体检发现右肾占位20余天,2018年7月10日入院。体检:右侧肾区叩击痛。CT示:腹膜后右肾周筋膜内可见类圆形混杂密度肿块影,大小约7.4 cm×6.3 cm×7.7 cm,轮廓不规整,呈明显不均匀强化,于右肾中下极可见杯口状压迹。手术所见:右肾中部腹侧外突出肾脏的部分直径约2 cm,无破溃,沿肿瘤边缘切除肿瘤组织,保留肾脏。
病理检查:大体检查:灰红碎组织一堆,大小13 cm×12 cm×5 cm,切面灰红、灰黄、质中。镜下观察:肿瘤由梭形、圆形细胞构成,散在少数成熟的脂肪细胞以及多形脂母细胞,炎性背景明显,有较多的淋巴细胞和浆细胞浸润,类似"炎性恶性纤维组织细胞瘤(IMHF)",偶见淋巴滤泡形成,局部形成硬化灶。脂母细胞胞质多空泡状,细胞内或外可见嗜酸性玻璃样球状小体;胞核深染、畸形,边缘常见压迹,核分裂象可见(图4)。肿瘤坏死不明显,未见高分化脂肪肉瘤区域。免疫组织化学染色:瘤细胞呈S-100蛋白(图5)、MDM2、CDK4、p16和波形蛋白阳性;广谱细胞角蛋白(CKpan,AE1/AE3)、间变性淋巴瘤激酶(ALK)1、cyclin D1、上皮细胞膜抗原(EMA)、SMA、结蛋白、calponin、h-caldesmon、HMB45和Melan A阴性;Ki-67阳性指数约10%。FISH检测:检测到MDM2基因扩增(图6)。
病理诊断:去分化脂肪肉瘤伴有同源性脂母细胞分化。
随访:局部切除,术后化疗至2018年10月存活。
去分化脂肪肉瘤(dedifferentiated liposarcomas,DDLPS)是脂肪肉瘤的一种独特亚型,形态上表现为从具有脂源性的不典型脂肪瘤样瘤(atypical lipomatous tumor,ALT)或高分化脂肪肉瘤(well-differentiated liposarcoma,WDL)向高级别肉瘤移行[1]。肿瘤中去分化组分的比例因不同病例而异,少数病例可出现异源性分化,包括骨或软骨肉瘤样、肌源性等[1],以及同源性脂母细胞分化,形态类似于多形性脂肪肉瘤[2,3]。DDLPS多发生在腹膜后、腹股沟区、躯干、深部软组织等,以往许多发生于腹膜后的恶性纤维组织细胞瘤(MHF)被归类于该肿瘤[4]。肿瘤的去分化程度因病例不同而异,在多数肿瘤中,ALT/WDL成分明显,但在极个别的病例中,缺乏ALT/WDL,主要为未分化肉瘤成分。DDLPS属于异质性肿瘤,其异质性主要来自其未分化组分,可出现同源性[5]或异源性分化[1,2],其中在大约有5%的DDLPS病例显示异源肌纤维母、平滑肌或横纹肌分化,SMA或结蛋白阳性,该异源性分化不存在于其他类型的脂肪肉瘤中[6,7,8,9],给肿瘤的诊断带来挑战。即便如此,DDLPS的免疫组织化学特点为几乎不变的弥漫性MDM2和/或CDK4核阳性,伴有MDM2扩增[1,10]。因此,应用免疫组织化学检测MDM2/CDK4,以及FISH检测MDM2基因扩增,再结合形态特征可用来区分DDLPS与其他高级别肉瘤[10,11]。
本组例1发生于成年人的大腿深部软组织,由梭形细胞构成,形态类似于纤维或平滑肌肉瘤,免疫组织化学多数细胞SMA阳性,但结蛋白、h-caldesmon、Myogenin、MyoD1、MDM2、CDK4阴性,显示肌源性分化。FISH检测到MDM2基因扩增。例2发生于右肾区,影像学和手术提示来自肾周脂肪囊的可能性较大,该肿瘤由梭形、圆形或多形性细胞构成,伴有明显的炎性反应,形态上类似所谓的"IMHF",有少数散在的脂肪细胞和多形性多空泡状脂母细胞,但缺少明显ALT/WDL成分。免疫组织化学染色,S-100蛋白、p16、MDM2和CDK4阳性,伴有MDM2基因扩增。该例有别于其他类型脂肪肉瘤,应诊断为DDLPS伴同源性脂母细胞分化[2,3]。典型的DDLPS,在组织形态上,通常含有ALT/WDL成分。本文2例的共同特点是缺少明显的ALT/WDL成分,可能与未充分取材有关。尽管如此,有学者对发生于腹膜后/大腿的未分化高级别多形性肉瘤(UHGPS)病例研究发现,约26%病例显示特征性CDK4和MDM2基因扩增,表明尽管缺乏脂母细胞的组织学证据,一部分UHGPS病例可能为DDLPS,在极少数病例中,即便缺乏ALT/WDL成分,有MDM2的扩增,但MDM2、CDK4免疫组织化学阴性,也可以诊断DDLSP[12]。
DDLPS的鉴别诊断包括具有肌源性分化的肿瘤,包括平滑肌肉瘤、横纹肌肉瘤、肌纤维母细胞肉瘤、恶性外周神经鞘瘤(MPNST)以及多形性脂肪肉瘤(pleomorphic liposarcoma,PLPS)等。例1具有肌源性分化,通过横纹肌特异性标志物Myogenin和MyoD1阴性,以及电镜下未观察到Z带,可排除横纹肌肉瘤。该例结蛋白、h-caldesmon阴性,结合其超微结构,可除外平滑肌肉瘤。肌纤维母细胞肉瘤常呈SMA和/或结蛋白阳性,通常为膜下斑片状或线状阳性,其他标志物阴性;电镜可观察到肌膜下束状肌丝,致密体和致密斑。但该例明显缺乏这些特性。MPNST可有肌源性分化,S-100蛋白为灶性阳性,常见H3K27me3表达丢失。因此例1不符合MPNST。例2具有PLPS的某些组织学特点,需鉴别。细胞内或外嗜酸性玻璃样小球是部分PLPS的特征;免疫组织化学染色,约半数病例S-100蛋白阳性,MDM2和CDK4阴性,无MDM2基因扩增。此外,除WDLPS和DDLPS外,MDM2基因的扩增也出现于皮质旁骨肉瘤、低级别中央型骨肉瘤、极少数横纹肌肉瘤和恶性外周神经鞘膜瘤等肿瘤中。然而,这些肿瘤也均不含有ALT/WDL成分。另外,通过肿瘤的临床表现、影像学检查、组织学形态、特异性的免疫标志物,很容易将这些肿瘤与DDLPS区分开。因此,有学者建议,MDM2基因扩增的检测,应成为骨与软组织肿瘤诊断中常规检测手段[11]。
DDLPS是较为常见类型的脂肪肉瘤,多发生于腹膜后、腹股沟区和大腿深部软组织。当伴有同源或异源性分化,而缺少ALT/WDL时,其诊断尤为困难。因不同类型的肿瘤,其治疗方法和预后不同,具有肌源性分化的肉瘤,与同级别的其他肉瘤相比预后更差,需更精确诊断。因此,对于发生于后腹膜区的任何多形性高级别肉瘤,应当充分取材寻找ALT/WDL成分;另外,应该仔细地组织学观察并联合免疫组织化学染色和分子遗传学检查,排除去分化脂肪肉瘤的可能。
所有作者均声明不存在利益冲突



























