
伴有极向反转的乳头状肾肿瘤是新命名且罕见的肾脏肿瘤,目前的研究证明其可能是一种良性或惰性的乳头状肾肿瘤。该患者男性,54岁,体检CT发现右肾下极囊实性占位,无特殊临床症状。镜下肿瘤界限清楚,见纤维性包膜,由具有纤维血管轴心的乳头状或管状乳头状结构组成,细胞温和,形态一致,胞质嗜酸性,细胞核特征性的位于胞质顶部。瘤细胞表达GATA3、广谱细胞角蛋白(CKpan)、细胞角蛋白(CK)7、MUC1、CD10、P504s、PAX8及E-Cadherin,且波形蛋白、肾细胞癌标志物(RCC)、CD117及CK20阴性,Ki-67阳性指数约2%,符合伴有极向反转的乳头状肾肿瘤诊断。其不同于乳头状肾细胞癌Ⅰ型和Ⅱ型,且由于良好的预后需要单独分类。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,54岁。2019年8月因脑出血就诊于中国科学技术大学附属第一医院(安徽省立医院总院),体检发现右肾下极囊实性占位,无肉眼血尿及肾脏叩击痛。CT平扫+增强示右肾下极直径约2.6 cm类圆形结节,境界清楚,向被膜下突出,可见假包膜征(图1)。超声示右肾下极偏外侧见大小约2.3 cm×2.3 cm×2.4 cm的类圆形高回声区,边界清楚规则,超声造影可见"假包膜征",肿瘤内可见血流信号(图2)。影像学诊断意见:右肾下极占位,考虑乳头状肾细胞癌可能性大。
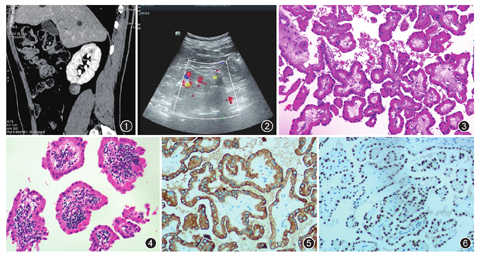

病理检查:大体观察见部分肾脏组织,大小约3.5 cm×3.0 cm×2.0 cm,于一极见一直径约2.5 cm肿物,切面囊实性,囊内充满灰红色乳头状物,质地软,境界清楚。镜下观察:肿瘤界限清楚,见纤维性包膜,由具有纤维血管轴心的乳头状或管状乳头状结构组成(图3),表面覆盖单层立方形或柱状细胞,胞质颗粒状、嗜酸性,细胞核小,位于远离基底膜的胞质顶部,核仁不明显,乳头或管腔边界光滑,乳头间质见淋巴细胞呈片状浸润(图4)。免疫组织化学结果:瘤细胞表达GATA3(图5)、广谱细胞角蛋白(CKpan,图6)、细胞角蛋白(CK)7、MUC1、CD10、P504s、PAX8及E-Cadherin,且波形蛋白、肾细胞癌标志物(RCC)、CD117及CK20阴性,Ki-67阳性指数约2%。
病理诊断:(右)肾伴有极向反转的乳头状肾肿瘤,WHO/国际泌尿病理学会(ISUP)Ⅰ级。美国癌症联合委员会(AJCC)pTNM分期(2017年第8版):pT1a。
随访6个月,肿块及周围部分肾切除术后无复发及转移。
伴有极向反转的乳头状肾肿瘤(papillary renal neoplasm with reverse polarity)是肾脏一种罕见的倾向为良性或惰性的肿瘤。2003年,Allory等[1]发现部分乳头状肾细胞癌预后较好,并将其称为"嗜酸细胞样型乳头状肾细胞癌(oncocytoid-type papillary renal cell carcinoma)"。2005年,Lefèvre等[2]将其命名为"嗜酸细胞性乳头状肾细胞癌(oncocytic papillary renal cell carcinoma)",且这一术语被广泛使用。2017年,Saleeb等[3]基于免疫组织化学表型及分子表型将乳头状肾细胞癌分为4型,并提出"低级别嗜酸细胞性乳头状肾细胞癌,4型"这一术语。2019年,Al-Obaidy等[4]首次提出伴有极向反转的乳头状肾肿瘤这一诊断名称,并从病理形态学、免疫表型及染色体特征证明其不同于乳头状肾细胞癌Ⅰ型和Ⅱ型。荧光原位杂交(FISH)分析显示33%病例见第7号染色体三体,33%病例见第17号染色体三体,20%病例见第7/17号染色体三体(n=15),男性患者中14%病例存在染色体Y缺失(n=7)。在后续的研究中发现10例伴有极向反转的乳头状肾肿瘤有8例存在KRAS错义突变[5]。这些突变聚集在外显子2-密码子12:c.35 G>T(n=6)或c.34 G>C(n=2)中,分别导致p.Gly12Val和p.Gly12Arg改变。而在30例乳头状肾细胞癌中均未发现KRAS突变,所以此项研究支持了该肿瘤不同于乳头状肾细胞癌。迄今为止,检索文献已报道"嗜酸细胞"或"嗜酸细胞样"乳头状肾细胞癌84例,伴有极向反转的乳头状肾肿瘤18例。从明确诊断为伴有极向反转的乳头状肾肿瘤的病例中发现该肿瘤男女均可发生,中位年龄为66岁,以右肾多见。目前已报道的18例肿瘤大小均≤3 cm(中位数1.4 cm,平均大小1.6 cm)。多数无特殊临床表现,部分患者伴发获得性囊性肾病相关肾细胞癌及终末期肾病。
本例肿瘤具有纤维性包膜,由具有纤维血管轴心的乳头状或管状乳头状结构组成,表面覆盖单层立方或柱状细胞,细胞异型性小,胞质颗粒状、嗜酸性,核仁不明显,乳头或管腔边界光滑,乳头间质可见淋巴细胞呈片状浸润。无沙砾体、坏死、病理性核分裂象和细胞内含铁血黄素沉积。其最大的病理形态学特点是细胞核位于远离基底膜的胞质顶部。尚不清楚是否是由于在M期或之前的细胞周期中细胞核移位发生停滞,或者是细胞骨架和核骨架之间平衡力相互作用导致的特定分布。还发现本例CD10特征性的表达于乳头表面细胞膜,该例P504s虽为阳性,据其他研究P504s的表达不定,此外其还表达L1CAM。
鉴别诊断:(1)乳头状肾细胞癌以乳头状结构为主时需要与伴有极向反转的乳头状肾脏肿瘤进行鉴别,前者乳头状结构的纤维血管轴心可见丰富的泡沫细胞,细胞内含铁血黄素沉积,而后者水肿的纤维血管轴心内的泡沫细胞常为散在分布,且无含铁血黄素沉积,此外肿瘤细胞核具有远离基底膜重要特征。乳头状肾细胞癌Ⅰ型由单层细胞覆盖的纤细乳头组成,细胞质少、淡染,细胞核排列呈单层,一般位于乳头轴心基底膜,而Ⅱ型肿瘤则由广泛的假复层细胞覆盖的乳头,细胞质嗜酸,细胞核随机分布,核异型性大。两者免疫组织化学表型存在一定重叠,但后者弥漫表达GATA3和L1CAM,且波形蛋白表达缺失,与乳头状肾细胞癌表达相反;两者均可表达P504s,后者染色强度远低于前者;伴有极向反转的乳头状肾脏肿瘤及乳头状肾细胞癌Ⅰ型均表达上皮细胞膜抗原(EMA),且MUC1及CK7常常阳性,Ⅱ型多数不表达,所以EMA联合MUC1及CK7可用于排除乳头状肾细胞癌Ⅱ型。且多数伴有极向反转的乳头状肾脏肿瘤存在KRAS基因突变,而乳头状肾细胞癌相反。(2)透明细胞乳头状肾细胞癌细胞核呈线状排列,远离基底膜,或位于细胞中央或顶部,且该肿瘤体积小,多为囊实性,见多灶及双侧病例。但该肿瘤胞质透明,典型免疫表型是CK7弥漫强阳性,大多数CD10阴性,碳酸酐酶9(CA9)特征性的"杯状"着色模式[6]。而伴有极向反转的乳头状肾肿瘤胞质嗜酸,颗粒状,CD10往往阳性。(3)嗜酸细胞腺瘤是边界清楚的无包膜肿瘤,33%的病例可见中央星状瘢痕。其形态结构多样,可见巢状、腺泡状、管状或微囊结构,27%的病例可见灶状小乳头或管内上皮簇,但是单纯或广泛乳头状结构少见,伴有极向反转的乳头状肾肿瘤多见纤维性包膜,主要由乳头状或管状乳头状结构组成。此外嗜酸细胞腺瘤常常CD117膜阳性,CK7阴性,而伴有极向反转的乳头状肾肿瘤相反。
肾脏部分切除或根治性肾切除术是其主要的治疗方法,目前尚无转移或复发的报道。该肿瘤较为罕见,且认识不足,仍需长期、多量病例随访以进一步明确其生物学行为。
所有作者均声明不存在利益冲突



























