
探索使用病理石蜡样本检测新型冠状病毒的方法。
采用荧光定量PCR技术,使用新型冠状病毒核酸扩增试剂盒,检测临床确诊患者的肺组织病理石蜡样本1例,无病毒感染肺组织石蜡样本2例和正常人群咽拭子样本2例。建立检测体系,判读检测结果。
经过荧光定量PCR反应和信号采集,所有5例样本RNA内参HEX信号扩增曲线均有升起;临床确诊患者手术石蜡样本RNA FAM信号(N基因)扩增曲线升起(Ct值35.48),ROX信号(ORF1ab基因)曲线未升起。重复试验FAM信号扩增曲线升起(Ct值36.00),ROX信号曲线未升起。结合2次检测结果,该例患者病理石蜡样本新型冠状病毒阳性。同时作为对照的2例无感染病理石蜡组织样本和2例正常人群咽拭子样本病毒核酸检测均为阴性。
病理石蜡样本提取的总RNA可以满足新型冠状病毒检测的质量要求;根据新型冠状病毒检测指南建议设计和生产病毒核酸检测试剂盒可以满足病理石蜡样本检测的需要;使用所建荧光定量PCR检测体系,病理石蜡样本可以用于进行新型冠状病毒的核酸检测。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2019年12月初,武汉市各区陆续出现新型冠状病毒(2019-nCoV)感染肺炎(COVID-19)病例,该传染病迅速蔓延至湖北省及全国其他地区甚至海外多个国家[1,2]。新型冠状病毒肺炎于2020年1月20日被国务院批准为《中华人民共和国传染病防治法》规定的乙类传染病,并按照甲类传染病预防和控制[3]。疾病流行早期,以咽拭子、肺泡灌洗液、痰液或血液等样本进行PCR检测,发现阳性率仅为40%~60%,造成大量影像学怀疑2019-nCoV感染肺炎的患者无法得到及时诊断和救治,也因此进一步延缓了病毒传播途径的控制。这类患者能否采用其他方法进行诊断,帮助尽快确诊成为摆在医务工作者面前的巨大难题。鉴于肺组织是2019-nCoV感染性疾病中主要的靶器官之一,大多数患者肺部都会出现典型的渗出性、间质反应性病变,并表现相关病理学形态特征,那么能否使用病理石蜡样本,结合分子病理学技术,进行病毒核酸的检测,以辅助临床疑难患者的诊断和治疗呢?我们尝试采用分子病理学的荧光定量PCR检测方法,探讨使用病理石蜡样本检测2019-nCoV的可行性。
收集2020年1月于华中科技大学同济医学院附属同济医院病理科存档的手术切除、经病理诊断为肺癌的3例(A/B/C)患者石蜡包埋组织。其中患者A病理诊断为(右下)肺中分化鳞状细胞癌,27枚淋巴结均未见癌组织。术后第2天,患者发生高热,查血显示白细胞高,淋巴细胞降低,结合影像学检查,专家会诊为病毒性肺炎疑似病例,转感染科进行治疗。2 d后患者病情突然加重,经抢救无效死亡。患者B病理诊断为(右下)肺鳞状细胞癌(中分化);淋巴结2/29枚转移。手术后规范化治疗,血象、CT影像无异常,顺利出院。患者C病理诊断为(右上)肺浸润性腺癌;淋巴结21枚均未见肿瘤转移。患者术后无异常,经治疗出院。2例患者病理石蜡切片作为组织对照。另外,取2例(D例和E例)正常人群咽拭子样本作为方法学对照。
病毒/细胞RNA核酸提取试剂(货号8.0250301X036G)、甲醛固定石蜡包埋组织RNA提取试剂(货号8.0224101X036G)和2019-nCoV核酸检测试剂盒(货号8.0131901X024E)均为厦门艾德生物医药科技股份有限公司产品。Mx3000P型荧光定量PCR仪购自安捷伦公司。
对3例患者手术切除标本的存档所有HE染色切片进行常规病理诊断和复阅。选择具有明显炎性反应的蜡块(炎性病变区域占整个组织切片50%以上,切片面积1 cm2以上)进行2019-nCoV核酸检测。清洁切片机、刀座、切片刀、毛笔和镊子后,4 μm厚,连续切片10张,前8张放入标记好的1.5 mL离心管中待用;最后2张捞非黏附玻片,进行HE染色,用于形态学质量控制。
按照说明书准备石蜡样本RNA提取相关试剂。取含蜡卷的1.5 mL离心管;加入1 mL二甲苯和2 μL Tissue Tracer入离心管中,振荡混匀10 s,56 ℃加热脱蜡3 min;13 800 r/min离心2 min。弃上清,加入1 mL无水乙醇和2 μL Tissue Tracer,振荡混匀10 s,13 800 r/min离心2 min。弃上清,56 ℃金属浴加热5 min彻底晾干后。加入160 μL Buffer RTL和20 μL蛋白酶K溶液,振荡混匀后56 ℃消化30 min。将离心管转移至80 ℃孵育30 min。取出离心管待降到室温后,用掌式离心机离心5 s。按20 μL DNaseⅠ Magic Buffer与10 μL DNase Ⅰ(3 U/μL)的比例混成DNaseⅠ工作混合液,每人份加入30 μL工作混合液至离心管中,轻柔吹打混匀,37 ℃静置15 min;13 800 r/min离心3 min,吸取全部上清到新的1.5 mL离心管中。加入340 μL Buffer RTB和750 μL无水乙醇,振荡混匀后用掌式离心机离心。将650 μL液体转移至RNA吸附柱中,13 800 r/min离心30 s,倒掉收集管中的液体。将剩余液体转移至RNA吸附柱中,13 800 r/min离心30 s,倒掉收集管中的液体。加入600 μL Wash Buffer A至RNA吸附柱,13 800 r/min离心30 s,倒掉收集管中的液体。加入600 μL Wash Buffer B,至RNA吸附柱,13 800 r/min离心30 s,倒掉收集管中的液体。再次加入600 μL Wash Buffer B,至RNA吸附柱,13 800 r/min离心30 s,换用新的收集管,13 800 r/min离心5 min,丢弃收集管。将RNA吸附柱移到干净的离心管中,滴加80 μL Buffer RTE(靠近RNA吸附膜中心,勿碰到吸附膜),56 ℃闭盖静置2 min,13 800 r/min离心1 min。收集样本RNA;RNA提取完后马上检测,特殊情况需延迟时-20 ℃保存RNA,24 h以内上样检测。
按照病毒/细胞RNA提取试剂说明书配制提取试剂。吸取200 μL拭子样本至1.5 mL离心管中,加入600 μL Buffer RLB。向样本离心管中加入20 μL蛋白酶K Plus,涡旋混匀15 s,掌上离心机离心5 s,放至56 ℃金属浴消化10 min。80 ℃金属浴孵育10 min,取出离心管静置至室温。加入600 μL无水乙醇,颠倒混匀10次,掌上离心机离心5 s。后边提取步骤参见石蜡样本RNA提取的步骤。
使用紫外分光光度计测定RNA浓度,并记录;A260/A280比值介于1.8~2.1之间。
从试剂盒中取出nCoV反应液、nCoV混合酶和nCoV阳性对照。室温静置30 min,解冻后,振荡混匀,掌上离心机快速离心15 s,静置待用。分装:根据样本、阳性对照及阴性对照所需反应管总数(n+1),按每测试中分别含30 μL nCoV反应液和1 μL nCoV混合酶的比例混合,振荡混匀后快速离心15 s。以每管31 μL顺序分装到8联PCR反应管中。做好起始和顺序标记。加样:在相应8联PCR反应管中分别加入9 μL待检样本RNA、最后9 μL 2019-nCoV阴性对照和9 μL阳性对照,盖上8联PCR反应管盖,快速离心15 s。将8联PCR反应管放入即时荧光定量PCR仪。注意方向和顺序。
首先接通荧光定量PCR仪及控制电脑电源,打开控制软件。设定反应条件:第一阶段42 ℃,5 min;95 ℃,5 min,1个循环;第二阶段95 ℃25 s,55 ℃ 35 s,72 ℃ 20 s,45个循环;第三阶段40 ℃ 30 s,1个循环;信号收集,第二阶段55 ℃时收集FAM、HEX和ROX信号;注意不要选择校正荧光参照。核对检查程序,并保存。点击开始按钮,启动程序运行。运行完成后,保存结果。并将扩增完毕的8联管使用手套包裹两层,高压后按医用垃圾处理。
FAM信号显示2019-nCoV核壳蛋白(nuleoprotein,N)基因的保守区域;ROX信号显示2019-nCoV开放读码框1ab(openreadingframe,ORF1ab)的保守区域;HEX信号为内参。(1)阴性对照FAM、HEX和ROX信号全部未升起(NO Ct),或Ct值应均>45;若任意一种信号扩增Ct值≤45,则此次实验结果无效,建议重新检测;若阴性对照的HEX信号偶尔有扩增曲线升起,不影响对检测结果判读。(2)阳性对照的FAM、HEX和ROX信号应全有扩增曲线升起,且其Ct值一般<35。(3)按孔号顺序依次进行分析与判读;应同时选择样本反应孔、阴性对照孔和阳性对照孔,尽量采用系统默认的扩增曲线阈值线位置(特殊情况可进行微调),确定每个反应孔Ct值。(4)样本扩增结果判读:①若样本HEX信号Ct值≤40继续分析;若Ct值>40,说明存在抑制性物质、漏加或采样失败,需要重新进行检测。②样本FAM和ROX信号结果判读,如果样本2种信号Ct值均≤37,则判读为2019-nCoV阳性;如果样本2种信号Ct值均>40,则判读为2019-nCoV阴性;如果FAM和ROX信号发生分离,即仅单个信号Ct值<40,则重复一次,如果2次结果Ct值均<40,则判读为2019-nCoV阳性;否则为阴性。
呈间质性肺炎改变,肺泡间隔明显增宽,伴纤维结缔组织增生和轻度纤维化(图1),肺泡间隔内可见浆细胞及少许淋巴细胞浸润;肺泡腔内可见大量渗出及单核细胞(图2)。
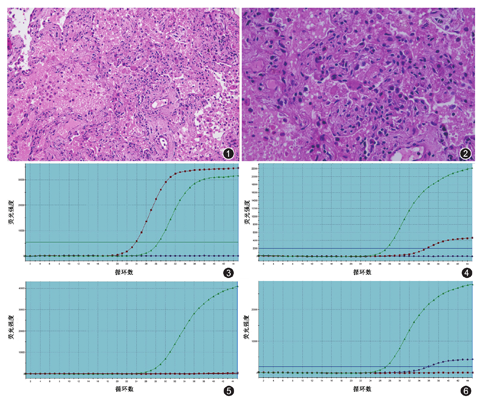

HEX信号通道(图3),阳性对照孔正常升起(Ct值28.33);阴性对照孔未升起(Ct值>40);患者A样本孔升起(Ct值23.83)。FAM信号通道(图4)阳性对照孔正常升起(Ct值28.11),阴性对照孔未升起(Ct值>40);患者A样本孔升起(Ct值35.48)。ROX信号通道(图5)阳性对照孔正常升起(Ct值29.54),阴性对照孔未升起(Ct值>40);患者A样本孔未升起(Ct值>40)。按照判读规则,该例样本需要进行重复:HEX信号通道,阳性对照孔正常升起(Ct值28.49);阴性对照孔未升起(Ct值>40);患者A样本孔升起(Ct值23.88)。FAM信号通道(图6)阳性对照孔正常升起(Ct值27.25),阴性对照孔未升起(Ct值>40);患者A样本孔升起(Ct值36.00)。ROX信号通道阳性对照孔正常升起(Ct值29.07),阴性对照孔未升起(Ct值>40);患者A样本孔未升起(Ct值>40)。结合2次2019-nCoV核酸扩增结果,患者A病理石蜡样本2019-nCoV阳性。
4个样本孔HEX信号均正常升起(Ct值<40)。FAM信号和ROX信号扩增曲线均未升起(Ct值>40),患者B、患者C和D例及E例的样本全部为2019-nCoV阴性。
新型冠状病毒肺炎暴发流行后,国家卫生健康委员会于1月28日,发布了新型冠状病毒肺炎防控方案(第3版)[4],同时作为附件发布了新型冠状病毒肺炎实验室检测技术指南(第3版)[5](以下简称"技术指南")。该技术指南推荐选用针对新型冠状病毒的ORF1ab、N基因区域的引物和探针。其中推荐靶标一(ORF1ab):正向引物(F):CCC TGTGGGTTTTACACTTAA,反向引物(R):ACGATTGTGC ATCAGCTGA,荧光探针(P):5′-FAM-CCGTCTGCGGTA TGTGGAA AGGTTATGG-BHQ1-3′。推荐靶标二(N):正向引物(F):GGGGAACTTCTCCTGCTAGAAT,反向引物(R):CAGACATTTTGCTCTCAAGCTG,荧光探针(P):5′-FAM- TTGCTG CTGCTTGACAGATT-TAMRA-3′。国内多个核酸检测试剂生产公司根据技术指南,迅速研发生产出自己的产品。在非常短的时间内解决了大量疑似患者难以确诊的问题;随着临床的大量应用,以咽拭子为代表的临床核酸检测逐渐暴露出一个问题,即新型冠状病毒肺炎疑似患者中核酸检测阳性率仅为40%~60%,导致仍有相当部分的患者具有明显的流行病学史和CT影像学证据却无法得到实验室检测结果的支持,因为无法得到准确诊断,而得不到有效的救治;延误病情的同时,传染源的隔离和传播途径的控制也面临巨大困难,因此在《新型冠状病毒肺炎诊疗方案(试行第5版)》[6]中湖北省患者增加了临床诊断类别。那么作为疾病诊断金标准的病理学诊断,能否在新型冠状病毒性疾病诊断过程中发挥作用,病理石蜡组织中RNA能否进行2019-nCoV核酸检测,现有2019-nCoV核酸检测试剂盒能否应用于石蜡样本RNA检测,分子病理在新型冠状病毒致病机制研究中能否发挥进一步的作用,都是值得探讨的问题。我们使用临床手术常规石蜡样本提取总RNA,使用依据技术指南推荐引物序列设计生产的检测试剂盒,进行2019-nCoV核酸的荧光定量PCR检测。结果显示这例符合临床诊断标准的新型冠状病毒肺炎致死病例的病理石蜡样本RNA,在2次2019-nCoV核酸检测中都存在N基因的阳性扩增,在内参信号可信的前提下,虽然ORF1ab基因无扩增曲线升起,按照说明书和检测指南,该病理石蜡样本核酸检测结果仍然判读为"2019-nCoV阳性"。该例患者检测结果也是临床检测咽拭子等新鲜样本2019-nCoV核酸检测结果常见的一种形式。从扩增曲线Ct值和峰形图可见病理石蜡样本提取的总RNA中病毒RNA核酸质量与含量均可满足检测质量要求。这可能是由于虽然病毒RNA经过固定、脱水、透明和包埋等技术操作,但仍然得到比较好的保存,其RNA链大多数片段长度在120 bp以上,满足了国家卫生健康委员会颁布检测指南推荐引物扩增区间长度的要求。而该病例FAM信号扩增曲线的两次有效升起也说明根据技术指南推荐引物序列设计的检测试剂盒进行石蜡样本的2019-nCoV核酸的荧光定量PCR检测是可行的。另外,同批次检测的2例正常咽拭子样本HEX信号正常,FAM和ROX信号无升起,也可说明本研究所用的检测系统有效、可信。同时,2例对照患者(肺鳞癌、肺腺癌各1例)的病理石蜡样本HEX信号均升起,FAM信号和ROX信号无升起,说明石蜡样本和新鲜咽拭子样本使用同样的2019-nCoV核酸检测系统,具有同样的特异性和有效性。综上所述,我们可以初步得出以下结论:(1)病理石蜡样本提取的总RNA可以满足2019-nCoV检测的质量要求,组织样本中2019-nCoV的RNA经过石蜡样本处理过程,仍然可以得到较好的保存,其核酸浓度和长度可以满足核酸检测的要求。(2)根据技术指南推荐引物序列设计的检测试剂盒初步证实可以满足病理石蜡样本RNA进行2019-nCoV检测的需要。(3)病理石蜡样本可以作为咽拭子、肺泡灌洗液、肛拭子、痰液和血液等新鲜样本的补充,进行2019-nCoV的核酸检测。尽管如此,由于本试验为新型冠状病毒防疫期间的紧急研究,样本例数较少,结论的可靠性和准确性仍然需要进一步大样本的验证。
病理石蜡样本中RNA质量可以满足2019-nCoV核酸检测的要求,为今后病理学工作者结合器官、组织、细胞形态特征和分子病理学结果,研究新型冠状病毒造成的肺炎及其他组织损伤机制奠定了基础,也为研究相关病变的发生、发展和转归创造了条件。
所有作者均声明不存在利益冲突



























