
报道1例伴有EWSR1断裂的上颌骨非透明细胞性牙源性癌。患者男,43岁。肿瘤组织学及形态学改变均具有硬化性牙源性癌的特征,但与目前所报道的硬化性牙源性癌的EWSR1基因重排结果有所不同。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,43岁。因发现左上颌骨腭部无痛性肿物3个月于2019年3月4日入院。口腔专科检查于左侧上颌硬腭部见一大小约1 cm×1 cm的椭圆形肿物,表面溃破,质硬,边界不清,活动度差,CT检查发现左侧上颌硬腭处可见条片状软组织密度影,边界不清,密度不均匀,增强后明显不均匀强化,局部骨质破坏(图1),考虑癌。
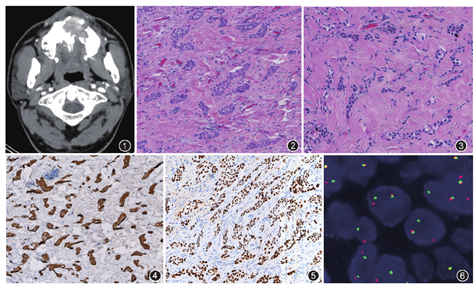

病理检查:上颌骨肿物,大小约1.5 cm×1.0 cm×0.3 cm,切面灰红灰黄质软。镜下观察:在硬化的纤维间质背景下,肿瘤细胞成小巢团、条索状、梁状分布(图2,图3),侵犯了周围横纹肌组织,并有小灶钙化。上皮性肿瘤细胞多呈圆形、卵圆形,轻度不规则/多形性,胞质嗜酸性,核大深染,缺乏明显异型性,染色质细腻,核仁及核分裂象不明显,另见有极少数较大的胞质透亮的细胞。首次病理诊断为上皮源性恶性肿瘤,免疫组织化学呈广谱细胞角蛋白阳性,细胞角蛋白(CK)19强阳性,CK5/6强阳性(图4),p63强阳性(图5),E-钙黏蛋白有膜染色,CK7阴性,Ki-67阳性指数3%。荧光原位杂交(FISH)检测结果:43%肿瘤细胞呈EWSR1基因断裂(图6),聚合酶链反应(PCR)及DNA测序:未发现BRAF V600E突变。
病理诊断:伴有EWSR1断裂非透明细胞性牙源性癌,倾向为硬化性牙源性癌。
随访:术后随访6个月余,未见复发及转移,现仍随访中。
此例镜下表现为在硬化的纤维间质背景下,肿瘤细胞成小巢团、条索状、梁状分布,侵犯了周围横纹肌组织,并有小灶钙化。上皮性肿瘤细胞多呈圆形、卵圆形,轻度不规则/多形性,胞质嗜酸性,核大深染,缺乏明显异型性,染色质细,核仁及核分裂象不明显,另见有极少数较大的胞质透亮的细胞。这些都是硬化性牙源性癌的特征性病理改变。此例与之前报道过的硬化性牙源性癌的EWSR1基因重排结果不同,故而慎重进行鉴别诊断和讨论。
硬化性牙源性癌是颌骨的原发性骨内癌,2008年Koutlas等[1]描述了3例牙源性肿瘤的临床病理特征,将其标记为"硬化性牙源性癌"。检索文献报道的病例不超过10例,男女比例相当,均为局部侵袭,未发生转移性,并且在组织病理学上以细胞形态相对温和的立方体、多边形的小中型细胞与显著的硬化间质及神经、肌肉侵犯为特征。硬化性牙源性癌的发病风险因素尚不清楚,其部位多在前磨牙区和磨牙区,下颌骨受到的影响更为频繁[2]。临床上大多无特异性症状。镜下最为明显的特征是单层薄条索状、巢团状细胞和上皮细胞束位于致密的硬化间质中。上皮细胞或间质可能在不同区域占主导地位。上皮细胞有时可能被压缩,仅在免疫组织化学上可见。细胞学上,上皮细胞比较温和,可见空泡,无鳞状细胞分化。需要注意的是,虽然形态学看起来温和类似良性,但实际上存在骨骼肌侵犯和周围神经浸润[3]。此病例均符合这些典型的组织学特征。在免疫组织化学中肿瘤细胞强烈表达CK7、CK5/6、CK19和p63,与牙源性起源的上皮细胞一致。在大多数细胞中观察到E-钙黏蛋白的膜免疫反应性。肿瘤细胞对波形蛋白、癌胚抗原、上皮膜抗原(EMA)、CK20、平滑肌肌动蛋白、S-100蛋白、CD1a、雌激素受体(ER)、calretinin、CD34和结蛋白均为阴性。Ki-67阳性指数约为2%~3%[4]。这与我们病例中的免疫组织化学结果十分一致。
然而,与现有的硬化性牙源性癌的病例报道相反的是,此例EWSR1分裂探针的FISH分析显示肿瘤细胞中存在EWSR1的基因断裂。在牙源性肿瘤中,EWSR1基因检测阳性常常出现在牙源性透明细胞癌(COCC)中。在一项研究中,83.3%的COCC具有EWSR1重排,并在这些重排病例中发现存在EWSR1-ATF1易位,迄今为止,发现特定透明细胞肿瘤易位阳性的包括:部分原发性透明细胞唾液腺、牙源性及鳞状肿瘤;阴性包括:透明细胞钙化上皮牙源性肿瘤、透明细胞鳞状细胞癌、上皮-肌上皮癌、鼻窦肾细胞样腺癌和透明细胞黏液表皮样癌[5]。而且COCC的组织形态学特征明显,可见EWSR1基因重排也并不能作为透明细胞癌的诊断标准,我们可以确定的是,虽然此例EWSR1基因重排呈阳性,但对我们的诊断并没有决定作用。10例硬化性牙源性癌中,其EWSR1基因重排虽然均为阴性,但由于病例极少,也未进行系统的归纳与整理,所以这仍是一个疑点,我们不知这是硬化性牙源性癌的新发现还是另一种还未分类的新类型的牙源性癌,这还需要更多的病例以及长期的研究和随访。
鉴别诊断:(1)COCC:一种以空泡透明细胞岛或团块为特点的恶性肿瘤。发生于50~70岁的中老年女性,好发于下颌骨前部,初期表现为颌骨肿胀或牙齿松动。镜下主要由片状、岛状、条索状排列的透明细胞及基底样细胞组成,透明细胞有核分裂象,过碘酸-雪夫染色阳性,细胞界限明显。间质为成熟的结缔组织,一般无腺样结构,无钙化沉积物及坏死,大多伴有EWSR1基因重排。形态学较为特异,通过镜下表现一般都可进行诊断。COCC具有局部浸润性生长、易复发、淋巴结转移及远处转移的生物学特点,确诊后一般采用手术切除治疗,扩大切除病灶并进行局部淋巴结清扫术,术后结合放化疗,预防复发或转移[6]。(2)牙源性纤维瘤:根据其发病部位可分为中心型(骨内型)和外周型(骨外型)。中心型的肿瘤界限清楚无包膜,镜下由细胞丰富的纤维性结缔组织构成,可见散在牙源性上皮岛;外周型的肿瘤界限不清,肿瘤纤维组织以胶原为主,可有丰富的细胞和黏液样变,还可见牙本质和牙骨质样钙化及多核巨细胞。需要注意的是,牙源性纤维瘤不会发生侵袭现象,这一点有助于跟其他牙源性肿瘤鉴别。(3)牙源性钙化上皮瘤(CEOT):肿瘤由多边形上皮细胞组成团片状,胞质红染,胞界清晰,可见细胞间桥,胞核明显多形性,特征表现为细胞内和细胞间有均质嗜伊红的淀粉样物质,呈同心圆状钙化。本例的上皮细胞可能与CEOT中的有些相似,但淀粉样蛋白物质并不存在。CEOT也不存在广泛的浸润和神经受累[7]。(4)促结缔组织增生性成釉细胞瘤:颌骨前部多见,镜下肿瘤内结缔组织显著增生,胶原丰富,可见玻璃样变,肿瘤性上皮岛或条索位于纤维束之间,这些与本例比较相似,但是成釉细胞瘤大多数上皮岛或条索周边细胞排列紧密呈柱状,中央细胞常呈旋涡状鳞状化生或星状类似成釉器样结构。
治疗和预后:此例可以看作是低度恶性肿瘤,并且上皮性牙源性肿瘤是具有高复发风险的渗透性浸润性病变,目前一致认为严密随访和完全切除是首选治疗方案。与其他恶性肿瘤一样,需持续5年的定期随访。目前报道病例极少,对硬化性牙源癌的自然病程及行为尚不确定,不过虽然还未发现有任何局部和远处病变的转移,但有证据表明切除范围距肿瘤边缘最好保留5 mm安全界限,由于迄今随访也未出现淋巴结转移,因此可能没有必要进行颈淋巴结清扫术[8]。
所有作者均声明不存在利益冲突



























