
观察新型冠状病毒感染疾病(COVID-19)死亡患者肺组织穿刺标本的病理变化,检测肺组织内是否存在新型冠状病毒(2019-nCoV),结合临床表现进行分析。
对武汉地区10例COVID-19死亡病例双侧肺脏行B超引导下经皮多点穿刺尸检,常规HE染色制片后观察肺组织的病理改变,行电镜检查,并运用逆转录-聚合酶链反应(RT-PCR)方法检测肺组织内2019-nCoV核酸,结合临床资料进行临床病理分析。
10例死亡患者中7例男性,3例女性。平均年龄70(39~87)岁。7例合并基础疾病。平均病程30(16~36)d。9例肺组织肺泡腔内检出程度不一的纤维素性及化脓性炎性渗出物,肺泡腔内透明膜形成。肺泡隔纤维母细胞增生。Ⅱ型肺泡上皮细胞反应性增生和脱落。肺泡腔内见多少不等的巨噬细胞。可见毛细血管透明血栓和血管内混合血栓。部分病例检出急性细支气管炎伴黏膜剥脱及腔内分泌物增多和细支气管上皮化生。该组病例中1例肺泡腔内检出大量细菌(球菌),1例检出大量真菌(酵母型菌体)。9例肺组织2019-nCoV核酸检测阳性,1例阴性。电镜下,Ⅱ型肺泡上皮细胞胞质内检出冠状病毒颗粒。
该组2019-nCoV感染死亡病例肺部病理学改变表现为弥漫性肺泡损伤(DAD),以急性渗出期和机化增生期为主,有肺泡腔内纤维素性渗出物聚集伴透明膜形成,肺泡隔纤维母细胞增生,肺泡上皮细胞损伤伴Ⅱ型肺泡上皮细胞反应性增生和脱落。大部分病例伴多量中性粒细胞和单核细胞浸润,部分病例检出大量细菌及真菌,提示在DAD基础上继发了严重的细菌或真菌感染。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
新型冠状病毒感染疾病(coronavirus disease 2019,COVID-19)是一种新发的由新型冠状病毒(2019-nCoV)感染引起的传染病[1]。截至2020年4月4日,COVID-19已累及全球100多个国家和地区逾100万例感染者,超过5万例死亡[2]。2019-nCoV属于全新的β属冠状病毒,其病毒RNA序列与严重急性呼吸综合征冠状病毒(SARS-CoV)和中东呼吸综合征冠状病毒(MERS-CoV)不同[3]。患者临床主要表现为发热、咳嗽、肌肉酸痛及疲乏等[4],重型患者出现呼吸急促及缺氧,严重者可发展为急性呼吸窘迫综合征、呼吸衰竭而死亡。影像学典型表现为双侧肺部出现斑片状磨玻璃样改变[5]。目前,COVID-19的病理改变报道少,其病理特征尚不明确。我们观察了10例COVID-19死亡患者的肺部病理改变,电镜下进行分析,并通过逆转录-聚合酶链反应(RT-PCR)方法进行2019-nCoV病毒核酸检测,以总结COVID-19的病理改变。
10例患者为武汉地区2020年2—3月期间确诊COVID-19并因COVID-19导致死亡的病例。穿刺取样征得患者本人生前或家属同意,于患者死亡后2 h内行超声引导下经皮肺脏多点穿刺,每点穿取3~5条组织。收集患者临床资料、实验室检查结果及影像学资料。本研究符合中国国家卫生健康委员会发布的法规和赫尔辛基宣言,并经华中科技大学同济医学院附属协和医院医学伦理委员会审批{[2020]伦审字(0043-1)号}。
穿刺组织样本经3.7%中性甲醛固定,石蜡包埋后常规HE制片,每张切片厚4 μm。在光学显微镜下观察组织病理形态,所有的HE切片均由1位主治医师及1位主任医师共同观察,并结合穿刺操作中的B超影像学资料及穿刺中的肉眼所见综合分析。
选用甲醛固定石蜡包埋(FFPE)样本进行PCR检测。试剂盒包括FFPE样品RNA分离试剂盒(货号:ADx-FF04,厦门艾德生物医药科技股份有限公司)及2019-nCoV核酸检测试剂盒(货号:Z-RR-0479-02-25,上海之江生物科技股份有限公司)。Mx3000P即时荧光定量PCR仪为美国安捷伦公司产品。
取肺穿刺组织大小约0.2 cm×0.2 cm,经2.5%戊二醛固定24~48 h后,1%锇酸后固定,梯度脱水,浸透,Epon包埋,半薄切片、普鲁士蓝染色下定位,制成超薄切片,铀铅双重染色后制成铜网,日立HT7800透射电镜观察。
10例患者中7例为男性,3例为女性。首发症状时间从2020年1月24日至2月6日,病程16~36 d,平均病程30 d。年龄39~87岁,平均年龄70岁。7例患者合并基础疾病,其中癌症术后5例、冠心病史2例。所有患者均出现发热、咳嗽、咳痰、肌肉酸痛、寒战、流鼻涕、胸闷或气短等症状。胸部平片提示双侧肺内弥漫分布片状高密度影。所有患者临床均应用抗病毒和抗生素治疗,其中7例应用低剂量激素治疗。10例患者均为临床实验室咽试子2019-nCoV核酸检测阳性。
本组穿刺尸检中,10例患者中除1例肺组织病理改变不明显,其余9例肺组织内均出现不同阶段的弥漫性肺泡损伤改变。同时,病程时间长短与肺泡损伤的主要表现形式有一定相关性。其中病程为16~24 d的4例(例1、3、4和9)以弥漫性肺泡损伤的急性渗出期改变为主。镜下表现为:(1)肺组织明显水肿,肺泡内大量中性粒细胞及单核细胞渗出,可见少量红细胞和纤维素性渗出,未见明显透明膜形成,肺泡隔毛细血管扩张充血,肺泡上皮变性坏死(图1A);(2)肺组织水肿,肺泡腔内多量纤维素性及数量不等的中性粒细胞及单核细胞渗出,早期透明膜形成,肺泡隔纤维素性变性坏死,肺泡上皮变性坏死(图1B);(3)肺泡腔内大量纤维素性及少量中性粒细胞及单核细胞渗出,局部典型透明膜形成,肺泡隔增宽不明显,少量Ⅱ型肺泡上皮细胞反应性增生(图1C);(4)部分肺泡腔塌陷,以肺泡隔纤维素沉着为主伴局部纤维化,肺泡腔内见巨噬细胞聚集,无明显渗出,少量Ⅱ型肺泡上皮细胞反应性增生(图1D);(5)肺泡腔见纤维素渗出伴典型透明膜形成,中性粒细胞及单核细胞渗出不明显,肺泡隔增宽伴少量纤维母细胞增生,少量Ⅱ型肺泡上皮细胞反应性增生(图1E);(6)肺泡腔大小不等,肺泡腔见大量纤维素性渗出并形成纤维素球结构,局部纤维素性渗出内出现纤维母细胞,中性粒细胞及单核细胞渗出不明显,肺泡隔增宽伴少量纤维母细胞增生,少量Ⅱ型肺泡上皮细胞反应性增生(图1F)。且以上病理改变在各个病例穿刺肺组织的不同区域呈现出非均一性。而病程为27~36 d的5例(例2、6、7、8和10)更多以弥漫性肺泡损伤的机化增生期改变为主。镜下主要表现为肺泡结构重建,肺泡隔明显增宽伴纤维化及大量纤维母细胞增生,肺泡腔纤维素渗出及透明膜被增生的纤维母细胞替代,并入肺泡隔,可见透明膜残余(图2A)或者完全被纤维母细胞替代(图2B),部分肺泡腔内形成纤维母细胞栓(图2C),局部肺组织实性变伴少量单核细胞、小淋巴细胞和浆细胞浸润(图2D)。弥漫性肺泡损伤机化增生期Ⅱ型肺泡上皮细胞反应性增生更为明显,部分肺泡上皮细胞脱落,个别肺泡上皮细胞明显增大,胞核增大,可见明显核仁,具有丰富的双嗜性颗粒状胞质(图2E);部分肺泡上皮细胞形成合体状多核细胞(图2F)。所有病例中均未查见典型的病毒包涵体。


在本组COVID-19死亡病例多点穿刺取材的肺组织中,每一病例各穿刺组织的病理变化并不完全一致。在10例肺组织中,9例出现不同程度的Ⅱ型肺泡上皮细胞反应性增生,8例肺泡隔出现纤维母细胞增生,8例肺泡腔内出现多少不等的中性粒细胞和单核细胞渗出,7例肺泡腔内出现纤维素性渗出,其中6例检出局部或者广泛的透明膜形成。8例多点穿刺的肺组织内检出多少不等结构相对正常,肺泡损伤改变不明显的肺组织。其中例5肺组织镜下肺泡上皮损伤和反应性增生改变均不明显,仅表现为肺泡隔少量单核巨噬细胞浸润,肺泡腔内少量巨噬细胞,肺泡腔内无明显渗出物(图3A和图3B)。
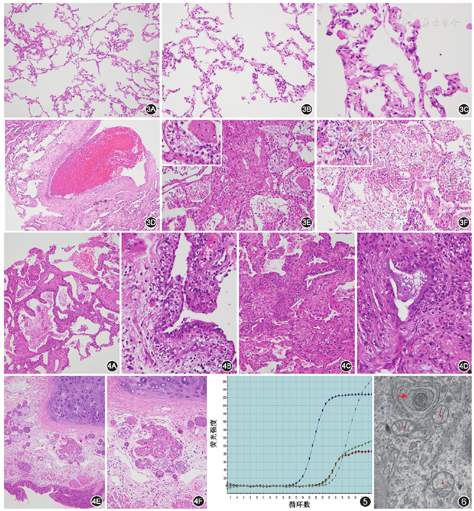

本组病例镜下观察血管内皮损伤及血管炎不明显,2例出现毛细血管透明血栓(图3C),1例出现静脉内混合血栓(图3D)。所有病例肺泡腔内均出现多少不等的巨噬细胞,局部巨噬细胞聚集成团,可形成多核巨细胞。肺组织肺泡隔易见散在的巨核细胞(图1C及图1F;图2A)。肺间质内以中性粒细胞和单核细胞浸润为主,而淋巴细胞和浆细胞少见。2例检出大量病原体,其中细菌感染(例7)镜下表现为肺泡隔大量纤维母细胞增生,局灶见少量残余纤维素性渗出,未检出典型透明膜,同时在肺泡腔内出现大量中性粒细胞和单核细胞渗出以及大量球形细菌菌体(图3E);而真菌感染(例8)镜下表现为肺泡隔大量纤维母细胞增生,未检出纤维素性渗出及典型透明膜,同时部分肺泡腔内出现中性粒细胞和单核细胞渗出以及大量酵母型真菌菌体(图3F)。10例组织中均检出多少不等的细支气管组织,1例出现周围细支气管上皮化生(图4A),2例出现急性细支气管炎伴黏膜剥脱(图4B),2例出现细支气管局灶鳞状上皮化生(图4C),2例出现细支气管黏液细胞数目增多伴腔内分泌物潴留(图4D),大部分细支气管黏膜上皮及纤毛结构存在,部分细支气管内分泌物增多。10例组织中4例镜下检出支气管组织,支气管黏膜结构未破坏,间质水肿,少量中性粒细胞和单核细胞浸润,黏膜下支气管腺结构未见明显破坏,其中3例支气管黏膜下腺腺腔内分泌物潴留(图4E和图4F)。肺组织石蜡包埋样本进行2019-nCoV核酸检测,结果显示9例阳性(图5),1例(例9)阴性。病例的临床病理特征见表1。
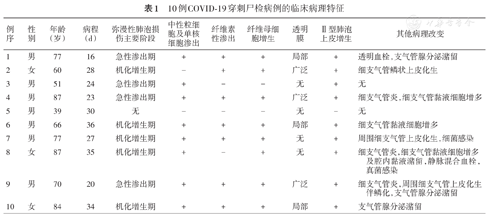
10例COVID-19穿刺尸检病例的临床病理特征
10例COVID-19穿刺尸检病例的临床病理特征
| 例序 | 性别 | 年龄(岁) | 病程(d) | 弥漫性肺泡损伤主要阶段 | 中性粒细胞及单核细胞渗出 | 纤维素性渗出 | 纤维母细胞增生 | 透明膜 | Ⅱ型肺泡上皮增生 | 其他病理改变 |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 男 | 77 | 16 | 急性渗出期 | + | + | + | 局部 | + | 透明血栓,支气管腺分泌潴留 |
| 2 | 女 | 60 | 28 | 机化增生期 | - | + | + | 广泛 | + | 细支气管鳞状上皮化生 |
| 3 | 男 | 51 | 24 | 急性渗出期 | + | - | - | 无 | + | 无 |
| 4 | 男 | 87 | 23 | 急性渗出期 | + | + | + | 广泛 | + | 细支气管炎,细支气管黏液细胞增多 |
| 5 | 男 | 39 | 30 | 无 | - | - | - | 无 | - | 无 |
| 6 | 男 | 66 | 36 | 机化增生期 | + | + | + | 局部 | + | 细支气管黏液细胞增多 |
| 7 | 男 | 77 | 27 | 机化增生期 | + | + | + | 无 | + | 周围细支气管上皮化生,细菌感染 |
| 8 | 女 | 87 | 35 | 机化增生期 | + | - | + | 无 | + | 细支气管炎,细支气管黏液细胞增多及腔内黏液潴留,静脉混合血栓,真菌感染 |
| 9 | 男 | 70 | 20 | 急性渗出期 | + | + | + | 广泛 | + | 细支气管炎,周围细支气管上皮化生伴鳞化,支气管腺分泌潴留 |
| 10 | 女 | 84 | 34 | 机化增生期 | + | + | + | 局部 | + | 支气管腺分泌潴留 |
电镜下可见大部分肺泡腔开放不良,灶性肺泡上皮细胞坏死脱落。Ⅱ型肺泡上皮细胞明显肿胀,胞质内见多量直径75~100 nm皇冠状病毒颗粒,细胞表面活性物质分泌减少(图6)。肺泡间隔毛细血管可见大量红细胞淤积,部分毛细血管腔完全闭锁。
本研究纳入病例从出现首发症状到死亡的时间均大于14 d,大部分为男性,年龄较大且多合并基础疾病。10例病例中,9例肺组织标本内RT-PCR方法检测出2019-nCoV核酸阳性。透射电镜观察到肺泡上皮胞质内存在冠状病毒颗粒。这些结果提示直到患者死亡,大部分患者肺组织内仍持续存在2019-nCoV。而例9病程20 d,镜下肺泡腔内大量纤维素性渗出伴大量透明膜形成,形态学改变符合弥漫性肺泡损伤急性渗出期改变,但反复检测多个样本,2019-nCoV核酸均为阴性,分析原因可能是该患者体内病毒已大部分清除,残余病毒载量低于检测下限,也可能穿刺组织局限,未能取到病毒载量高的肺组织。
弥漫性肺泡损伤是COVID-19导致临床出现急性呼吸窘迫综合征的病理形态基础。弥漫性肺泡损伤根据病程变化发展可大致分为急性渗出期(1~7 d)、机化增生期(8~20 d)和纤维化期(>20 d)[6]。本组病例病程16~36 d,在<25 d病程的病例中,镜下主要为纤维素性炎或者化脓性炎的急性渗出期改变;而>25 d病程的病例中,镜下以机化性炎为主的弥漫性肺泡损伤机化增生期改变为主。弥漫性肺泡损伤不同阶段的病理改变存在不同程度的重叠,而本组病例镜下未观察到致密的胶原纤维形成,形成终末期蜂窝肺的纤维化期特征性改变。这些病理改变提示2019-nCoV导致的弥漫性肺泡损伤病理进程可能延后,而且不同部位的弥漫性肺泡损伤病理阶段改变也不完全同步。COVID-19肺组织出现不同程度的Ⅱ型肺泡上皮细胞增生及脱落,部分肺泡上皮细胞明显增大,胞核大,核仁明显,具有丰富的双嗜性颗粒状胞质,可形成上皮源性合体状多核细胞,这些病理改变在机化增生期更为明显。虽然透射电镜结果显示2019-nCoV直接感染肺泡上皮,但所有病例镜下均未检出典型病毒包涵体,提示2019-nCoV不易形成典型的病毒包涵体。2019-nCoV感染导致的肺部病理改变与SARS-CoV和MERS-CoV感染导致肺病理改变相似[7,8,9,10],均属于非特异性的弥漫性肺泡损伤的病理模式,与疾病病程相关。
弥漫性肺泡损伤急性渗出期的病理机制是肺泡上皮屏障、毛细血管屏障和肺泡表面活性物的损伤,以及中性粒细胞及单核细胞导致急性炎性损伤[11,12]。在正常肺泡以提供气体交换的表面和防止液体外渗屏障的Ⅰ型肺泡上皮细胞为主和少量具有再生、吸收肺泡腔内液体和产生表面活性物功能的Ⅱ型肺泡上皮细胞[13]。2019-nCoV感染损伤肺泡上皮和毛细血管屏障,导致肺泡腔大量浆液性纤维素性渗出,进而形成肺泡腔内透明膜,阻碍气体交换而出现急性呼吸窘迫综合征。弥漫性肺泡损伤急性渗出期肺泡腔大量渗出及Ⅱ型肺泡上皮细胞损伤改变肺泡表面活性物组成和形态,导致肺泡稳定性下降和塌陷,阻碍气体交换,同时影响肺泡表面活性物免疫作用[14,15]。
弥漫性肺泡损伤急性渗出期后,经过治疗,部分患者肺功能恢复,部分患者进展为机化增生期。机化增生期的病理机制是人体对损伤的不良修复导致肺泡隔及肺泡腔内大量纤维母细胞增生和Ⅱ型肺泡上皮反应性增生及不典型改变,肺泡结构重建[11,12]。机化增生期后,病理进程将不可逆进展为纤维化期。在纤维化期,增生的纤维组织形成致密的纤维胶原组织,最终形成蜂窝肺改变。我们观察到本组病例弥漫性肺泡损伤从急性渗出期到机化增生期的连续组织形态谱系改变。弥漫性肺泡损伤急性渗出期进展为机化增生期的危险因素和机制尚待进一步研究。
目前临床主要通过机械通气和体外膜肺氧合(ECMO)治疗急性呼吸窘迫综合征。在机械通气过程中,充满渗出物或塌陷的肺泡腔在呼吸周期内不能膨胀,不具备肺泡换气功能,反而高潮气量的机械通气导致肺泡过度扩张会进一步加剧肺损伤。及时进行ECMO支持治疗可以防止长时间高潮气量的机械通气造成肺损伤。机械通气和ECMO治疗可以缓解急性呼吸窘迫综合征的临床表现,但我们需要更多地从病理机制上抑制弥漫性肺泡损伤的进程。
同时,我们观察到8例肺泡腔内出现多少不等的中性粒细胞和单核细胞渗出,局部可出现大量中性粒细胞及单核细胞渗出形成化脓性炎改变。中性粒细胞浸润是急性肺损伤的病理机制之一[16],类似病理改变在SARS-CoV感染和流感肺炎中也有提及[7,8,9,17]。在弥漫性肺泡损伤早期可出现肺泡上皮变性坏死及肺泡隔毛细血管屏障损伤,肺泡腔内变性坏死细胞碎屑和纤维素性渗出,促使大量中性粒细胞及单核细胞渗出的急性炎性反应。中性粒细胞和单核细胞可清除和溶解细胞碎屑和纤维素性渗出。我们观察到中性粒细胞及单核细胞渗出越多,纤维素网形成越稀疏。除了2例镜下检出明确细菌或者真菌,这些病理改变表明2019-nCoV感染可出现大量中性粒细胞及单核细胞浸润,形成化脓性炎改变并抑制透明膜形成。但我们并不能完全排除继发感染导致大量中性粒细胞及单核细胞渗出的可能,需进一步研究证实。COVID-19肺组织内淋巴细胞和浆细胞浸润相对少见,结合临床血象持续存在中性粒细胞升高及淋巴细胞减少,2019-nCoV感染可能抑制或者直接破坏免疫系统。我们还发现COVID-19的肺组织肺泡间隔出现数量不等的巨核细胞。新近研究发现肺是终末血小板生成的主要部位和具有相当造血潜能的器官[18],结合患者存在低血小板血症表现,肺组织内巨核细胞在COVID-19进展中的作用和意义值得深入研究。
本组例5为39岁男性,胃癌术后1年,临床表现为发热(38.7 ℃)、胸闷、肌肉酸痛和纳差等症状,多次咽试子2019-nCoV核酸检测阳性,影像学提示双肺散在片状模糊影。镜下观察该例肺组织内肺泡结构相对正常,肺泡隔未明显增宽,仅少量单核细胞、巨噬细胞浸润,肺泡腔内无明显渗出,可见少量散在增大的巨噬细胞,Ⅱ型肺泡上皮细胞增生不明显,组织形态未提示弥漫性肺泡损伤改变。这个病例可能代表部分年轻患者COVID-19肺组织病理改变。
我们观察到1例合并细菌感染(球菌),1例合并真菌感染(酵母型菌体),具体的感染病菌分类正在进一步明确。其中合并细菌感染者(例7)为病程27 d的77岁男性,面部皮肤癌术后2年,入院以来一直应用抗生素预防感染,但患者仍出现继发感染。而合并真菌感染者(例8)为病程35 d的87岁女性,有冠心病和2型糖尿病病史,无癌症病史,临床未提示真菌感染和应用抗真菌药治疗。有研究表明急性呼吸窘迫综合征患者的晚期死亡主要与感染相关脓毒血症或多器官衰竭有关,而非呼吸衰竭[19]。对COVID-19继发感染的预防和治疗是临床治疗和降低死亡风险的重要方面。
目前,已有少量文献报道COVID-19患者的肺组织病理改变。Xu等[20]报道COVID-19出现弥漫性肺泡损伤,透明膜形成,肺泡上皮脱屑性改变,形成合体状多核细胞伴肺泡上皮不典型增大。Tian等[21]报道2例COVID-19无症状期活检病例,肺组织表现为水肿蛋白样渗出物,透明膜不明显。姚小红等[22]报道的3例COVID-19尸检中,肺泡腔浆液和纤维素渗出较轻,透明膜较少。况东等[23]报道1例2019-nCoV感染合并肺癌的无症状患者,肺组织内广泛的肺间质性炎性病变,肺泡腔内大量巨噬细胞、泡沫细胞聚集。这些已报道的COVID-19病例病程较短,多表现为早期弥漫性肺泡损伤改变,部分肺病理改变与本组病例中的局部肺组织病理改变一致。相比之下,我们这组病例的病程更长,病理形态上更多表现为弥漫性肺泡损伤机化增生期改变,提示病程较长的COVID-19患者肺组织病理变化。
综上所述,本研究发现COVID-19死亡患者肺组织出现弥漫性肺泡损伤,是形成急性呼吸窘迫综合征的病理形态学基础。弥漫性肺泡损伤以急性渗出期和机化增生期改变为主,肺泡腔内大量纤维素性渗出伴透明膜形成,肺泡隔大量纤维母细胞增生。Ⅱ型肺泡上皮细胞反应性增生及脱落,可见肺泡上皮巨细胞及合体状多核细胞形成,典型病毒包涵体不明显。病变内中性粒细胞、单核细胞和巨噬细胞浸润常见,淋巴细胞和浆细胞浸润少见。部分病例出现继发感染。消除体内2019-nCoV、清除肺泡腔内渗出物、重建肺泡上皮及毛细血管屏障、控制急性炎性反应、抑制纤维母细胞不良修复及预防继发感染对COVID-19临床治疗和预后具有重要作用。
所有作者均声明不存在利益冲突



























